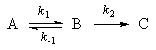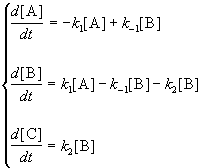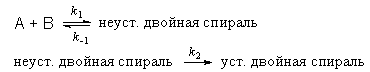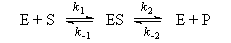Для большинства сложных реакций, включающих несколько элементарных стадий, кинетические уравнения обычно настолько сложны, что их можно точно решить только численным интегрированием. В то же время, разные константы скорости, входящие в эти уравнения, отличаются друг от друга во много раз, что позволяет при решении кинетических уравнений использовать приближенные методы.
Мы рассмотрим два основных метода — метод квазистационарных (иногда просто — стационарных) концентраций и квазиравновесное приближение — на примере кинетической схемы:
1. Приближение квазистационарных концентраций применяют в том случае, когда в ходе реакции образуются неустойчивые промежуточные вещества. Если скорость распада этих веществ намного превышает скорость их образования, то концентрация веществ в любой момент времени мала. Раз мала концентрация, то мала и скорость ее изменения, которую приближенно принимают равной 0. Условие квазистационарности позволяет выражать концентрацию промежуточных веществ через концентрации исходных веществ и тем самым упрощать кинетические уравнения.
Для приведенной выше схемы система кинетических уравнений имеет вид:
Если k2 >> k1, то B — неустойчивое промежуточное вещество, концентрацию которого можно считать квазистационарной:
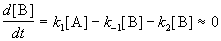
откуда 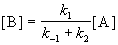
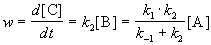
Таким образом, мы выразили скорость реакции через концентрацию исходного вещества, установили порядок реакции (первый) и выразили эффективную константу скорости через константы скорости отдельных элементарных реакций.
Приближение квазистационарных концентраций обычно применяется к реакциям с участием свободных радикалов, которые представляют собой реакционноспособные неустойчивые частицы.
2. Квазиравновесное приближение применяют в том случае, когда одна из реакций — обратимая, причем равновесие быстро устанавливается и медленно разрушается. Для приведенной выше схемы это означает, что k2 . + H . + M (k1)
H . + п-H2 
H . + H . + M 
Используя метод стационарных концентраций, получите выражение для скорости конверсии пара-водорода.
Решение. Из второго уравнения следует, что скорость образования орто-водорода равна:
Для того, чтобы решить задачу, надо исключить из этого выражения концентрацию неустойчивого вещества — атомов водорода. Это можно сделать, приняв, что она не изменяется со временем:
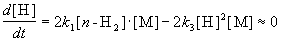
откуда 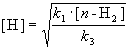
При оценке скорости изменения концентрации [H] мы учли, что в первой и третьей реакциях образуются и расходуются по два атома H, а во второй реакции число атомов H не изменяется. Подставляя концентрацию [H] в выражение для скорости реакции, получаем окончательный результат:
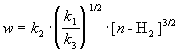
Из этого результата мы видим, как в сложной реакции может получиться дробный порядок.
Пример 6-2. Механизм ренатурации ДНК из двух ветвей спирали имеет вид:
Предполагая, что первая стадия — быстрая, а вторая — медленная, выведите уравнение для скорости образования устойчивой двойной спирали и выразите общую константу скорости реакции через константы скорости элементарных стадий.
Решение. Условия задачи позволяют применить квазиравновесное приближение. Концентрация неустойчивой двойной спирали в этом приближении равна:
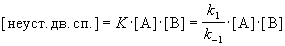
Скорость реакции определяется скоростью второй стадии:
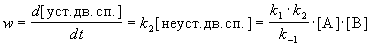
Образование устойчивой двойной спирали ДНК — реакция второго порядка с эффективной константой скорости k = k1 . k2 / k-1.
6-1. Механизм некоторой ферментативной реакции имеет вид:
Используя метод квазистационарных концентраций для комплекса фермента с субстратом, выразите скорость образования продукта через текущие концентрации фермента, субстрата и продукта.(ответ)
6-2. Для реакции NO2Cl 
NO2Cl 
NO2Cl + Cl . 
Используя метод квазистационарных концентраций, выведите уравнение для скорости разложения NO2Cl.(ответ)
6-3. Для реакции синтеза иодоводорода из простых веществ H2 + I2 
I2 
2I . 
2I . + H2 
Используя квазиравновесное приближение, выведите уравнение для скорости образования HI и покажите, что данная реакция имеет второй порядок.(ответ)
6-4. В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
активация: A + A 
дезактивация: A + A* 
распад: A* 
Используя метод квазистационарных концентраций, выведите уравнение для скорости мономолекулярной реакции и определите порядок реакции при больших и малых концентрациях [A].(ответ)
6-5. Для тримолекулярной реакции 2NO + O2 
2NO 
(NO)2 + O2 
Определите порядок суммарной реакции, предполагая, что первая стадия — быстрая, а вторая — медленная.(ответ)
6-6. Конденсация ацетона (CH3)2CO в водном растворе катализируется основаниями, которые обратимо реагируют с ним с образованием карбаниона C3H5O — . Карбанион реагирует с молекулой ацетона и дает продукт реакции. Упрощенный механизм выглядит так:
AH + B 
A — + BH + 
A — + AH 
Используя метод стационарных концентраций, найдите концентрацию карбаниона и выведите уравнение для скорости образования продукта.(ответ)
6-7. Составьте кинетические уравнения для следующего механизма газофазной реакции:
A 

Определите скорость образования продукта в приближении квазистационарных концентраций. Покажите, что при высоких давлениях реакция может протекать по первому порядку, а при низких давлениях — по второму порядку.(ответ)
6-8. Химическая реакция N2O 
N2O + M 
N2O* 
N2O* + M 
N2O + O . 
Считая концентрации N2O* и O . стационарными, найдите выражение для скорости распада N2O.(ответ)
6-9. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) 
N2O5 
NO2 + NO3 
NO2 + NO3 
NO + N2O5 
6-10. Составьте кинетическое уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2N2O5(г) 
N2O5 
NO2 + NO3 
NO2 + NO3 
NO + NO3 
Указание. Интермедиаты — NO и NO3.(ответ)
6-11. Дана схема цепной реакции:
AH 
A . 
AH + B . 
A . + B . 
Назовите стадии зарождения, развития и обрыва цепи. Используя метод квазистационарных концентраций, покажите, что образование продукта P описывается кинетическим уравнением первого порядка.(ответ)
6-12. Дана кинетическая схема:
CH4 + M 
CH3 . + CH4 
H . + CH4 
H . + CH3 . + M 
(M — инертная молекула). Используя метод квазистационарных концентраций, выразите скорость образования этана через концентрацию метана.(ответ)
6-13. Реакция разложения бромметана 2CH3Br 
CH3Br 
CH3 . + CH3Br 
Br . + CH3Br 
2CH3 . 
Используя метод стационарных концентраций, найдите выражение для скорости образования этана.(ответ)
6-14. Термическое разложение углеводорода R2 протекает по следующему механизму:
R2 
R . + R2 
R’ . 
2R . 
где R2, PA, PB — устойчивые углеводороды, R . и R’ . — радикалы. Найдите зависимость скорости разложения R2 от концентрации R2.(ответ)
6-15. Дана кинетическая схема разложения ацетальдегида:
CH3CHO 
CH3 . + CH3CHO 
CH2CHO . 
CH3 . + CH3 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования метана и скорости расходования ацетальдегида.(ответ)
6-16. Реакцию радикального дегидрирования этана можно описать с помощью механизма Райса-Герцфельда, который включает следующие стадии:
инициирование: CH3CH3 
развитие цепи: CH3 . + CH3CH3 
CH3CH2 . 
H . + CH3CH3 
обрыв цепи: H . + CH3CH2 . 
Найдите уравнение для скорости образования этилена, если константа k1 мала. Как можно изменить условия, чтобы изменился порядок?(ответ)
6-17. Дана кинетическая схема дегидрирования этана:
C2H6 
CH3 . + C2H6 
C2H5 . 
H . + C2H5 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования этилена.(ответ)
6-18. Химическая реакция 2C2H6 
C2H6 
H . + C2H6 
C2H5 . + C2H6 
2C2H5 . 
Используя метод стационарных концентраций, получите выражение для скорости образования бутана.(ответ)
6-19. Дана кинетическая схема радикального хлорирования тетрахлорэтилена в растворе CCl4:
Cl2 
Cl . + C2Cl4 
C2Cl5 . + Cl2 
2C2Cl5 . 
Используя приближение стационарных концентраций, получите выражение для скорости образования гексахлорэтана.(ответ)
6-20. Реакция образования фосгена CO + Cl2 
Cl2 
2Cl . 
CO + Cl . 
COCl . 
COCl . + Cl2 
Используя метод стационарных концентраций, найдите выражение для скорости образования фосгена.(ответ)


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Видео:ЛЕКЦИЯ №2 || Химическая кинетика || Скорость реакции, Закон действия масс, Порядок реакцииСкачать

Реакция образования фосгена
7. Реакция образования фосгена
протекает как неразветвленная цепная реакция, и при значительных степенях превращения ее скорость определяется опытным выражением
Выведите кинетическое уравнение для скорости образования фосгена и покажите, при каких условиях это уравнение согласуется с опытными данными, используя цепной механизм процесса
Cl· + Cl· + M → Cl2 + M
8*. Диметиловый эфир диссоциирует в определенных условиях с образованием этана и этанала (C2H5)2O → C2H6 + CH3CHO. В этом случае наблюдаемый порядок реакции равен 1. Покажите на основании предложенного цепного механизма процесса, что указанная реакция действительно имеет первый порядок
9*. Для эквимолярной смеси водорода и дейтерия Н2 + D2 → HD были получены следующие данные для начальных давлений р0 смеси при 1000 К:
А. Определите общий порядок этой реакции.
Б. Предложен следующий цепной механизм процесса:
Получите кинетическое уравнение реакции. Удовлетворяет ли рассматриваемый механизм полученному в п. а) значению общего порядка реакции?
Ответ: А. n= 1,5. Б. υ=К(PH2) 1,5
10*. Известно, что скорость реакции 2O3 →3O2 существенно увеличивается в присутствии Cl2 . Предложен следующий цепной механизм процесса
Радикалы ClO·, образующиеся по стадии (1), разрушаются без участия в продолжении цепи.
Б. Получите выражение для скорости образования кислорода, пренебрегая О2, полученными по стадии (4). Какова роль хлора?
В. Оцените среднюю длину цепи.
Г. Выразите опытную энергию активации через Еi различных элементарных стадий.
11*. Для реакции в газовой фазе H2 + NO2 = H2O + NO предложен следующий цепной механизм
Покажите, что этот механизм позволяет получить кинетическое уравнение вида
Объясните, почему это уравнение не включает концентрацию NO2, который участвует стадии инициирования.
[NO2] распределяется между стадиями инициирования и обрыва
12*. Гексаметилсилан Me3SiSiMe3 (вещество А) изомеризуется в метантриметилсилил (вещество В). Этот процесс ускоряется в присутствии паров толуола. Был предложен следующий механизм реакции для интервала температур 700 – 800 К
А. Получите выражение для скорости образования вещества В в зависимости от концентрации А, толуола и констант скорости различных стадий процесса.
Б. Оцените аррениусовскую энергию активации при образовании продукта В через энергии активации элементарных стадий, считая, что k4 » k-3 [PhMe].
13. Для реакции образования HBr из H2 и Br2 предложен цепной механизм реакции
Br2 +M → 2Br· + M E1 = 192,9 кДж · моль -1
Br + H2 → HBr + H E2 = 73,6 кДж · моль -1
H + Br2 → HBr + Br E3 = 3,8 кДЖ · моль -1
H + HBr → H2 + Br E4 = 3,8 кДж · моль -1
Где М – любая молекула в газовой фазе. Вычислите значение опытной энергии активации суммарный реакции H2 + Br2 → 2HBr, если известно кинетическое уравнение для скорости образования HBr
Где k = 2k2(k1⁄ k5 ) ½ и k′ = —. Каким образом константа k′ зависит от k3
Ответ: Еа= 170 кДж ·моль -1 ; k′ практически не зависит от температуры
14.* Для реакций термолиза этанала в газовой фазе CH3CHO → CH4 + CO предложен следующий цепной механизм
А. Получите кинетическое уравнение для скорости расходования CH3CHO и образования различных продуктов.
Б. Как изменятся выражения для скорости расходования СН3СНО и образования продуктов в случае длинных цепей, т.е. когда k1 « ki?
15. При изучении реакции хлорирования этана C2H6 + Cl2 → C2H5Cl + HCl (V, T=const) экспериментально показано, что реакция имеет порядок а по Cl2 и b по C2H5. На основании предложенного механизма процесса
и используя принцип квазистационарных концентраций по отношению к радикалам Cl· и ·C2H5, найдите :
а) кинетическое уравнение для скорости образования НСl с указанием численных значений а и b для опытного уравнения;
б) численное значение опытной константы скорости и укажите ее размерность, если известны значения констант элементарных стадий при температуре 575 К: k1 / k4 = 5,30× 10 -23 M, k2 = 4,19 · 10 10 л · моль -1 · с -1 , k3 = 5,27 · 10 9 л · моль -1 × с -1 .
б) kоп= 0,305 л 1/2 ·моль -1/2 ·с -1
16.* Для объяснения пиролиза метоксиметана CH3OCH3 предложен цепной механизм
А. Выразите концентрации всех радикалов через [CH3OCH3] и ki различных элементарных стадий.
Б. Выведите кинетическое уравнение для скорости реакции через убыль исходного вещества либо через образование основных продуктов (CH4 и HCHO). При каких условиях эти выражения для скорости реакции совпадают? Какая стадия процесса является лимитирующей?
dt dt dt при условии, что
17.* Экспериментальное изучение термического разложения F2O в диапазоне начальных давлений (1- 100 кПа) и температурном интервале (500 – 580 К) привело к уравнению вида
А. С помощью цепного механизма процесса разложения F2O
покажите, что кинетическое уравнение для скорости расходования F2Oхорошо согласуется с опытным выражением.
Б. Определите значение энергии активации стадии (2) и энтальпии диссоциации связи (O-F) в F2O с учетом разумной оценки энергии активации
тримолекулярной стадии (4) и численных значений констант,
kI = 7,8 · 10 13 exp (- ———) [л·моль -1 ·с -1 ];
kII = 2,3·10 10 exp (- ———)[л ½ ·моль -½ ·с -1 ];
а также для Тср = 540 К.
57,2 кДж·моль -1 , Е(О-F)≈ 221 Дж·моль -1
Глава2. Кинетика фотохимических реакций
2.1 Вопросы и задания для самоконтроля
1. Дайте определение термина «фотохимия» и укажите предмет исследований.
2. Объясните, в чем заключается причина протекания фотохимических реакций, часто невозможных при термическом воздействии на ту же реакционную систему?
3. Приведите примеры известных фотохимических процессов.
4. Сформулируйте закон Буге-Ламберта и приведите его математическую формулировку.
5. В чем заключается закон Бера?
6. Сформулируйте объединенный закон Буге-Ламберта-Бера и приведите его математическую формулировку.
7. В чем заключается первый закон фотохимии?
8. Приведите математическую формулировку закона Вант-Гоффа.
9. Проанализируйте случаи, когда Фотохимическая реакция имеет первый или нулевой порядок по концентрации поглощающего свет вещества.
10. Сформулируйте закон Эйнштейна-Штарка. В чем заключается его современная трактовка?
11. Что называют общим квантовым выходом ф фотохимической реакции? Укажите интервал принимаемых ф значений, ответ поясните.
12. Дайте определение первичного квантового выхода γ׳׳1. Может ли он принимать значения больше единицы?
13. Что называют вторичным квантовым выходом γ2? Какая существует связь между γ2, ф и γ1?
14. Какая величина носит название 1 Эйнштейн? Зависит ли она от природы излучения?
15. Расположите в порядке возрастания энергетической активности лучи разных участков спектра: зеленые, красные, ультрафиолетовые, желтые, инфракрасные.
16. в чем заключается начальная стадия поглощения света? Какова ее длительность?
17. Перечислите шесть возможных направлений второй стадии первичных процессов.
18. Охарактеризуйте направления, на которых происходят первичные химические процессы. Приведите примеры.
19. Какое состояние молекулы называется синглетным? Укажите временной интервал жизни возбужденного синглета.
20. Какие возможны другие состояния системы? Укажите временной интервал жизни возбужденного триплета.
21. Перечислите процессы, которые относятся к безызлучательным. В чем заключается процесс колебательной релаксации, и какова его длительность?
22. Охарактеризуйте процессы внутренней конверсии и интеркомбинационного перехода. Какова их длительность? Может ли триплетное состояние быть более реакционноспособным, чем основное синглетное? Ответ мотивируйте.
23. Какой процесс называют флуоресценцией? Для каких молекул она характерна? Каков временной интервал жизни для флуоресценции?
24. Какой процесс называют фосфоресценцией? Укажите временной интервал жизни для фосфоресценции.
25. Поясните термин «фотосенсибилизация». Приведите примеры.
26. какие реакции относят к вторичным процессам?
27. Какие характеристики фотохимических реакций определяют при кинетических исследованиях флуоресценции и фосфоресценции?
28. В чем заключается механизм Штерна-Фольмера? Какие первичные процессы учитываются в этом механизме?
29. Какую величину называют тушением? Покажите графически, на основании схемы Штерна-Фольмера, какие величины могут быть определены при экспериментальном исследовании?
30. Каким образом с помощью схемы Штерна-Фольмера, можно рассчитать первичный квантовый выход?
31. Какие существуют пути возбуждения фотопроцессов?
32. * Выведите уравнения для квантовых выходов флуоресценции и реакций из синглетного возбужденного состояния простейшей кинетической схемы.
33. * Получите соотношения для квантовых выходов фосфоресценции и реакции из триплетного возбужденного состояния простейшей кинетической схемы.
34. *Какие существуют пути для оценки эффективной энергии активации безызлучательных процессов?
35. Каким образом находят энергию активации односторонней реакции из синглетного состояния?
36. * Каким способом (и при каких условиях) можно оценить энтальпию реакции в возбужденном состоянии?
37. Поясните термины «динамическое тушение» и «статическое тушение». Каковы критерии выбора тушителей синглетных и триплетных возбужденных состояний?
38. * Получите для простейшей схемы с учетом процесса тушения синглетного возбужденного состояния уравнение Штерна-Фольмера. Какую величину называют константой тушеня?
39. * Получите уравнение Штерна-Фольмера для кинетической схемы процесса фотосенсибилизации.
40. Возможно ли протекание фотопроцесса, если энергия возбуждения сенсибилизатора значительно ниже энергии возбуждения реагента?
2.2.1Энергия активации фотохимической реакции равна 30 ккал ·моль -1 . Какова должна быть минимальная длина волны света для того, чтобы инициировать эту реакцию? Чему равна частота этого света?
Решение: Находим частоту света по формуле
Е 30 ккал·моль -1 · 4,189 Дж
NАh (6,022·10 23 моль -1 )(6,626·10 -34 Дж·с)
Для того, чтобы найти длину волны, находим волновое число
ν (3,15·10 14 с -1 )(10 -2 м·см -1 )
ω = —— = ——————————— = 10500 см -1
2.2.2. Свет с длиной волны 436 нм проходил в течение 900 с через раствор брома и коричной кислоты в CCl4. Среднее количество поглощенной энергии 1,919 ·10 -3 Дж·с -1 . В результате фотохимической реакции количество брома уменьшилось на 3,83·10 19 молекул.
Чему равен квантовый выход? Предложите механизм реакции, объясняющий квантовый выход.
Решение: В результате реакции поглотилось
1,919·10 -3 · 900 1,73 Дж
световой энергии. Энергия одного моля квантов составляет
Е = NАhс/λ = 6,022·10 23 моль -1 ·6,626·10 -34 Дж·с·3·10 8 м·с -1 /436·10 -9 м=
Число молей поглощенных квантов смета:
n(hν) = 1,73/ 2,74·10 5 = 6,29·10 -6 .
Квантовый выход реакции равен
γ = n(Br2)/n(hν) = (3,83·10 19 /6,022·10 23 )/ 6,29·10 -6 = 10
Такое значение квантового выхода характерно для цепной реакции, механизм которой может быть следующим6
Br2 + hν → Br + Br (зарождение цепи)
Br + Br → Br2 (обрыв цепи) .
2.2.3.Предложен следующий механизм фотохимической реакции
Найдите выражение для квантового выхода продукта В.
Ia – интенсивность излучения.
Решение: Используя принцип квазистационарных концентраций можно записать
подставляя [А*] из (2), получим
По определению квантовый выход равен
2.2.4. Реакция хлорирования метана Cl2 + CH4 → CH3Cl + HCl допускает существование следующего механизма
·CH3 + HCl → CH4 + Cl· продолжение
Cl· + Cl· + М → Cl2 + М обрыв
(М – некоторая молекула реакционной смеси или стенка сосуда .)
А) определите, какой должна быть длина волны светового излучения на первой стадии, если известно, что энтальпия диссоциации Cl2 равна 242,5 кДж · моль -1 ;
Б) полагая, что скорость диссоциации молекулы хлора пропорциональна интенсивности I используемого электромагнитного излучения, получите аналитические выражения для концентрации свободных радикалов [Cl·] и [·CH3] в момент времени t.
Решение:а) находим значение энергии, необходимой для диссоциации одной молекулы Cl2
Е = ——— = ————— = 4,026·10 -19 Дж · моль -1 .
Затем рассчитываем искомую величину длины волны
hс 6,626·10 -34 · 3·10 8
λ = —— = ———————— = 4,993·10 -7 м
б) применим принцип квазистационарных концентраций к радикалам [Cl·] и [·CH3]:
Суммируя выражения (1) и (2), получаем
откуда находим искомую концентрацию Cl·
Концентрация [·CH3] рассчитывается из уравнения (1)
Заменяя [ Cl· ] из выражения (4) и полагая k2k׳ = k׳׳, получаем
2.2.5.Фотолиз Cr(CO)6 d в присутствии вещества М может протекать по следующему механизму:
Предполагая, что интенсивность поглощенного света мала:
Определите численное значение величин, соответствующих этой энергии:
А) частота света;
Б) волновое число;
В) длина волны, нм;
Ответ: 3.16·10 14 с -1 ; 10500 см -1 ; 952 нм; 1,31 эВ
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Ядовитый газ фосген образуется из CO и Cl2: CO+Cl2↔COCl2. Равновесные концентрации веществ [Cl2] = 0,3 моль/л, [CO] = 0,2 моль/л и [COCl2]= 1,2 моль/л.
Ядовитый газ фосген образуется из CO и Cl2: CO+Cl2↔COCl2. Равновесные концентрации веществ [Cl2] = 0,3 моль/л, [CO] = 0,2 моль/л и [COCl2]= 1,2 моль/л.
Вычислите константу равновесия системы и начальные концентрации хлора и оксида углерода (II).
с(Cl2)нач.= 1,2 моль/л + 0,3 моль/л = 1,5 моль/л;
с(CO)нач. = 1,2 моль/л + 0,2 моль/л = 1,4 моль/л
Видео:How to Write the Net Ionic Equation for CoCl2 + Ca(OH)2 = Co(OH)2 + CaCl2Скачать

Лекция № 3 Химическая кинетика
ЛЕКЦИЯ № 3 Химическая кинетика.
Целью исследований химической кинетики является:
1. экспериментальное определение скорости реакции и её зависимости от различных факторов,
2. выявление механизма реакции, т. е. числа стадий и природы образующихся в этих стадиях промежуточных веществ.
Скорость реакции измеряется количеством вещества, реагирующего в единице объёма в единицу времени – (гомогенные реакции) или на единице поверхности раздела фаз (гетерогенные реакции). Отсюда размерности скоростей реакции гомогенной 

Практически скорость гомогенной реакции может быть измерена изменением концентрации исходного вещества или продукта реакции в единицу времени. Этим процессам отвечают диаграммы:
Следует отметить, что даже в самом малом ограниченном участке приведённых кривых скорость реакции непостоянна и, поэтому, истинной скоростью реакции называется скорость в данный момент времени. Она представляет собой первую производную от концентрации по времени
Факторы, влияющие на скорость химических реакций
1. Природа веществ
2. Концентрации веществ (давление — для газофазных реакций)
6. Степень измельчённости – для гетерогенных процессов
Остановимся на некоторых из них.
1. Природа веществ.
С наибольшей скоростью реагируют вещества (неорганические и органические) с ионными, полярными ковалентными связями. Взаимодействия органических веществ с ковалентными малополярными связями протекают значительно медленнее.
2. Концентрация реагентов.
Количественная связь между скоростью и концентрацией реагирующих веществ описывается законом действия масс (, П. Вааге, 1864-1867 г. г.), современная трактовка которого такова: при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, в степенях, равных порядку реакции по этим веществам. Порядок реакции по каждому из реагентов определяют экспериментально.
Для гомогенной реакции
кинетическое уравнение в соответствии с законом действия масс имеет вид

где k – константа скорости реакции, которая численно равна скорости реакции при концентрации каждого из реагентов равной 1 моль/л. Константа скорости характеризует скорость данного процесса при данной температуре; не зависит от концентрации реагентов, зависит от температуры – возрастает с ростом температуры. б и в – порядок реакций по веществам соответственно A и B.
Только для одностадийных реакций, при которых исходные вещества без каких-либо промежуточных соединений превращаются в продукты реакции величины б и в равны стехиометрическим коэффициентам.
Например 

В случае гетерогенных реакций в уравнения закона действия масс вводятся концентрации только веществ, которые находятся в газовой фазе или в растворе. Например, для реакции C(тв) + O2 

Порядок и молекулярность реакции.
Порядок реакции – число, равное сумме показателей степеней концентраций реагентов в кинетическом уравнении.
Порядок реакции может принимать значения от 0 до 3, включая дробные величины.
Для простоты рассмотрим только реакции целочисленного порядка.
Реакции нулевого порядка – такие реакции, скорость которых не зависит от концентрации реагента. Большая часть из них являются гетерогенными реакциями, протекающими на поверхности металла. Например, реакция разложения аммиака на H2 и N2 на поверхности вольфрама является реакцией нулевого порядка, т. е. её скорость на протяжении всего процесса не зависит от концентрации NH3.


Реакции первого порядка
2H2O2 

4AsH3 

Несоответствие между кажущейся молекулярностью и порядком реакции объясняется тем, что в многостадийных реакциях промежуточные превращения осуществляются с несопоставимыми скоростями. Наиболее медленная стадия определяет скорость реализации процесса превращения исходных веществ в конечные продукты. Эта стадия называется лимитирующей.
Например, 2N2O5 
Реакция протекает в две стадии:
N2O5 
N2O5 + N2O3 
Скорость второй бимолекулярной реакции несравненно выше скорости первой – мономолекулярной, следовательно, скорость превращения N2O5 в NO2 определяется первой стадией, чему соответствует уравнение

Важной величиной является время полупревращения (ф1/2) реакции, т. е. время, в течение которого концентрация реагента уменьшается в 2 раза по сравнению с исходным значением. В фармакинетике это обозначается термином “период полуэлиминации”.
Распределение лекарственного препарата, введенного в кровоток, подчиняется кинетике первого порядка.
Подставляя значение 
k1 – константа скорости реакции
Реакции второго порядка – самый распространённый тип реакций. Вот примеры таких реакций
2NO2 
H2 + I2 
CO + Cl2 
2N2O 
Реакции третьего порядка крайне редки.
Исходя из всего вышесказанного, можно определить размерности констант реакций различных порядков.
моль

л

л2 

Под молекулярностью реакции понимают число молекул, которые одновременно взаимодействуют, осуществляя элементарный акт химического превращения. В отличие от порядка реакции молекулярность не может быть ни нулевой, ни дробной.
Мономолекулярные – в элементарном акте химического превращения участвует одна молекула:
н-C4H10 
цикло-C3H6 
Ca(HCO3)2 
Бимолекулярные – реакции, в которых химическое превращение осуществляется путём взаимодействия двух молекул:
CO + Cl2 
H2 + I2 
PH3 + B2H6 
Тримолекулярные реакции – их известно очень немного. Очевидно, что вероятность одновременного соударения трёх молекул в реакционном пространстве очень мала и, поэтому, тримолекулярные реакции идут крайне медленно.
Примеры тримолекулярных реакций:
2NO + O2 
2NO + Cl2 
Реакций более высокой молекулярности не существует.
Влияние температуры на скорость химических реакций упрощённо описывается правилом Вант-Гоффа (1884 г.): при повышении температуры на каждые 10 градусов скорость гомогенной реакции возрастает примерно в 2-4 раза. Математически это правило записывается так:

где 

г – температурный коэффициент Вант-Гоффа
4. Энергия активации.
Более строгую математическую зависимость скорости реакции от температуры описывает уравнение С. Аррениуса (1889 г.), который исходил из предположения, что не всякое столкновение молекул в реакционном объёме заканчивается результативно, т. е. с образованием нового вещества. По С. Аррениусу продукт реакции образуется только при столкновении молекул, обладающих некоторым избытком кинетической энергии, т. е. активных (реакционноспособных) молекул.
ррениуса:
k – константа скорости реакции
A – коэффициент пропорциональности (предэкспоненциальный
множитель), который указывает долю активных молекул
e – основание натурального логарифма; e ≈ 2.718
Ea – энергия активации – избыточная энергия молекул, которой они должны обладать, чтобы их столкновение приводило к химическому взаимодействию
R – универсальная газовая постоянная;
T – абсолютная температура; Т=273 + toC
Наблюдаемые на опыте значения энергии активации находятся в пределах 0 – 400 кДж/моль. Величина Ea может служить критерием скорости протекания химического процесса:
Ea 120 
Первой стадией практически любого химического процесса является образование непрочного промежуточного соединения – активированного комплекса.
Активированный комплекс не является химическим соединением в привычном понимании этого слова. В нём не исчезли первоначально существовавшие в молекулах исходных веществ связи между атомами и не до конца сформировались новые. Однако электронные оболочки атомов во взаимодействующих молекулах определённым образом деформированы в направлении формирования новых химических связей, а прежние связи ослаблены.
Это можно схематично изобразить на примере реакции
H2 + I2 
Образование короткоживущего активированного комплекса требует меньших затрат энергии, чем разрыв связей в молекулах исходных веществ, т. к. этому разрыву содействует взаимное влияние реагентов и наметившееся образование новых связей. В итоге образование непрочного активированного комплекса приводит к уменьшению высоты энергетического активационного барьера.
Особенности каталитических реакций.
а. Катализаторы вводятся в реакцию в очень низких концентрациях.
б. Состав катализатора остаётся неизменным до и после реакции.
в. Катализаторы обладают специфичностью действия, т. е. катализаторы активны по отношению к одним процессам и инертны по отношению к другим. Например:
г. Катализаторы ускоряют как прямую, так и обратную реакции.
д. Катализаторы не влияют на величину константы равновесия, а только ускоряют достижение состояния равновесия.
е. Катализаторы снижают энергию активации.
При введении катализатора в реакционный объём происходят два последовательных процесса – образование промежуточного соединения катализатор–реагент и второй процесс – взаимодействие образованного соединения со вторым реагентом с образованием продукта реакции и освобождением катализатора.
Схематично это можно записать так:
A + B 
A + K 
AK + B 
возвращением катализатора в цикл, Ea3)
Одной из наиболее интересных областей химической кинетики является исследование закономерностей ферментативного катализа. Реакции, катализируемые ферментами, характеризуются высоким ускорением (
Для веществ, участвующих в ферментативных реакциях применимы следующие термины: субстрат (S) – индивидуальное химическое вещество, реакции которого катализируются ферментами (энзимами, E), фермент (E) – каталитически активное вещество, ускоряющее какие-либо превращения субстрата.
Михаэлис и Ментен (1913 г.) установили, что промежуточной стадией практически любой ферментативной реакции является присоединение по месту активных центров фермента молекул субстрата с образованием фермент–субстратного комплекса ES, который распадается с образованием продукта P и освобождением фермента E, чему соответствует схема:
Результатами их исследований стал вывод формулы – уравнения Михаэлиса-Ментен


находится в составе фермент-субстратного комплекса
C(S) – концентрация субстрата
Km – константа Михаэлиса
Уравнение имеет два предельных случая. При низкой концентрации субстрата Km



Графически это выглядит так:
а. первый порядок отн. C(S)
б. нулевой порядок отн. C(S)
Из графика зависимости скорости процесса от концентрации субстрата можно получить также значение Km, т. к. при 

Температурная зависимость скорости ферментативных реакций описывается кривой с максимумом. Восходящая часть кривой отражает обычную для всех химических реакций закономерность. Нисходящая часть показывает снижение активности фермента вследствие тепловой денатурации белковой молекулы, сопровождающейся нарушением её структуры, определяющей активность фермента.
Исследование зависимости скорости ферментативных реакций в температурном интервале, когда не наблюдается тепловой денатурации фермента, даёт возможность оценивать энергетическую характеристику процесса.
Это позволяет сделать общий вывод – высокая каталитическая активность ферментов объясняется как существенным снижением энергии активации, так и значительным благоприятным изменением энтропии в ходе реакции.
💥 Видео
The following two reactions: i. `PCl_(5)(g) hArr PCl_(3)(g)+Cl_(2)(g)` (ii) `COCl_(2)(g) hArr CO...Скачать

Вычисление константы скорости реакции | Задачник по химии ГлинкаСкачать

HCl+KMnO4=MnCl2+Cl2+KCl+H2O Расстановка коэффициентов методом электронного баланса в ОВР 10.47бСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Химия | Cкорость химической реакцииСкачать

Скорость химических реакций. Гомогенные и гетерогенные реакции. Химия 8 классСкачать

Введение в кинетикуСкачать

Гетерогенная реакция в аппарате КиппаСкачать

Скорость химической реакции. 10 класс.Скачать

Механизм радикального замещенияСкачать

Реакция элиминирования галагеналканов (10-класс)Скачать

СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ. КАТАЛИЗАТОР.Скачать

Получение алканов. Реакция Кольбе (механизм + сложные случаи). ЕГЭ по химии.Скачать
Расчет скорости химической реакции по текущим концентрациям реагентов. Химия для поступающих.Скачать

Гомогенные и гетерогенные реакции. Самоподготовка к ЕГЭ и ЦТ по химииСкачать

КОЛЛАГЕН С ВИТАМИНОМ "С" ДЛЯ ЖЕНЩИН ДЛЯ СУСТАВОВ ДЛЯ ЛИЦАСкачать

Лекция 12. «Кинетика реакций с участием твердых веществ. Гетерогенный катализ»Скачать