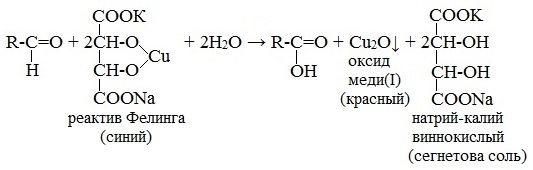
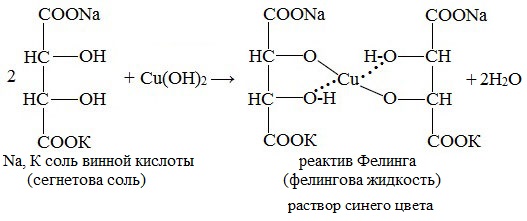
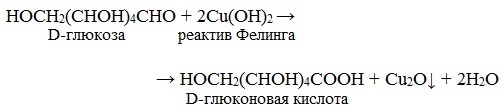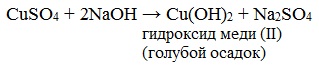Реактив Фелинга (медно-тартратный реактив, фелингова жидкость) — состоит из равных объемов раствора сложной соли тартрата натрия-калия (сегнетова соль, натрий-калий виннокислый) в 10%-ном р-ре NaOH и раствора сульфата меди.
Приготавливается непосредственно перед анализом путем смешения двух растворов.
Применяется для качественного и количественного определения альдегидов жирного ряда и в особенности моносахаридов. Действие реактива Фелинга основано на восстановлении иона двухвалентной меди до одновалентной за счёт окисления альдегидных групп исследуемых соединений.
При этом на холоде выпадает оранжево-жёлтый осадок гидроксида меди (I) СuОН, а при нагревании – красный осадок оксида меди (I) Сu2O.
Впервые был предложен в 1850 году немецким химиком Г. Фелингом.
Реакция на моносахариды
Глюкоза окисляется свежеосажденным гидроксидом меди (II) в щелочной среде до глюконовой кислоты, восстанавливая ионы Cu +2 до Cu +1 . Углеводы подобного типа называют восстанавливающими.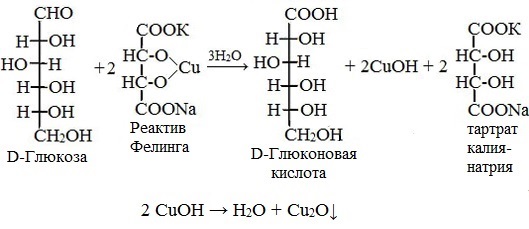
Эта реакция применяется для количественного определения сахаров в пищевых продуктах.
Реакция на альдегиды
Альдегиды жирного ряда восстанавливают двухвалентную медь в одновалентную.
Ароматические альдегиды эту реакцию не дают.
Образование реактива Фелинга
Реактив Фелинга используется как качественная реакция для определения альдегидной группы.
Видео:Общие свойства углеводов. Реактив Фелинга, Фруктоза, Сахароза, Крахмал.Скачать

Химия-2. Методические указания по выполнению лабораторных работ для студентов специальности 02080365 «Биоэкология»
| Название | Методические указания по выполнению лабораторных работ для студентов специальности 02080365 «Биоэкология» |
| Анкор | Химия-2.doc |
| Дата | 18.04.2018 |
| Размер | 0.53 Mb. |
| Формат файла |  |
| Имя файла | Химия-2.doc |
| Тип | Методические указания #18218 |
| страница | 3 из 4 |
| Подборка по базе: 6. Методические указания по написанию кон.pdf, МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ОФОРМЛЕНИЮ.docx, Метод указания по выполнению КР ИЭУ.doc, методические указания по выполнению КР ( 1 раздел) (1).pdf, Методические указания по оформлению текста ВКР и курсовых работ., Рекомендации к выполнению ПрофЭт.docx, 2. Методические рекомендации инструктору по ФОС для по Спас шлюп, Сборник лабораторных работ по дисциплине ОП.10 _Информационная б, Методические указания по выполнению лабораторной работы №4.docx, Методические указания по Математической статистике.pdf 2.3. ВЫСШИЕ ПОЛИСАХАРИДЫ В пробирку наливают 1 мл 1%-ного раствора крахмала. Затем добавляют равный объем реактива Фелинга. Жидкости тщательно перемешивают и нагревают верхнюю часть растворов до начинающегося кипения. Цвет растворов не изменяется. Молекулы полисахаридов содержат в своем составе большое число соединенных друг с другом при помощи гликозидных связей остатков моносахаридов. Молекулы крахмала (амилоза и амилопектин) содержат в среднем от 1000 до 300000 остатков D-глюкозы. Однако в макромолекулах амилозы и амилопектина содержится всего по одному свободному гликозидному гидроксилу, который в растворе может дать альдегидную группу, поэтому концентрация альдегидных групп в растворе настолько мала, что крахмал не восстанавливает реактив Фелинга. Реакция крахмала с йодом представляет собой сложный процесс. Синюю окраску с йодом дает амилоза — одна из фракций крахмала. Амилоза — полисахарид линейного строения, состоящий из остатков α -D-глюкопиранозы. Ее молекулы имеют структуру спирали, внутри которой есть свободный канал диаметром около 5 мкм, в него внедряются молекулы йода, образуя окрашенные комплексы («соединения включения») за счет взаимодействия с гидроксильными группами моносахаридных остатков. При нагревании молекулы амилозы теряют свою спиралевидную структуру, и окрашенные комплексы разрушаются, при охлаждении спиралевидная структура амилозы и, следовательно, окрашенные комплексы восстанавливаются. Для полисахаридов с разветвленными цепями (амилопектин и гликоген) наряду с процессами образования комплексов большое значение имеет процесс адсорбции йода на поверхности боковых цепей. Если боковые цепи в молекуле гликогена короткие, то развивается бурая окраска, если они длинные, то темно-красная. Опыт 18. Гидролиз крахмала Реактивы и оборудование: 1%-ный раствор крахмала, 10%-ный раствор серной кислоты, разбавленный раствор йода в иодиде калия (раствор Люголя), 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; конические колбы на 100 мл, пипетки, мерные цилиндры на 50 и 10 мл, пробирки.
Напишите уравнения реакций окисления продуктов гидролиза крахмала фелинговой жидкостью. Опыт 19. Кислотный гидролиз клетчатки Реактивы и оборудование: концентрированная серная кислота, 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; мелко нарезанная фильтровальная бумага, стеклянные палочки, водяные бани, пробирки. В сухую пробирку помещают несколько мелко нарезанных кусочков фильтровальной бумаги и приливают 1 мл концентрированной серной кислоты. Содержимое пробирки тщательно перемешивают стеклянной палочкой до полного разрушения бумаги и образования бесцветного вязкого раствора. После этого к нему осторожно при перемешивании по каплям добавляют 1 мл дистиллированной воды. Пробирку ставят на кипящую водяную баню. Смесь нагревают 10—15 мин при регулярном перемешивании. После охлаждения жидкость нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге) и проводят с ней реакцию с фелинговой жидкостью для обнаружения в продуктах гидролиза восстанавливающих сахаров. Напишите уравнение реакции гидролиза целлюлозы и объясните опыт. Лабораторная работа №3 3. АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ Опыт 20. Свойства аминов 20.2 Взаимодействие первичных аминов с азотистой кислотой. Эту реакцию используют как качественную реакцию на первичные амины алифатического ряда. В пробирку с 0,2 г хлорида метиламмония приливают 1 мл воды, а затем, после растворения соли, вносят 1 мл 10%-ного раствора нитрита натрия. Смесь тщательно перемешивают. При добавлении к реакционной смеси нескольких капель ледяной уксусной кислоты выделяется азот в виде мелких пузырьков. Как идет реакция вторичных и третичных аминов алифатического ряда с азотистой кислотой? на 100 мл, лед, водяные бани, пробирки. глицин (биполярный ион) 21.2. Образование медной соли аминоуксусной кислоты. В сухую пробирку вносят 0,5 г карбоната меди (II) и 1,5—2 мл 2%-ного раствора аминоуксусной кислоты. Реакционную смесь нагревают на пламени горелки. После нагревания хорошо видна синяя окраска раствора. Часть раствора переливают в другую пробирку и добавляют к нему 2 капли 10%-ного раствора гидроксида натрия. Выпадает ли осадок гидроксида меди (II)? Приведите объяснение. Оставшуюся часть жидкости охлаждают в стакане с ледяной водой. Постепенно выпадают кристаллы труднорастворимой медной соли аминоуксусной кислоты. Обычно для ускорения процесса кристаллизации стенку пробирки потирают стеклянной палочкой. Образование комплексных окрашенных в синий цвет медных солей характерно для α -аминокислот. 21.3. Цветная реакция аминокислот с нингидрином. Реакция с нингидрином очень чувствительна, поэтому ее часто применяют для качественного и количественного анализа α -аминокислот. К 2—3 мл 1%-ного раствора аминоуксусной кислоты добавляют 2—3 капли 0,1%-ного раствора нингидрина в ацетоне. Содержимое пробирки встряхивают и нагревают на горячей водяной бане. Через некоторое время появляется фиолетовая окраска с синим оттенком. Различные α — аминокислоты с нингидрином образуют окрашенные соединения, отличающиеся оттенком. Механизм реакции α — аминокислот с нингидрином подробно рассматривается в курсе биохимии. Опыт 22. Свойства мочевины Почему мочевина дает соль только по одной аминогруппе? Способность мочевины образовывать труднорастворимую соль с азотной кислотой используют для обнаружения мочевины в моче. В сутки с мочой из организма человека выделяется около 30 г мочевины. 22.2 Гидролиз мочевины. В пробирку вносят 0,1—0,2 г мочевины и добавляют 1—2 мл баритовой воды (насыщенный раствор гидроксида бария). Раствор кипятят до выпадения в осадок карбоната бария. Влажная красная лакмусовая бумажка, поднесенная к отверстию пробирки во время кипячения раствора, синеет в связи с выделением аммиака: В живых организмах гидролиз мочевины происходит под действием фермента уреазы (urea — лат. — мочевина). 22.3 Образование биурета. В сухую пробирку насыпают 0,2 г мочевины и нагревают ее в пламени горелки. Мочевина сначала плавится, а потом при дальнейшем нагревании разлагается с выделением аммиака, который обнаруживают по посинению влажной красной лакмусовой бумажки, поднесенной к отверстию пробирки, и по запаху. Через некоторое время плав в пробирке затвердевает, несмотря на продолжающееся нагревание: Пробирку охлаждают, добавляют в нее 2 мл воды и при слабом нагревании растворяют полученный биурет. Когда осадок отстоится, сливают с него раствор биурета и добавляют несколько капель 10%-ного раствора гидроксида натрия и 1—2 капли 1%-ного раствора сульфата меди. Раствор окрашивается в розово-фиолетовый цвет вследствие образования комплексной медной соли биурета. Схема таутомерных превращений биурета: Уравнение реакции биурета с гидроксидом меди (II): комплексная медная соль биурета. Эта реакция называется биуретовой. Она также является цветной реакцией на пептиды и белки. Кислотно-основные свойства анилина выражены слабо. Однако основные свойства анилина четко проявляются в его способности образовывать соли с минеральными кислотами. Эмульсию анилина разливают в две пробирки. К одной части по каплям при встряхивании добавляют концентрированную соляную кислоту. Постепенно происходит просветление мутной жидкости вследствие образования легко растворимой в воде соли — хлорида фениламмония: В пробирку с полученной солью приливают раствор гидроксида натрия. Наблюдают помутнение жидкости вследствие выделения анилина: [C6H5-NH3] + Cl — + NaOH → C6H5-NH2 + NaCl + H2O При добавлении раствора гидроксида натрия осадок растворяется, и жидкость мутнеет. Опыт 24. Взаимодействие анилина с бромной водой Объясните, почему реакция приводит к образованию триброманилина. Рассмотрите механизм монобромирования анилина и объясните влияние аминогруппы на бензольное кольцо. Опыт 25. Окисление анилина Реактивы и оборудование: анилин, хромовая смесь; пробирки. В пробирку наливают 1 мл воды и 2—3 капли анилина, тщательно перемешивают и добавляют 1—2 мл хромовой смеси (раствор дихромата калия в разбавленной серной кислоте). Окраска раствора меняется от оранжевой до зеленой, а затем наблюдается почернение реакционной смеси. Конечным продуктом окисления анилина является краситель сложного строения — «черный анилин», который используют для окрашивания тканей и получения красящего слоя копировальной бумаги. Лабораторная работа №4 Опыт 26. Получение фурфурола и его свойства Фурфурол образуется из пентозанов, которые вместе с клетчаткой входят в состав древесины: С полученным раствором фурфурола проводят некоторые реакции. 26.2.Взаимодействие фурфурола с анилином. На полоску фильтровальной бумаги наносят каплю анилина. В это же место добавляют каплю уксусной кислоты, а затем раствора фурфурола. Появляется пятно, окрашенное в красный цвет. 26.3. Реакция фурфурола с аммиачным раствором серебра. В пробирку наливают 1 мл аммиачного раствора гидроксида серебра и добавляют 1—2 капли раствора фурфурола. Раствор нагревают на горячей водяной бане. Выпадает черный осадок металлического серебра. Напишите уравнение реакции взаимодействия фурфурола с аммиачным раствором гидроксида серебра и с анилином. Наличие какой функциональной группы доказывают реакции, проведенные в опытах 26.2, 26.3? Видео:Опыты по химии. Гидролиз крахмалаСкачать  Лабораторные работы по органической химии (стр. 10 )
Необходимо помнить, что для изображения пространственной конфигурации циклических форм моносахаридов пользуются проекционными формулами Фишера или перспективными формулами Хеуорса. Моносахариды – соединения со смешанными функциями, т.е они имеют в молекуле альдегидную и кетонную группы и несколько спиртовых. Поэтому нужно писать реакции с монозами по всем функциональным группам. Уясните, какой гидроксил называется полуацетальным (гликозидным) и чем его свойства отличаются от спиртовых гидроксилов. Изучение полисахаридов надо начинать со знакомства с их строением, с отличительных особенностей – структурных формул крахмала и клетчатки, знать особенности ? и ? — гликозидных связей, а также биологическое и практическое значение этих полисахаридов. В процессе освоения класса углеводов большое внимание необходимо обратить на эфиры сахаров, и в первую очередь на фосфорные эфиры, т.к. они занимают особое место в синтезе и распаде сахаров. Видео:реакция крахмала с йодомСкачать  Дисахариды и полисахаридыВ зависимости от числа молекул моносахаридов, образующихся при гидролизе полисахаридов, последние подразделяются на дисахариды, трисахариды и т.д. Наибольшее практическое значение имеют дисахариды. Связь между двумя молекулами моносахаридов устанавливается с помощью двух гидроксильных групп – по одной от каждой молекулы монозы. Однако характер этой связи может быть различным. Если одна из молекул моносахарида всегда предоставляет свой полуацетальный (гликозидный) гидроксил, то вторая молекула участвует в этом либо полуацетальным гидроксилом (образуется гликозид – гликозидная связь), либо спиртовым гидроксилом (образуется гликозид – гликозная связь). Отсутсвие или наличие в молекуле дисахарида полуацетального гидроксила отражается на свойствах дисахаридов. Если при образовании дисахарида обе молекулы участвовали своими полуацетальными гидроксилами (гликозид – гликозидная связь), то у обоих остатков моноз циклические формы являются закрепленными, альдегидная группа такого дисахарида образоваться не может. Такой дисахарид не обладает восстанавливающими свойствами и называется невосстанавливающим дисахаридом. В случае гликозид – гликозной связи циклическая форма одного остатка моносахарида не является закрепленной, она может перейти в альдегидную форму, и тогда дисахарид будет обладать восстанавливающими свойствами. Такой дисахарид называется восстанавливающим. Восстанавливающие дисахариды проявляют реакции, для соответствующих моносахаридов. Полисахариды являются высокомолекулярными веществами. В полисахаридах остатки моносахаридов связываются гликозид – гликозными связями. Поэтому их можно рассматривать как полигликозиды. Остатки моносахаридов, входящие в состав молекулы полисахарида могут быть одинаковыми, но могут и различаться; в первом случае это гомополисахариды, во втором – гетерополисахариды. Важнейшими гомополисахаридами, состоящими из остатков глюкозы, являются крахмал, гликоген и клетчатка (или целлюлоза). Вопросы для самопроверки. 1. Какой атом углерода называется ассиметрическим? 2. Напишите карбонильные формулы Д- глюкозы, Д- фруктозы. 3. Что такое L- и Д-, ?- и ?- формы сахара? 4. Напишите альдегидные и циклические формы глюкозы. 5. Что такое гликозидный гидроксил? Какие реакции свойственны сахарам по этому гидроксилу? 6. Напишите уравнения реакций образования мальтозы и целлобиозы. Чем отличаются формулы этих дисахаридов? 7. Гидролиз крахмала и клетчатки. Какие промежуточные и конечные продукты при этом образуются? 10. Биологическая роль гликогена? 1. Напишите реакции окисления (в разных условиях) и восстановления моноз: а) D-глюкозы; б) D-фруктозы. 2. Напишите схему перехода в щелочной среде глюкозы во фруктозу. 3. Напишите реакции гидрирования: а) D-глюкозы; б) D-галактозы; в) D-фруктозы. 4. Напишите уравнение реакции следующих дисахаридов: а) лактозы; б) мальтозы. 5. Напишите уравнение реакции окисления дисахаридов в мягких условиях: а) мальтозы; б) целлобиозы; в) лактозы. Назовите образующиеся кислоты. 6. С помощью каких химических реакций можно отличить сахарозу от мальтозы? 7. Напишите схемы строения крахмала и целлюлозы. 8. Напишите гидролиз сахарозы, используя структурные формулы. В чем заключается явление инверсии? Что такое инвертный сахар? 9. Напишите схемы реакций окисления D- глюкозы до глюконовой кислоты и до глюкаровой кислоты (двухосновной). 10. Чем объясняются восстановительные свойства глюкозы? Из D-глюкозы получите глюконовую и сахарную (глюкароновую) кислоты. 11. Приведите реакции, доказывающие наличие в молекуле D-глюкозы карбонильной и гидроксильной групп (окисление, восстановление, образование сложного эфира с уксусным ангидридом). 12. Как химическим путем можно отличить сахарозу от мальтозы. Напишите реакцию и назовите полученное соединение. 13. Как химическим путем можно отличить сахарозу от лактозы? Напишите схему реакций и назовите полученное соединение. 14. Напишите схему гидролиза крахмала. Чем отличается строение крахмала от строения клетчатки? Поясните, приведя структурные формулы. 15. Напишите формулы сахарозы и целлобиозы. Поясните, какой из этих дисахаридов и почему является восстанавливающим. 16. Напишите строение крахмала и целлюлозы, поясните сходства и различия в строении их молекул. Лабораторная работа №10 Цель работы: изучить качественные реакции на углеводы Гидролиз крахмала осуществляется постепенно через промежуточные продукты расщепления – декстрины. Различают несколько типов декстринов, которые с йодом дают различную окраску: амилодекстрины окрашиваются в фиолетово-синий цвет, эритродекстрины в красно-бурый цвет, ахродекстрины – не меняющие цвет в присутствии йода. Эксперимент: В плоскодонную колбу емкостью 100-150 мл. поместите с помощью пипетки 15 мл. 1 % раствора крахмала и 5 мл. 5 % раствора серной кислоты. Закройте колбу пробкой, в которую вставлена стеклянная трубка (воздушный обратный холодильник) и поставьте на электроплитку, укрепив колбу в кольце штатива. Через 3 минуты с момента закипания колбочку снимите с плитки, дайте немного остыть и отберите пробу (около 1 мл.) в одну из заранее приготовленных пробирок, которых должно быть 6 штук. Закройте колбу пробкой и вновь поставьте на плитку. Замечая время с момента закипания, через 3 минуты возьмите пробу во вторую пробирку, повторяя указанную выше процедуру. Так делайте несколько раз. Если жидкость в колбе немного выкипает, то добавьте дистиллированную воду. Через 15-20 минут с содержимым пробирок проделайте реакцию на йод. В каждую пробирку капните по 2 капли 0,1% раствора йода. Наблюдайте за окраской. Объясните результаты опыта. В течение 15-20 минут осуществляется полный гидролиз крахмала. Об окончании гидролиза судят по желтой окраски от йода в последней из пробирок. С остатком гидролизата проделайте реакцию Троммера или Фелинга. Результаты объясните. К какой группе сахаров относится сахароза? Напишите формулу. Исходя из структуры, объясните, обладает ли сахароза восстанавливающими свойствами? Эксперимент. В пробирку налейте 20 капель 10% раствора сахарозы, прибавьте 12-16 капель 10% раствора серной кислоты и кипятите на спиртовке в течение 2-3 минут. Пробирке дайте остыть и отберите из нее 5 капель для реакции Троммера и фелинговой жидкостью. Те же реакции выполните с негидролизованным 10% раствором сахарозы. Объясните результаты реакций. Жидкость Фелинга является медным алкоголятом сегнетовой соли (калия-натрия виннокислого). Моносахариды при кипячении с фелинговой жидкостью восстанавливают ее оксида меди (I): Реакция с фелинговой жидкостью широко используется при количественном определении содержания редуцирующих сахаров в животных и растительных тканях. Эксперимент: К 3-4 мл. 1% раствора глюкозы или фруктозы добавьте равный объем фелинговой жидкости и нагрейте до начала кипения (2-3 мин.).
По этой реакции глюкоза в щелочной среде восстанавливает медь (II) до меди (I), а сама окисляется при этом до глюконовой кислоты: Эксперимент: К 3-4 мл раствора глюкозы прибавьте 1-2 мл. 5 % раствора едкого натра и по каплям 5 % раствора сернокислой меди. Сначала раствор окрашивается в сине-фиолетовый цвет, а затем, при осторожном нагревании выпадает желтый осадок. Какова формула этого вещества? Почему при дальнейшем нагревании желтый осадок переходит в красно-бурый осадок? Монозы, окисляясь в щелочной среде, восстанавливают соединения меди (II) до меди (I), соли оксида висмута – до металлического висмута, соли серебра – до металлического серебра. Эти реакции используются для количественного определения так называемых восстанавливающих или редуцирующих сахаров, молекулы которых содержат карбонильную группу. Восстанавливающими свойствами обладают также некоторые дисахариды – мальтоза, лактоза, целлобиоза, молекулы которых имеют свободную карбонильную группу. Видео:ТИК ТОК ЗАСТАВИЛ МЕНЯ ПОВТОРИТЬ ЭТО … НЕНЬЮТОНОВСКАЯ ЖИДКОСТЬ #shortsСкачать  9. АминыАминами называются производные углеводородов, образованные замещением в последних атомов водорода на группы – NH2, -NHR или -NRR1. Амины можно рассматривать и как производные аммиака, в молекуле которого атомы водорода замещены на углеводородные радикалы. Однозамещенные производные аммиака называют первичными, двухзамещенные – вторичными, трехзамещенные – третичными аминами. Химическое поведение аминов определяется наличием в их молекуле аминогруппы. На внешней электронной оболочке атома азота пять электронов, в молекуле амина, как и в молекуле аммиака, азот затрачивает на образование трех ковалентных связей три электрона, а два электрона остаются свободными (неподеленная пара электронов). 🌟 ВидеоПроба Фелинга на фенилпировиноградную кислотуСкачать  кислотный гидролиз крахмалаСкачать  Порядок реакцииСкачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  изменение крахмала под действием слюныСкачать  Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать  НЬЮТОНОВСКАЯ ЖИДКОСТЬ 🤯 ПОДПИШИСЬ ⬇️Скачать  25. Схема реакции и химическое уравнениеСкачать  Качественная реакция глюкозы с гидроксидом меди (II)Скачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  крахмал и вода, # жидкость Ньютона # антистресс.Маленькое счастье .Скачать  Кислотный гидролиз крахмалаСкачать  Как сделать ньютоновскую жидкость ? Подписывайся,если хочешь ещё экспериментов ⬇️Скачать  Крахмал. Целлюлоза. 11 класс.Скачать  Опыты по химии. Получение коллоидного раствора крахмалаСкачать  Свойства крахмала. Химический опытСкачать  |