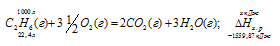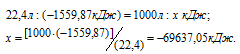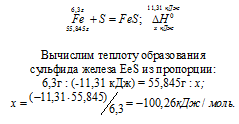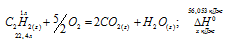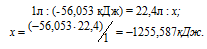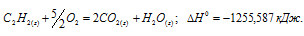- Ваш ответ
- решение вопроса
- Похожие вопросы
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Реакция горения аммиака выражается термохимическим уравнением : 4NH3(г) + 3O2(г) = 2N2(г) + 6Н20(ж) DН = — 1530, 28 кДж?
- При сгорании 32г метана CH4 выделилось 1604 кДж Теплоты?
- Составьте термохимическое уравнение реакции горения С2Н4, если в реакцию вступил 1 моль кислорода и при этом выделилось 467 кДж теплоты?
- Сколько моль кислорода вступило в реакцию если согласно термохимическому уравнению горения водорода 2H2 + O2 = 2H2O + 572 кДж выделилось 1144 кДж теплоты?
- По термохимическому уравнению : 2NH3 = 3H2 + N2 — 92 кДж вычислите количество теплоты , необходимое для разложения : а) 85 г аммиака ; б) 3 моль аммиака ?
- При сжигании 2 моль фосфора выделяется 1504 кдж теплоты?
- При сжигании 62 г фосфора выделилось 1504 КДж теплоты?
- По термохимическому уровнению реакция горения фосфора 4P + 5O2 = 2P2O5 + 3010 кдж Вычислите коллтчество теплоты, выделяющей при сжигании 31г фосфора?
- Помогите пожалуйста?
- Помогите пожалуйста?
- Термохимическое уравнение реакции горения водорода 2H2 + O2 = 2H2O + 483, 2 КДЖ?
- Правильный расчет теплового эффекта реакций и теплот образования веществ
- Тепловой эффект реакции
- Теплота образования вещества
Видео:Уравнивание реакций горения углеводородовСкачать

Ваш ответ
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

решение вопроса
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Похожие вопросы
- Все категории
- экономические 43,424
- гуманитарные 33,634
- юридические 17,906
- школьный раздел 608,194
- разное 16,858
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Please wait.
Видео:Реакции горенияСкачать

We are checking your browser. gomolog.ru
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 707224af4afd2056 • Your IP : 85.95.179.80 • Performance & security by Cloudflare
Видео:Аммиак: как образуется и с чем реагирует? #аммиак #химия #видеоурок #егэхимияСкачать

Реакция горения аммиака выражается термохимическим уравнением : 4NH3(г) + 3O2(г) = 2N2(г) + 6Н20(ж) DН = — 1530, 28 кДж?
Химия | 10 — 11 классы
Реакция горения аммиака выражается термохимическим уравнением : 4NH3(г) + 3O2(г) = 2N2(г) + 6Н20(ж) DН = — 1530, 28 кДж.
Вычислите теплоту образования NH3(г).
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж), ∆H = — 1530, 28 кДж — 1530, 28 = 6 * ( — 285, 84) — 4 * ∆H(NH3(г))
∆H(NH3(г)) = — 46, 19 кДж.
Видео:Составление уравнений реакций горения. 11 класс.Скачать

При сгорании 32г метана CH4 выделилось 1604 кДж Теплоты?
При сгорании 32г метана CH4 выделилось 1604 кДж Теплоты.
Составьте термохимическое уравнение реакции горения метана.
Видео:Горение. 7 класс.Скачать

Составьте термохимическое уравнение реакции горения С2Н4, если в реакцию вступил 1 моль кислорода и при этом выделилось 467 кДж теплоты?
Составьте термохимическое уравнение реакции горения С2Н4, если в реакцию вступил 1 моль кислорода и при этом выделилось 467 кДж теплоты.
Видео:Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

Сколько моль кислорода вступило в реакцию если согласно термохимическому уравнению горения водорода 2H2 + O2 = 2H2O + 572 кДж выделилось 1144 кДж теплоты?
Сколько моль кислорода вступило в реакцию если согласно термохимическому уравнению горения водорода 2H2 + O2 = 2H2O + 572 кДж выделилось 1144 кДж теплоты?
Видео:Горение аммиака в кислородеСкачать

По термохимическому уравнению : 2NH3 = 3H2 + N2 — 92 кДж вычислите количество теплоты , необходимое для разложения : а) 85 г аммиака ; б) 3 моль аммиака ?
По термохимическому уравнению : 2NH3 = 3H2 + N2 — 92 кДж вычислите количество теплоты , необходимое для разложения : а) 85 г аммиака ; б) 3 моль аммиака .
Видео:Гетерогенный катализ. Каталитическое окисление аммиакаСкачать

При сжигании 2 моль фосфора выделяется 1504 кдж теплоты?
При сжигании 2 моль фосфора выделяется 1504 кдж теплоты.
Составьте термохимическое уравнение реакции горения фосфора.
Видео:25. Схема реакции и химическое уравнениеСкачать

При сжигании 62 г фосфора выделилось 1504 КДж теплоты?
При сжигании 62 г фосфора выделилось 1504 КДж теплоты.
Составьте термохимическое уравнение реакции горения фосфора.
Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

По термохимическому уровнению реакция горения фосфора 4P + 5O2 = 2P2O5 + 3010 кдж Вычислите коллтчество теплоты, выделяющей при сжигании 31г фосфора?
По термохимическому уровнению реакция горения фосфора 4P + 5O2 = 2P2O5 + 3010 кдж Вычислите коллтчество теплоты, выделяющей при сжигании 31г фосфора.
Видео:Горение аммиака в кислородеСкачать

Помогите пожалуйста?
Напишите термохимическое уравнение реакции горения водорода, если при сгорании 1 г водорода выделилось 121 кДж теплоты.
Видео:2CH3OH + 3O2 → 2CO2 + 4H2O | Реакция горения метанолаСкачать

Помогите пожалуйста?
Напишите термохимическое уравнение реакции горения водорода, если при сгорании 1 г водорода выделилось 121 кДж теплоты.
Видео:Тепловой эффект реакции. Экзотермические и эндотермические реакцииСкачать

Термохимическое уравнение реакции горения водорода 2H2 + O2 = 2H2O + 483, 2 КДЖ?
Термохимическое уравнение реакции горения водорода 2H2 + O2 = 2H2O + 483, 2 КДЖ.
Вычислить теплоту которая выделиться при образований воды массой 180г.
На этой странице сайта размещен вопрос Реакция горения аммиака выражается термохимическим уравнением : 4NH3(г) + 3O2(г) = 2N2(г) + 6Н20(ж) DН = — 1530, 28 кДж? из категории Химия с правильным ответом на него. Уровень сложности вопроса соответствует знаниям учеников 10 — 11 классов. Здесь же находятся ответы по заданному поиску, которые вы найдете с помощью автоматической системы. Одновременно с ответом на ваш вопрос показаны другие, похожие варианты по заданной теме. На этой странице можно обсудить все варианты ответов с другими пользователями сайта и получить от них наиболее полную подсказку.
6 — 2. Там Ag и Cl не растворимы. Поэтому они могут существовать в одном растворе не взаимодействуя. 16 — 3. K2SO3 + H2SO4 = K2SO4 + SO2 + H2O. 18 — 4. 20 — 3.
6. 3) Na + и ОН — (другие образуют осадок или газ, и вода) 16. 3) серной кислоты и сульфита калия ОбразуетсяK2SO4, Н2О и SO2 18. 4) H2SO4 + BaCl2 = BaSO4 + 2HCl 20. 3) CaCO3 и НСl 22. 3) Nа2СО3 + НСl 4. 3) (NH4)2CO3.
Видео:Занятие 14 | Реакции горения | Курс химии | 7 классСкачать

Правильный расчет теплового эффекта реакций и теплот образования веществ
Видео:Реакция аммиака с сульфатом меди. Химический опытСкачать

Тепловой эффект реакции
Задание 95.
Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 15/2О2(г) = 6СО2(г) + 3Н2О(г); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования бензола равна +33,9 кДж. Ответ: —3135,58 кДж.
Решение:
∆H°С6Н6(парообр.) = +33,9 кДж/моль;
∆H°С6Н6(г) = +82,9 кДж/моль;
∆H°Н2О = -241,98 кДж/моль;
∆H°СО2 = -393,51 кДж/моль;
(С6Н6(ж) → (С6Н6(г); ∆H = +33,9 кДж;
ΔН = ?
Зная мольную теплоту парообразования и мольную теплоту образования газообразного бензола, рассчитаем мольную теплоту образования жидкого бензола из соотношения:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Ответ: ΔН = -3136 кДж.
Задание 96.
Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моля этана С2Н6(г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м 3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж.
Решение:
Уравнение реакции горения этана имеет вид:
С2Н6 (г) + 31/2O2 = 2СО2(г) + 3Н2О (ж); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Рассчитаем теплоту, выделяющуюся при сжигании 1м 3 этана из пропорции:
Ответ: . Q = 69637,05 кДж.
Теплота образования вещества
Задание 97.
Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3O2 (г) = 2N2(г) + 6Н2O(ж); 
Ответ: —46,19 кДж/моль.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном дав-лении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
4NH3(г) + 3O2 (г) = 2N2(г) + 6Н2O(ж); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:



Отсюда вычислим теплоту образования NH3:
4 


4 
4

Ответ: –46,19 кДж/моль.
Задание 98.
При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа ЕеS. Ответ: —100,26 кДж/моль.
Решение:
Уравнение реакции имеет вид:
Ответ: —100,26 кДж/моль.
Задание 99.
При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксида углерода. Вычислите теплоту образования С2Н2(г). Ответ. 226,75 кДж/моль.
Решение:
Уравнение реакции горения ацетилена имеет вид:
Рассчитаем теплоту, выделяющуюся при сжигании 1моль ацетилена из пропорции:
Термохимическое уравнение реакции горения ацетилена будет иметь вид:
Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:




Отсюда вычислим теплоту образования С2Н2:




Ответ: 226,75 кДж/моль.
Задание 100.
При получении молярной массы эквивалента гидроксида кальция из СаО(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: –635,6 кДж.
Решение:
Так как молярная масса эквивалента гидроксида кальция равна 1/2M(Са(ОН)2), то при по-лучении 1моль его выделится 65,06 кДж теплоты (2 . 32,53 = 65,06).
Термохимическое уравнение получения гидроксида кальция из СаО(к) и Н2О(ж) будет иметь вид:
СаО(к) + Н2О(ж) = Са(ОН)2(к); 
Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:




Отсюда вычислим теплоту образования С2Н2: