| Бромоводород | |||
|---|---|---|---|
| |||
| Систематическое наименование | бромоводород | ||
| Традиционные названия | Бромистый водород | ||
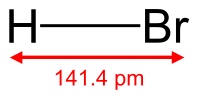
| Хим. формула | HBr | ||
| Рац. формула | HBr | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 80,91 г/моль | ||
| Плотность | газ (25 °C), 3,307 г/л, жидкий (−68 °C) 2,17 г/см³ | ||
| Энергия ионизации | 11,62 ± 0,01 эВ | ||
| Температура | |||
| • плавления | –86.80 °C | ||
| • кипения | –66.38 °C | ||
| Критическая точка | 90,0 °C, 8,54 МПа | ||
| Энтальпия | |||
| • образования | -34,1 кДж/моль | ||
| Давление пара | 20 ± 1 атм , 20,003 бар , 26,5 бар и 40,7 бар | ||
| Константа диссоциации кислоты pKa | ≈ –9 | ||
| Растворимость | |||
| • в воде | 193 (20 °C) | ||
| Дипольный момент | 0,24 Д | ||
| Рег. номер CAS | 10035-10-6 | ||
| PubChem | 260 | ||
| Рег. номер EINECS | 233-113-0 | ||
| SMILES | |||
| RTECS | MW3850000 | ||
| ChEBI | 47266 | ||
| Номер ООН | 1048 | ||
| ChemSpider | 255 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе.
- Содержание
- Получение
- Физические свойства
- Химические свойства
- Применение
- Транспортировка
- Токсичность
- 2.3.1. Химические свойства водорода и галогенов.
- Химические свойства водорода
- Взаимодействие водорода с простыми веществами
- Взаимодействие водорода со сложными веществами
- Химические свойства галогенов
- Взаимодействие галогенов с простыми веществами
- Взаимодействие галогенов с неметаллами
- Взаимодействие галогенов с металлами
- Реакции галогенов со сложными веществами
- Реакции замещения с галогенами
- Взаимодействие галогенов с водой
- Взаимодействие галогенов с растворами щелочей
- Acetyl
- 📸 Видео
Видео:Опыты по химии. Взаимодействие брома с алюминиемСкачать

Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Транспортировка
- 6 Токсичность
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение
В промышленности бромоводород получают непосредственным взаимодействием простых веществ:
Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений
В лаборатории получают гидролизом трибромида или пентабромида фосфора:
Восстановление брома несколькими способами:
Вытеснение из бромидов щелочных металлов разбавленной кислотой:
Видео:Монохлорид Брома - BrCl. Реакция Брома и Хлора. Реакция Cl2 и Br2.Скачать

Физические свойства
Бромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив.
Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C.
Растворяется в этаноле, образуя слабый электролит.
При охлаждении водных растворов HBr можно получить кристаллогидраты:
- HBr·H2O — устойчив при −15,5÷-3,3 °C
- HBr·2H2O — плавится при −11,2 °C
- HBr·4H2O — плавится при −55,8 °C
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4.
Видео:Взаимодействие этилена с бромной водойСкачать

Химические свойства
Водный раствор бромистого водорода образует сильную одноосновную кислоту:
Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул:
Как кислота реагирует с металлами, их оксидами, основаниями:
Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет:
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Применение
Применяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления.
Видео:Бром и всё о нём. Химия – простоСкачать

Транспортировка
Безводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Токсичность
Бромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин.
Видео:Взаимодействие брома с алюминиемСкачать

2.3.1. Химические свойства водорода и галогенов.
Видео:Решение задач по уравнениям параллельно протекающих реакций. 1 часть. 11 класс.Скачать

Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s 1 . С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Видео:Мононитрат Брома - BrNO3. Реакция спиртового раствора Брома и Нитрата Серебра. Реакция Br2 и AgNO3.Скачать

Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген
Физические свойства
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns 2 np 5 , где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
HCl + HClO» width=»225″ height=»28″/>
HBr + HBrO» width=»225″ height=»28″/>
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
5NaI + NaIO3 + 3H2O» width=»341″ height=»62″/>
Видео:Реакция взаимодействия брома с гидроксидом натрияСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📸 ВидеоБромоформ - CHBr3. Реакция Ацетона, Брома и Гидроксида Натрия. Реакция (CH3)2CO, Br2 и NaOHСкачать  Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Реакция брома с алюминиемСкачать  Водород. 8 класс.Скачать  Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать  Правило Марковникова В.В. в реакциях присоединения у алкЕнов и алкИнов.Скачать  Уравнивание реакций горения углеводородовСкачать  Реакции присоединения | Химия 10 класс | УмскулСкачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  |