Принцип метода. Молекулы дисахаридов состоят из остатков двух молекул моносахаридов, соединенных гликозидной связью. К дисахаридам относятся: сахароза (свекловичный или тростниковый сахар), мальтоза (солодовый сахар), лактоза (молочный сахар), трегалоза (грибной сахар, микоза), целлобиоза (дисахарид, освобождающийся при гидролитическом расщеплении клетчатки) и др.
По типу связи между молекулами моноз дисахариды можно разделить на две группы: 1) построенные по типу мальтозы; 2) типа трегалозы.
Дисахариды мальтозного типа состоят из двух остатков моноз, соединенных в положении 1,4, т. е. кислородный мостик связывает первый атом углерода одной молекулы моносахарида с четвертым атомом углерода другой.
У мальтозы остается свободным один гликозидный гидроксил (карбонильная группа), поэтому дисахариды, построенные по типу мальтозы, сохраняют все реакции, свойственные карбонильной группе (Троммера, Бенедикта, Ниландера, с фелинговой жидкостью и т. д.).
По мальтозному тйпу построены также лактоза и целлобиоза. При гидролизе лактозы освобождаются молекула а-глюкозы и молекула галактозы
Молекула целлобиозы гидролитически расщепляется на две молекулы -глюкозы. Следовательно, целлобиоза-р-глюкозид-1,4-глюкоза.
В молекулах дисахаридов, построенных по типу трегалозы, моносахариды соединены кислородным мостиком между двумя гликозидными гидроксилами (карбонильными группами). Поэтому дисахариды трегалозного типа лишены восстанавливающих свойств. К дисахаридам указанного типа относятся сахароза и трегалоза. Сахароза легко гидролизуется с образованием смеси равных количеств глюкозы и фруктозы, называемой инвертным сахаром. Инвертный сахар дает все реакции, характерные для моноз.
Реакция Барфеда позволяет быстро отличить моносахариды от дисахаридов мальтозного типа, обладающих, как известно, восстанавливающими свойствами (лактозы, мальтозы, целлобиозы). Она основана на том, что восстанавливающие свойства моносахаридов сохраняются также в кислой среде, тогда как дисахариды восстанавливают металлы только при щелочной реакции. При взаимодействии дисахаридов с реактивом Барфеда красный осадок закиси меди появляется не сразу, а лишь спустя некоторое время (15—20 мин.), когда произойдет их гидролитический распад, который катализируется кислотами.
Порядок выполнения работы.
Отличие восстанавливающих свойств дисахаридов от моносахаридов.
В три пробирки наливают по 1 мл реактива Барфеда (Реактив Барфеда можно готовить и по следующей прописи: в 200 мл горячей воды растворяют 13,3 г уксуснокислой меди. Помешивают до растворения соли, фильтруют. К фильтрату прибавляют 1,9 мл ледяной уксусной кислоты — CH3 COOH.) и прибавляют по 1 мл в одну пробирку глюкозы (7%-ный раствор), в другую – мальтозы, а в третью лактозы (1%-ные растворы дисахаридов). Все пробирки нагревают на водяной бане в течение 10 мин. В пробирке с глюкозой образуется красный осадок оксида меди (I). Дисахариды этой реакции не дают.
Следует избегать длительного кипячения, т.к. дисахариды в кислой среде могут гидролизоваться до моносахаридов, и в результате реакция Барфеда станет положительной. Проба Барфеда отличается от других реакций восстановления тем, что окисление сахара протекает не в щелочной среде (где окисление протекает значительно легче, чем в нейтральной и особенно в кислой), а в среде слабо кислой. В этих условиях дисахариды практически не окисляются, что позволяет их отличить от моносахаридов.
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Мир науки
Видео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать

Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Видео:Качественная реакция на глюкозу. Реакция глюкозы с гидроксидом меди (ll)Скачать

Химия — рефераты, шпаргалки, семинары, конспекты, лекции
Видео:25. Схема реакции и химическое уравнениеСкачать

Опыты с углеводами
Опыт 37. Выявление гидроксильных групп в углеводах
В пробирку вносят 6 капель 10% раствора гидроксида натрия и 1 каплю 2% раствора меди (II) сульфата. Наблюдают образование синего осадка меди (II) гидроксида. При добавлении 1 капли 0,5% раствора D-глюкозы осадок быстро растворяется с образованием прозрачного синего раствора меди (II) сахарата:
Эта реакция доказывает наличие α-гликольного фрагмента в молекуле D-глюкозы.
Опыт 38. Взаимодействие моносахаридов с реактивом Фелинга
Реактив Фелинга — раствор меди (II) сульфата и сегнетовой соли в 10%-ном растворе гидроксида натрия. Его готовят непосредственно перед использованием.
В пробирку вносят 2 капли водного раствора меди (II) сульфата (раствор А) и 2 капли щелочного раствора сегнетовой соли — калий натрий тартрата (раствор Б). Наблюдают выделение голубого осадка ку-Прум (II) гидроксида, который с сегнетовой солью образует водорастворимый комплекс синего цвета:
Далее в пробирку добавляют 3 капли 5%-го раствора глюкозы и нагревают смесь до кипения. Наблюдают постепенное обесцвечивание раствора и образования красно-коричневого осадка меди (I) оксида:
Опыт 39. Общая реакция на углеводы с α-нафтолом (реакция Молиша)
В пробирку вносят несколько крупинок исследуемого углевода (глюкозы, сахарозы или крахмала), 1 мл воды и 2 капли свежеприготовленного 10%-ного спиртового раствора α-нафтола. Пробирку встряхивают, затем наклоняют и осторожно по стенке добавляют 1 мл концентрированной серной кислоты (тяжелый слой кислоты должен опуститься на дно пробирки, не смешиваясь с водным слоем). На границе двух слоев наблюдают появление темно-фиолетового кольца, обусловленного образованием продукта конденсации 5-гидроксиметилфурфуролу с α-нафтолом:
Эта реакция является общей на все углеводы (carbohydrates) и вещества, содержащие их.
Опыт 40. Нафторезорцинова проба Толленса
В пробирку вносят несколько крупинок глюкозы, 5 мл воды, 1 мл 1%-ного спиртового раствора нафторезорцину (1,3-дигидроксинафталину) и 1 мл концентрированной соляной кислоты. Смесь осторожно кипятят в течение 1 мин, затем осторожно встряхивают с 5 мл эфира или бензола. Эфирное (бензольный) слой приобретает разных оттенков: глюкоза, манноза, галактоза — сине-зеленую окраску; рамноза — фиолетовое, арабиноза, ксилоза — темно-синее. Появление окраска обусловлена образованием продуктов конденсации глюкуроновой кислоты с нафторезорцином и образованием производных динафтилметану (формула I) или Ксантен (формула II):
Эта реакция является общей на все углеводы, она часто применяется для определения уроновых кислот.
Опыт 41. Восстановительные свойства дисахаридов
1. В пробирку вносят 1 каплю 1% раствора лактозы, 4 капли 10% раствора гидроксида натрия и 1 каплю 2% раствора меди (II) сульфата. Образуется ярко-голубой осадок меди (II) гидроксида, который растворяется при встряхивании пробирки. При этом раствор становится прозрачно-синим, в результате образования комплекса меди (II) с лактозой:
Затем в пробирку добавляют 2 мл воды, встряхивают и осторожно нагревают верхнюю часть раствора. Наблюдают образование осадка, окраска которого меняется от желтого до красно-коричневого:
2. В пробирку вносят 1 каплю 1% раствора сахарозы, 4 крапли10% раствора гидроксида натрия и 1 каплю 2% раствора меди (II) сульфата. Ярко-голубой осадок меди (II) гидроксида растворяется при встряхивании пробирки. Образуется прозрачный синий раствор комплекса меди (II) с сахарозой. Содержимое пробирки нагревают: никаких изменений в пробирке не наблюдается, поскольку сахароза не имеет восстановительных свойств.
Опыт 42. Качественная реакция на крахмал
В пробирку вносят 5 капель 0,5% раствора крахмального клейстера и 1 каплю раствора йода в калий иодид. Наблюдают появление интенсивно-синей окраски раствора. Считают, что крахмал образует с йодом соединения-включения (клатраты), окрашенные в характерные цвета — синий (λмакс = 620 — 680 нм) для амилозы и красный (λмакс = 520 — 555 нм) для амилопектина. Молекулы амилозы в этих комплексах образуют вокруг молекулы йода спираль, каждый виток которой содержит 6 остатков глюкозы. При нагревании окрашенного раствора крахмала с йодом окраска исчезает, а при охлаждении снова появляется, что связано, очевидно, с раскруткой спирали амилозы (изменения пространственного строения клатратов).
Опыт 43. Кислотный гидролиз крахмала
При нагревании раствора крахмала с минеральными кислотами происходит его гидролиз с образованием глюкозы:
Глюкозу можно обнаружить характерными реакциями на моносахариды, например, реакцией Троммера.
Реакция Троммера. Моносахариды, например, глюкоза и фруктоза при нагревании восстанавливают меди (II) оксид в меди (I) оксид, окисляясь до альдольно кислот. Эту реакцию для глюкозы в общем виде можно записать следующим уравнением:
1. В пробирку к 3 мл 5% раствора глюкозы добавляют 1 мл 5%-го раствора гидроксида натрия, 1 мл 5%-го меди (II) сульфата, который при перемешивании растворяется (раствор приобретает голубую окраску). При его осторожном нагревании до кипения наблюдается образование желтого осадка меди (I) гидроксида или красно-коричневого осадка меди (I) оксида.
2. В две пробирки вносят по 5 мл раствора крахмала. В одну из них добавляют также 2 — 3 капли концентрированной соляной кислоты и кипятят на водяной бане в течение 15 минут. Вторая пробирка является контрольной. Затем в обе пробирки добавляют по 2 мл 15% раствора гидроксида натрия и по 5 капель раствора меди (II) сульфата и нагревают (реакция Троммера). В пробирке, в которой проводился гидролиз крахмала соляной кислотой при нагревании, наблюдается образование красно-коричневого осадка меди (I) оксида (положительная реакция Троммера), а в контрольной пробирке такой осадок не образуется (отрицательная реакция Троммера).
Опыт 44. Кислотный гидролиз клетчатки
Гидролиз клетчатки минеральными кислотами проходит значительно медленнее, чем крахмала. Если клетчатку предварительно обработать 80%-ным раствором серной кислоты, то процесс гидролиза клетчатки значительно ускоряется.
Глюкозу можно обнаружить характерными реакциями на моносахариды, например, реакцией Барфед.
Реакция Барфед. Гексозы в реакции с меди (II) ацетата образуют меди (I) оксид. Суммарное уравнение для глюкозы выглядит так:
Эта реакция происходит в среде, имеет значение рН, близкое к нейтральному. В этих условиях восстанавливающие дисахариды НЕ окисляются, что позволяет отличить их от моносахаридов.
Гидролиз клетчатки. Небольшое количество ваты (100 — 200 мг) вносят в пробирку, заливают ее 3%-ным раствором серной кислоты и кипятят в течение 10 мин.
Во вторую пробирку вносят такое же количество ваты, обрабатывают ее небольшим количеством (≈ 0,5 мл) 80%-го раствора серной кислоты до полного растворения, затем разбавляют содержимое пробирки водой до объема 1 мл и кипятят на водяной бане 5 мин.
Содержание обеих пробирок нейтрализуют раствором щелочи и проводят реакцию Барфед (добавляют по 1 мл раствора Барфед и после перемешивания нагревают до кипения).
В пробирке, содержащей необработанную концентрированной серной кислотой клетчатку, осадок красно-коричневого цвета меди (I) оксида не образуется (отрицательная реакция Барфед).
В пробирке, содержащей обработанную концентрированной серной кислотой клетчатку, появляется осадок красно-коричневого цвета меди (I) оксида (положительная реакция Барфед).
Видео:Реакция серебряного зеркала с глюкозой | Качественная реакция глюкозы на альдегидную группу |Скачать

Углеводы. Фармацевтический анализ углеводов
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
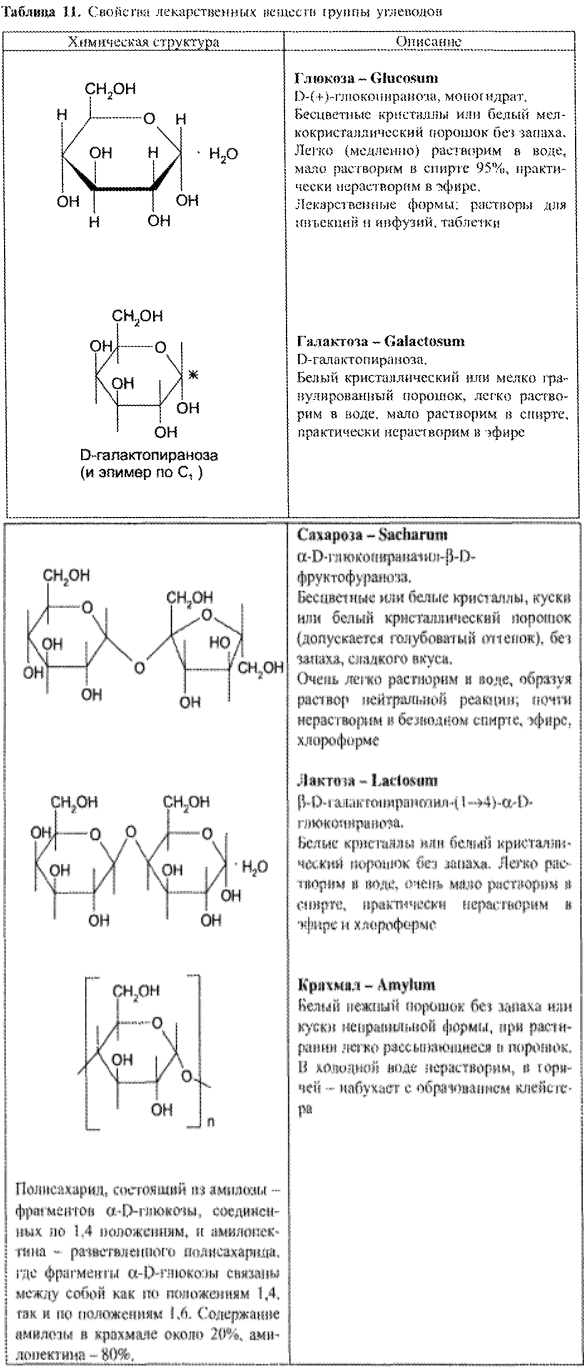
УГЛЕВОДЫ
Углеводы составляют обширную группу природных веществ, выполняющих в растительных и животных организмах разнообразные функции. Углеводы получают главным образом из растительных источников. Это связано с тем, что углеводы являются первичными продуктами фотосинтеза, осуществляемого растениями из оксида углерода и воды. Углеводы представляют своеобразный мост между неорганическими и органическими соединениями.
Название – «углеводы» возникло потому, что многие представители этого класса имеют общую формулу Сn(Н2О)m, и формально могут быть отнесены к «гидратам углерода».
Наиболее значимым ЛС данной группы является глюкоза. К группе углеводов относятся также сахароза, лактоза, галактоза и крахмал (табл. 11).
Требования НД к качеству глюкозы как лекарственному средству соответствуют требованиям к химически чистым веществам. Характерными физическими свойствами глюкозы являются следующие: – определённая форма крупных или мелких кристаллов, оптическая активность с сильно выраженным вращением плоскости поляризации (удельное вращение 10% раствора глюкозы +52,3°), Тпл безводной глюкозы.
Для глюкозы, которую получают в виде моногидрата, количество кристаллизационной воды является показателем качества ЛС. Содержание кристаллизационной воды должно составлять 10% от массы глюкозы моногидрата.
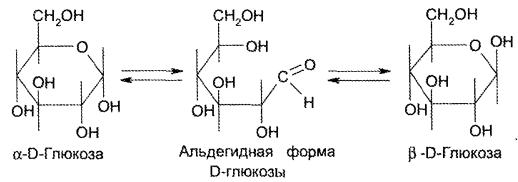
Определение удельного вращения глюкозы имеет свои особенности. В свежеприготовленных растворах глюкозы происходит мутаротация (изменение во времени величины угла вращения; через определенный временной интервал эта величина становится постоянной).
Мутаротацию можно ускорить путем прибавления к раствору глюкозы раствора аммиака (не более 0,1%). Если определять угол вращения глюкозы сразу после ее растворения и без прибавления к раствору аммиака, то этот показатель составит +109,16° и конечного значения +52,3° достигнет только через несколько часов.
Явление мутаротации объясняется тем, что при растворении глюкозы, которая в кристаллическом состоянии находится в какой-либо одной циклической форме, образуется ее альдегидная форма, через которую получаются аномерные циклические формы глюкозы: α и β – формы, различающиеся расположением полуацетального гидроксила относительно 1-го углеродного атома. Для α -D-глюкозы величина угла вращения составляет +109,6°, а для β-D-глюкозы +20,5°. Конечное значение угла вращения соответствует состоянию равновесия между α- и β – формами, которые через альдегидную форму в растворе превращаются друг в друга:
ХИМИЧЕСКИЕ СВОЙСТВА
Глюкоза и галактоза относятся к моносахаридам, сахароза и лактоза — к олигосахаридам, крахмал — к полисахаридам. Моносахариды, являясь веществами с двойственными функциями, вступают во многие реакции, характерные для спиртов и карбонильных соединений (альдегидов). Олигосахариды и полисахариды подвергаются гидролизу (ферментативному или кислотному) с образованием соответствующих моносахаридов.
Реакции на спиртовые гидроксилы
Как многоатомные спирты глюкоза, галактоза, сахароза и лактоза (подобно этиленгликолю и глицерину) способны взаимодействовать с меди (II) гидроксидом с образованием комплексных соединений синего цвета (химизм – см. с. 100).
Лекарственные вещества группы углеводов способны также к реакциям этерификации.
Реакции на альдегидную группу
Окисление, В зависимости от условий окисления моносахариды превращаются в различные продукты, В щелочной среде моносахариды окисляются под воздействием таких мягких окислителей, как реактивы Толленса и Фелинга (химизм – см. с, 107). С реактивом Толленса проходит реакция «серебряного зеркала», которая характерна для альдегидов. Следовательно, в эту реакцию моносахариды вступают в своей открытой (альдегидной) форме.
С реактивом Фелинга моносахариды образуют Сu2О красно-оранжевого цвета. И в этом случае моносахарид реагирует в открытой форме за счет альдегидной труппы. Обе реакции используются для обнаружения моносахаридов (например, глюкозы) в биологических жидкостях (кровь, моча).
Гликозиды и другие производные углеводов, не содержащие по- луацет:шьного гидроксила., не могут переходить в альдегидную форму и поэтому не обладают восстанавливающей способностью и не дают реакций с указанными реактивами.
В нейтральной среде окислению подвергается только альдегидная группа. При этом образуются альдоновые кислоты, которые в кислой среде, отщепляя воду, превращаются в лактоны.
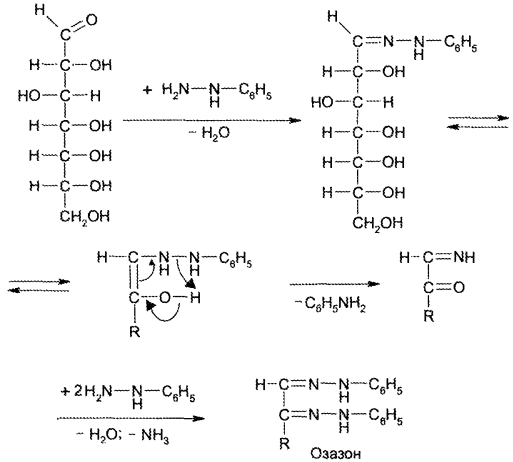
Образование озазонов. При нагревании моносахаридов с фенил- гидразином сахара превращаются в кристаллические соединения, плохо растворимые в воде, — озазоны. На 1-й стадии образуется фенилгидразон, который перегруппировывается в ходе внутримолекулярной окислительно-восстановительной реакции в моноимин 1,2-дикарбонильного соединения. Из последнего образуется озазон:
Озазоны — кристаллические вещества желтого цвета с четкой Тпл Реакция образования озазонов широко используется для установления подлинности сахаров, а также для выделения их из смесей.
АНАЛИЗ ИНДИВИДУАЛЬНЫХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Глюкоза (декстроза)
Подлинность. ФС в качестве испытания подлинности приводит реакцию окисления глюкозы реактивом Фелинга (химизм — см. с. 107).
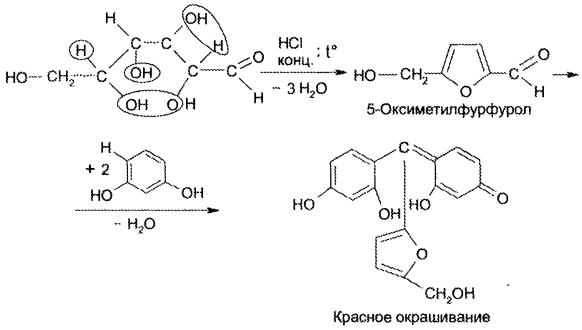
Известны и другие чувствительные и специфические реакции на глюкозу, не включенные в НД. Так, преобразование глюкозы в ме- тилфурфурол является чувствительной реакцией, которая основана на получении фурфурола из глюкозы при действии концентрированных серной или хлороводородной кислот с одновременным взаимодействием фурфурола с каким-либо фенолом (резорцином, тимолом, а-нафтолом) или ароматическим амином:
С меди (II) сульфатом глюкоза при подщелачивании (без нагревания!) образует растворимый фиолетово-синий комплекс; при стоянии раствора происходит окислительно- восстановительная реакция с выделением Сu2О. Таким образом, одновременно доказывается наличие и альдегидной, и спиртовых функциональных групп.
Регламентируется также определение удельного вращения. Измерение угла вращения проводят после прибавления к испытуемому раствору 2 капель раствора аммиака для предотвращения мутаротации.
Чистота, Статья ГФ на глюкозу включает стандартные испытания: прозрачность и цветность раствора, кислотность, присутствие хлоридов, сульфатов, кальция, бария, декстрина, мышьяка. Растворы для инъекций дополнительно проверяют на пирогенность.
Количественное определение. ГФ не регламентирует количественное определение субстанции. В препаратах глюкозы, в частности в растворах для инъекций, глюкозу определяют поляриметрически.
Сахароза
Сахароза является невосстанавливающим дисахаридом (олигосахаридом), так как образование гликозидной связи произошло за счет полуацетальных гидроксилов глюкозы и фруктозы. Поэтому сахароза не окисляется (в обычных условиях) реактивами Толленса и Фелинга. Сахароза — самый распространенный дисахарид, главный источник углеводов в пище человека. В фармации сахарозу применяют в виде сиропа — средство для улучшения вкуса.
Подлинность. Как многоатомный спирт сахароза образует с раствором кобальта (И) нитрата в присутствии эквивалентного количества натрия гидроксида комплекс фиолетового цвета.
Британская фармакопея (2001) регламентирует регистрацию ИК- спектра, а также ТСХ с использованием в качестве свидетелей стандартного образца сахарозы и других дисахаридов.
Чистота. Определение проводят так же, как у глюкозы.
Количественное определение не проводят.
Лактоза
Подлинность. У лактозы гликозидная связь образована между полуацетальным и спиртовым (С4) гидроксилами, поэтому подлинность лекарственного вещества доказывают прибавлением при нагревании реактива Фелинга. В результате выпадает кирпично-красный осадок меди (I) оксида (химизм — см. с. 107).
Чистота, Определение проводят так же, как у глюкозы.
🌟 Видео
Реакция глюкозы с гидроксидом меди (II)Скачать

Свойства глюкозы. 11 класс.Скачать
Качественная реакция на глюкозуСкачать

Reaction of Glucose with HCN (hydrogen cyanide)Скачать

[биохимия] — ГЛИКОЛИЗСкачать
![[биохимия] — ГЛИКОЛИЗ](https://i.ytimg.com/vi/EX5ZvvGQA5c/0.jpg)
Реакция глюкозы с аммиачным раствором оксида серебраСкачать

Брожение глюкозы. Из сборника задач по химии, Хомченко.Скачать

свойства глюкозы как многоатомного спиртаСкачать

Reaction of glucose, Action of Bromide water and Action of dil.HNO3Скачать

reaction of glucose, Action of acetic anhydrideСкачать

Опыты по химии. Взаимодействие глюкозы с гидроксидом меди (II) на холодуСкачать

Опыты по химии. Взаимодействие глюкозы с гидроксидом меди (II) при нагреванииСкачать

Химия 10 класс (Урок№10 - Углеводы. Глюкоза. Олигосахариды. Сахароза.)Скачать

Моносахариды. Глюкоза. 11 класс.Скачать

Качественные реакции на глюкозу.Скачать