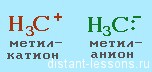- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Ионный и радикальный механизмы химических реакций органической химии
- Этан: способы получения и свойства
- Гомологический ряд этана
- Строение этана
- Изомерия этана
- Химические свойства этана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование этана
- 2. Дегидрирование этана
- 3. Окисление этана
- 3.1. Полное окисление – горение
- Получение этана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 3. Гидрирование алкенов и алкинов
- 4. Синтез Фишера-Тропша
- 5. Получение этана в промышленности
- 🔍 Видео
Видео:`H_(3)C-CH=CH_(2)+HCl` the intermediate of reaction is:Скачать

We are checking your browser. gomolog.ru
Видео:25. Схема реакции и химическое уравнениеСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Как решить такое уравнение ➜ c³+c²=2 ➜ Решаем на разных множествахСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6ffd831fdfb60b74 • Your IP : 178.45.155.83 • Performance & security by Cloudflare
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Видео:Химия | Cкорость химической реакцииСкачать

Ионный и радикальный механизмы
химических реакций органической химии
Ионный механизм химической реакции
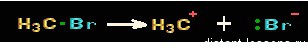
Судя по названию, ионный механизм реакции — это механизм, приводящий к образованию ионов. Соответственно, образуются органические катионы и анионы — карбокатионы или карбоанионы.
Такие ионы образуются при разрыве полярных ковалентных связей в органическом веществе.
Гетеролитический разрыв связей:
- карбокатионы будут взаимодействовать с нуклеофильными частицами,
- анионы – с электрофильными частицами (катионы металлов, галогены и др.)
- карбоанионы ( у них «избыток» электронов) будут взаимодействовать с электрофильными частицами.
Пример ионного механизма химической органической реакции:
Нуклеофильные частицы:
Электрофильные частицы:
Электрофильные и нуклеофильные реакции
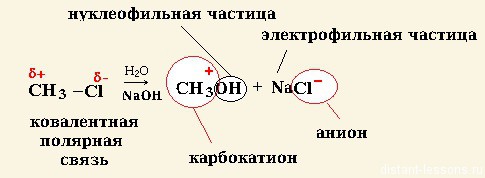
Нуклеофильные реакции — органическое вещество реагирует с нуклеофильным реагентом.
S N — substitution nucleophile
Ad N — addition nucleophile
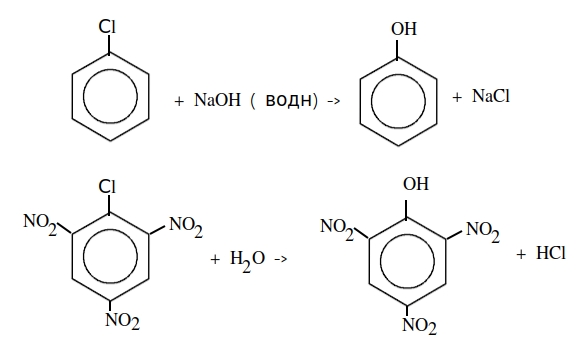
СH 3 Cl + NaOH -> СH3 OH + NaCl
нуклеофильное замещение протекает в тяжелых условиях ( t,p),
но если в бензольном кольце будут электроноакцепторные
заместители, то реакции пойдут намного легче,
электронодонорные — наоборот — затрудняют реакцию
HС≡CH + H2O -> ( Hg 2+ )->
Электрофильные реакции — органическое вещество реагирует с электрофильным реагентом
S E Ar — substitution electrophilic reaction
Ad E — addition electrophilic reaction
( образуется промежуточная частица NO 2 + )
C6H6 + CH 3Cl -> C6H5CH 3 + HCl
В органической химии чаще всего атакующей электрофильной частицей является протон H +
бромирование кратной связи
гидратация двойной связи
присоединение аминов или NH3
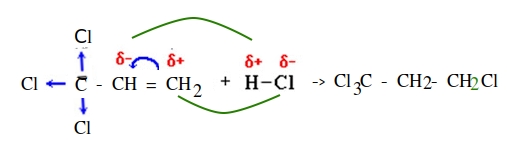
Присоединение по правилу Марковникова — типичный пример ионного типа механизма химической реакции:
водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
В основном, это реакции присоединения к кратным связям или обменные реакции.
Присоединение против правила Марковникова:
- заместитель при двойной связи оттягивает электронную плотность на себя
- если реакция присоединения идет не по электрофильному, а по радикальному механизму,
Ионные реакции проводят:
- при невысокой температуре;
- в полярных растворителях (в воде, например)
Радикальный механизм химической реакции
— механизм, приводящий к образованию радикалов.
Соответственно, образуются органические частицы — радикалы — имеющие неспаренный электрон.
Такие частицы образуются при разрыве неполярных слабо полярных ковалентных связей в органическом веществе.
Гомолитический разрыв связей:
Образовавшиеся радикалы могут взаимодействовать друг с другом.
Классическая реакция, идущая по радикальному механизму — хлорирование метана (обязательно на свету):
Радикальные реакции проводят:
- при высокой температуре,
- под действием света или радиоактивном облучении.
- примеры ЕГЭ — вопросов по механизмам органических реакций
Видео:Bond dissociation enthalpy of `H_(2)` , `Cl_(2)` and `HCl` are `434, 242` and `431KJmol^Скачать

Этан: способы получения и свойства
Этан C2H6 – это предельный углеводород, содержащий два атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Гомологический ряд этана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:For the reaction : ` H_(2)+Cl overset("sunlight")to 2HCl` the order of reaction isСкачать

Строение этана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :
При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле этана C2H6 атомы водорода располагаются в пространстве в вершинах двух тетраэдров, центрами которых являются атомы углерода |
Видео:Asus H110M-C. Ремонт цепи питания процессора.Скачать

Изомерия этана
Для этана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Реакция связывания комплементаСкачать

Химические свойства этана
Этан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для этана характерны радикальные реакции.
Этан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:With reference to the equation: Cl2 + H2S = 2HCl +S pertaining to a redox reaction select answersСкачать

1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Этан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании этана сначала образуется хлорэтан:
Хлорэтан может взаимодействовать с хлором и дальше с образованием дихлорэтана, трихлорэтана, тетрахлорметана и т.д.
1.2. Нитрование этана
Этан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в этане замещается на нитрогруппу NO2.
| Например. При нитровании этана образуется преимущественно нитроэтан: Видео:h2 + cl2 = hcl ll h2 + cl2 reaction ll h2 + cl2 → 2hcl reaction type llСкачать  2. Дегидрирование этанаДегидрирование – это реакция отщепления атомов водорода. В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др. При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Видео:Закон Гесса и изменение энтальпии реакцииСкачать  3. Окисление этанаЭтан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеЭтан горит с образованием углекислого газа и воды. Реакция горения этана сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении этана в недостатке кислорода может образоваться угарный газ СО или сажа С. Видео:Перевод из двоичной в десятичную систему счисленияСкачать  Получение этанаВидео:Type of Reaction for H2 + Cl2 = HClСкачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения этана из хлорметана или бромметана. При этом происходит удвоение углеродного скелета.
|