Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Видео:Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Видео:Химия 9 класс (Урок№12 - Оксид серы (IV). Сернистая кислота и ее соли.)Скачать

Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Видео:Соединения серы. 9 класс.Скачать

Реакция взаимодействия оксида серы(IV) и кислорода
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

2SO2 + O2  2SO3
2SO3
Реакция взаимодействия оксида серы(IV) и кислорода с образованием оксида серы(VI). Каталитическое окисление SO2 кислородом воздуха при температуре 400-500°C. Катализатором могут выступать: платина, оксид ванадия(V), оксид железа(III).
Реакция используется в статьях:
- 2SO2 + O2 = 2SO3, ΔH 0 298 = -197,9 кДж.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Получение оксида серы (IV)

В лабораторных условиях получение оксида серы (IV) производят в специальных герметических колбах, пары серы при вдыхании могут привести к отеку легких, поэтому помещение должно очень хорошо проветриваться.
На рисунке 1 изображена установка для сжигания серы в кислороде с последующим каталитическим окислением образовавшегося оксида серы (IV) в оксид серы (VI).
Кислород поступает через газоотводную трубку 1 из газометра. Ток газа легко регулируется с помощью кранов 2 (могут быть заменены резиновыми трубками с зажимами). Нагретая сера в фарфоровой лодочке (или осколке фарфоровой посуды) 3 загорается, и ее помещают в трубку, где она горит в токе кислорода.
Образующийся оксид серы (IV) и избыток кислорода по трубке 4 поступают в трехгорлую склянку 5 с концентрированной серной кислотой, где эти газы осушаются и смешиваются друг с другом и направляются в трубку 6 с катализатором 7.
Рис. Установка для получения оксида серы (IV) и окисления его в присутствии катализатора: 1—газоотводная трубка от газометра, 2 — краны, 3 — фарфоровая лодочка, 4— Г-образная газоотводная трубка, 5 — трехгорлая склянка, 6 — трубка-реактор, 7 катализатор. 8 — дугообразная трубка, 9 — стакан с охлаждающей смесью.
Оксид серы (VI) собирается в трубке 8, охлаждаемой смесью снега с солью 9. В качестве катализатора окисления SО2 в SО3 служит не только оксид ванадия (V), используемый в промышленности, но и оксид железа (III), оксид хрома (III) и др.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Катализатор для ускорения окисления серы
Достаточно активный катализатор — свежеприготовленный оксид хрома (III). Его получают путем прокаливания кусков пористой керамики, предварительно пропитанной раствором дихромата аммония (МNН4)2Сr 2O7.
Удовлетворительные результаты получают, если взять в качестве катализатора кусочки красного кирпича, в котором содержится оксид железа (III) на силикатном носителе или смесь оксида железа (III) со стеклянной (или асбестовой) ватой. Более активный катализатор получают пропитыванием асбестовой ваты раствором железного купороса с последующим высушиванием и прокаливанием.
Для окисления оксида серы (IV) до оксида серы (VI) очень часто используют трубчатые реакторы с электрическим нагревом (см. форзац I). Один из вариантов такой установки изображен на рисунке 13.
Оксид серы (IV) получают в колбе-реакторе 1 действием серной кислоты (в воронке 2) на сульфит натрия. Смесь оксида серы (IV) и кислорода после очистки и осушки в склянках 3 (конц. H 2SO4) и 4 (с ватой) поступает в реактор 5.
Рис.2 . Установка для каталитического окисления оксида серы (IV) в трубке с электронагревом:
1 — колба-реактор, 2 — капельная воронка, 3, 4 — проливные склянки, 5 — трубка-реактор, 6 — металлическая спираль, 7 — приемник, 8 — стакан со льдом, 9 — пробирка с раствором хлорида бария, 10 — пробирка с концентрированной серной кислотой.
При пропускании смеси оксида серы (IV) и кислорода над нагретой докрасна металлической спиралью 6 через небольшой промежуток времени можно наблюдать в приемнике 7 (в стакане 8 со льдом) туман, состоящий из оксида серы (VI) (точнее, мель чайших капель серной кислоты). Металлическая спираль, по-крытая слоем оксидов, оказывает каталитическое действие.
Постепенно туман заполняет приемник, и дальше он проходит через раствор хлорида бария, но частично поглощается концентриро ванной серной кислотой. В пробирке над раствором хлорида бария содержится больше тумана, чем в пробирке с концентрированной серной кислотой.
Образование тумана происходит более интенсивно, если между витками накаленной спирали поместить кусочки красного кирпича или другого катализатора. При длительном процессе с активными катализаторами можно получить оксид серы (VI) в жидком состоянии, а при сильном охлаждении приемника — и в твердом состоянии: в виде шелковистых нитей.
Статья на тему Получение оксида серы (IV)
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
💥 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Серная кислота и ее соли. 9 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Химия 9 класс (Урок№4 - Обратимые и необратимые реакции. Понятие о химическом равновесии.)Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Реакция сероводорода с оксидом серы IV. Химический опытСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

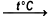 2SO3
2SO3