Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

» Сайт о химических элементах
Видео:Виявлення іонів Ni2+ реакцією ЧугаєваСкачать

Аналитические реакции катиона никеля (II) Ni2+
Аквокомплексы никеля (II)[Ni(H2O)6]2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля (II) имеют зеленую окраску. В растворе никель (II) присутствует только в форме комплексных соединений.
1.Реакция с щелочами.
Ni2+ + 2 ОН- -> Ni (ОН)2(зеленый)
Проба на растворимость. Осадок Ni(OH)2 растворяется в растворах кислот и аммиака: Ni(OH)2 + 2 Н+ -• №2+ + 2 Н2О
Ni(OH)2 +6 NH3 — [Ni(NH3)6]2+ + 3 ОН-
2.Реакция с аммиаком.
Ni(NO3)2 + NH3H2O — NiOHNO3 + NH4NO3,
NiCl2 + NH3H2O — NiOHCl + NH4C1 2NiSO4 + 2 NH3H2O — Ni(OH)2SO4 + (NH4)SO4,
Методика. В пробирку вносят 2-3 капли раствора соли хлорида никеля (II) Добавляют концентрированный (25%-й) раствор аммиака до полного растворения осадка и образования раствора синего цвета:
NiOHCl + 6 NH3 -> [Ni(NH3)6]2+ + ОН- + CY
Оксисоль Ni(II)гексамминникель (II) катион
Прибавляют к ней по каплям концентрированный раствор КВг до выпадения фиолетового осадка [Ni(NH3)6]Br2.
Комплексы [Ni(NH3)6]Ck [Ni(NH3)6](NO2)2, [Ni(NH3)6]SO4 хорошо растворяются в воде, а остальные мало растворимы в воде.
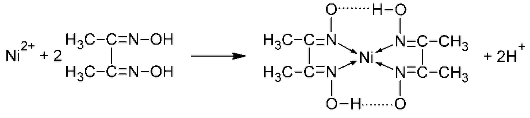
3.Реакция с реактивом Чугаева (диметилглиоксимом).
Розово-красный Бис-диметилглиоксиматоникель (II)
Реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака. Проведению реакции мешают катионы Cu2+, Pb2+, Fe2+, Fe3+.
Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, йод и др.), переводящих Ni (II) в Ni (III), комплекс которого имеет еще более интенсивную окраску.
4.Реакция с сульфид — ионами. —
Ni2+ + S2- -> NiS (черный)
5.Другие реакции катионов Ni (II).
Катионы Ni2+ с тиоцианатом калия KNCS и пиридином (Ру) образуют голубой осадок-комплекса состава [NiPy](NCS)2; со смесью щелочи и хлорной воды — черно-бурый осадок гидроксида Ni (III) Ni(OH)3; с рубеановодородной кислотой -сине-фиолетовый осадок рубеаната никеля малорастворимый в кислотах и аммиаке.
Смотрите также
Основные пути развития торговли
Торговля — это особая деятельность людей, связанная с осуществлением актов купли — продажи и представляющая собой совокупность специфических технологических и хозяйственных операций, напра .
Сера (Sulfur) S
Сера известна человеку со времен глубокой древности. Легендарный древнегреческий поэт Гомер, живший между XII и VIII вв. до нашей эры, автор эпических поэм «Иллиада» и «Одиссея&qu .
Видео:25. Схема реакции и химическое уравнениеСкачать

Опыт 6.5.3. Реакция с диметилглиоксимом (реактивом Чугаева)
Катионы Ni 2+ при реакции с диметилглиоксимом (реактивом Чугаева) при рН 6-9 образуют малорастворимое в воде внутрикомплексное соединение розово-красного цвета — бис-диметилглиоксиматоникель (II) (старое название — «никельдиметилглиоксим»):
(здесь точками обозначены водородные связи OH). Обычно реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака.
Катионы кобальта (II) в малых концентрациях не мешают определению никеля. Мешают катионы Cu 2+ , Pb 2+ , Fe 2+ , Fe 3+ . Разработаны методики для устранения их мешающего действия.
Эта реакция, впервые предложенная Л.А.Чугаевым, является наиболее характерной для катионов никеля (II) и высокочувствительной: предел обнаружения равен 0,16 мкг, предельное разбавление — 3 10 5 мл/г. Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, йод и др.), переводящих никель (II) в никель (III), комплекс которого с диметилглиоксимом имеет еще более интенсивную окраску.
Выполнение опыта:
В пробирку поместить 3-4 капли раствора соли никеля (II), прибавить 3-4 капли концентрированного раствора аммиака и каплю спиртового раствора диметилглиоксима. Выпадает розово-красный осадок комплекса диметилглиоксимата никеля.
Реакцию можно проводить капельным методом на фильтровальной бумаге. Для этого на листок фильтровальной бумаги наносят каплю раствора соли никеля (II), затем — каплю спиртового раствора диме-тилглиоксима. Бумагу держат над склянкой с концентрированным раствором аммиака (в парах аммиака) до появления розово-красного пятна.
Записать наблюдение и уравнение реакции в тетрадь.
Опыт 6.5.4. Реакция ссульфид-ионами
Катионы Ni 2+ с сульфид-ионами S 2- в нейтральной среде образуют черный осадок сульфида никеля (II) NiS.
Выполнение опыта:
В пробирку поместить 3-4 капли раствора соли никеля (II), прибавить 3-4 капли раствора сульфида натрия. Выпадает черный осадок.
Записать наблюдение и уравнение реакции в тетрадь.
Опыт 6.5.5. Реакция сщелочью и бромной (хлорной) водой
Со смесью щелочи и бромной (хлорной) воды соль двухвалентного никеля дает черно-бурый осадок гидроксида никеля (III) Ni(OH)3:
Выполнение опыта:
В пробирку поместить 3-4 капли раствора соли никеля (II), прибавить 3-4 капли раствора гидрооксида натрия и бромную или хлорную воду. Выпадает черно-бурый осадок.
Записать наблюдение и уравнение реакции в тетрадь. Рассмотреть уравнение с помощью метода электронного баланса.
Контрольные вопросы
1. Назовите групповые реагенты на катионы шестой аналитической группы.
2. Перечислите катионы, входящие в состав этой группы.
3. Какие элементы, катионы которых входят в состав шестой группы, проявляют переменную степень окисления?
4. Какие катионы шестой группы подвергаются гидролизу?
5. Напишите общую формулу комплексных соединений катионов шестой группы с аммиаком. Дайте названия этим соединениям.
6. Перечислите органические реагенты, применяемые для обнаружения катионов шестой группы.
7. Как действуют растворы щелочей и аммиака на катионы пятой и шестой аналитических групп? Напишите соответствующие уравнения реакций.
8. Как действует пероксид водорода в щелочной среде на кобальт (II)? Напишите соответствующее уравнение реакции и укажите цвет продукта реакции.
9. Какую окраску имеют аммиачные комплексы катионов шестой группы? Напишите их формулы.
10. Какую окраску имеетсульфид кадмия? Из каких растворов его выделяют?
11. Летучие соли каких ионов шестой групп окрашивают пламя газовой горелки? Укажите цвет пламени.
12. Для чего при растворении основной соли кобальта (II) CoOHCl и HgNH2Cl в избытке концентрированного раствора аммиака добавляют сухую соль аммония? Дайте обоснование, используя уравнения реакций растворения этих солей.
13. Какую реакцию можно использовать для дробного обнаружения ртути (II) в смеси катионов пятой и шестой групп? Напишите ее уравнение в ионном виде.
14. Почему реакцию образования диметилглиоксимата никеля проводят в аммиачной среде? Поясните, написав соответствующее уравнение реакции.
15. Напишите формулы комплексных соединений:
16. а) Cu 2+ скупроном,
17. б) Co 2+ с 1-нитрозо-2-нафтолом.
18. При выполнении какой аналитической реакции катиона кобальта (II) применяют экстракцию? Объясните необходимость ее применения.
Глава 7
Дата добавления: 2020-11-18 ; просмотров: 460 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Никель - Ni. Реакция Сульфата Никеля и Цинка. Реакция NiSO4 и Zn. Получение Никеля.Скачать

§ 46. Определение никеля в стали
Ион никеля осаждают органическим реактивом—диметилгли-оксимом (реактив Л. А. Чугаева). При действии его образуется алый кристаллический осадок диметилглиоксимата никеля (см. §29).
Накопление в растворе Н+-ионов, связывающих анионы, образуемые диметилглиоксимом, способствует течению реакции, обратной реакции образования осадка. Поэтому полнота осаждения здесь весьма сильно зависит от рН раствора. Достаточно полное осаждение достигается уже в слабокислой среде, например в присутствии ацетатной буферной смеси (CH3COOH + CH3COONa), поддерживающей рН раствора около 5. Еще лучше заканчивать
осаждение в присутствии аммонийной буферной смеси (NH4OH + NH4Cl) с рН около 9. В сильнощелочной среде растворимость осадка, так же как и в сильнокислой среде, повышается, вероятно, вследствие образования двузамещенных солей диметил-глиоксима.
Осадок диметилглиоксимата никеля обладает весьма ценными для анализа свойствами. Так, он весьма мало растворим в воде (ПР = 2,3- Ю-25), концентрация Ni2+ в его насыщенном растворе составляет около 4■1O-9 г-ион/л. Избыток осадителя еще больше понижает эту и без того весьма малую растворимость осадка. Далее, весьма ценно, что осадок получается достаточно чистым. Наконец, реакция довольно специфична. Из других катионов малорастворимые осадки с диметилглиоксимом дают только палладий и платина, которые редко встречаются при обычных анализах. Все это делает диметилглиоксим наиболее ценным осадителем Ni2+-ионов.
Применяя эту реакцию при анализе объектов, содержащих железо, его нужно предварительно окислить до Fe3+. Дело в том, что Fe2+-HOHbI, образующиеся обычно при растворении исследуемого образца в кислотах, с диметилглиоксимом дают растворимое в воде комплексное соединение красного цвета. При этом растворимость осадка диметилглиоксимата никеля увеличивается, поскольку часть диметилглиоксима связывается железом. Так как осаждение ведут, прибавляя в раствор, содержащий никель и диметилглиоксим, аммиак, то должны отсутствовать также и Регионы, образующие в этих условиях осадок Fe(OH)3. Поэтому Fe3+ предварительно маскируют прибавлением достаточного количества винной или лимонной кислоты; при этом образуются прочные комплексы железа (III).
Диметилглиоксим сравнительно мало растворим в воде. Поэтому в качестве осадителя применяют спиртовой или аммиачный раствор его. В первом случае необходимо иметь в виду, что осадок довольно значительно растворим в спирте, если концентрация спирта превышает 50%. Поэтому объем осадителя должен быть меньше, чем объем исследуемого водного раствора.
Заканчивать определение всего удобнее, отфильтровав осадок через стеклянный фильтрующий тигель и высушив его до постоянной массы при ПО—120° С, тогда весовой формой является диме-тилглиоксимат никеля, состав которого отвечает формуле (C4HTN2Oa)2Ni. Вместо этого осадок можно отфильтровать через бумажный фильтр и после промывания прокалить и взвесить полученную окись «никеля NiO. Однако это менее удобно, так как фактор пересчета будет примерно в 4 раза больше, чем в первом случае. Кроме того, при прокаливании осадка есть опасность потерять часть его вследствие возгонки, происходящей при температуре около 25O0C Чтобы избежать этого, прокаливать необходимо
при достаточном доступе воздуха, способствующем быстрому сгоранию диметилглиоксимата никеля.
Ход определения. Берут навеску стали, содержащую не более 0,03 г никеля (например, при содержании никеля до 2—3% навеска должна быть около 1 г, при большем содержании никеля ее следует соответственно уменьшать). Брать большие навески нецелесообразно, потому что осадок получается очень объемистым. Навеску переносят в стакан емкостью 300—400 мл и, накрыв его часовым стеклом, растворяют навеску при нагревании на песочной бане * или на электрической плитке в 25—30 мл разбавленного (1 : 1) раствора HCl (тяга!). Нагревание продолжают до полного прекращения выделения пузырьков водорода. Затем окисляют Fe2+, а также карбиды никеля, железа и других металлов, осторожно прибавляя к раствору 3—5 мл концентрированной HNO3-Для этого, сняв стакан с бани или плитки, слегка приподнимают с одного края часовое стекло и маленькими порциями прибавляют к раствору по стенке азотную кислоту. От первых порций ее жидкость буреет и наблюдается выделение бурых окислов азота. Окончив прибавление HNO3, снова нагревают раствор до прекра щения выделения окислов азота. После этого снимают стекло, предварительно смыв с него брызги раствора струей воды из промывалки в стакан, и разбавляют раствор водой до 1-20—150 мл. Для связывания Fe3+ прибавляют к раствору 5—7 г твердой винной кислоты (или 10—15 мл 50%-ного раствора ее). После растворения винной кислоты подщелачивают раствор аммиаком до появления запаха. В присутствии достаточного количества кислоты раствор остается совершенно прозрачным. Если раствор помутнеет при добавлении NH4OH, нужно еще добавить винной кислоты, так чтобы раствор стал прозрачным.
К аммиачному раствору прибавляют до кислой реакции разбавленную HCl. Если при этом на дне стакана появится незначительный осадок**, его отфильтровывают через неплотный фильтр и несколько раз промывают фильтр горячей водой, присоединяя промывные воды к фильтрату.
В полученном растворе осаждают Ni2+. Для этого прибавляют к нему 18—20 мл 1%-ного спиртового раствора диметилглиоксима и, нагрев раствор до 80—9O0C, сейчас же вводят в него по каплям раствор NH4OH до появления запаха, непрерывно перемешивая стеклянной палочкой содержимое стакана. Медленное прибавление аммиака способствует получению более крупнокристаллического
* Песочной баней называется металлический сосуд с песком, нагреваемый газовыми горелками или электрическим током. Изменяя толщину слоя песка, легко регулировать степень нагрева сосудов с растворами.
** Осадок может содержать углерод, а также кремневую, вольфрамовую и ниобиевую кислоты.
осадка. Этот осадок не всегда осаждается на дне стакана, иногда он может всплывать кверху. Для определения это не имеет значения.
Примерно через 1 ч после осаждения приступают к фильтрованию. Для этого предварительно подготавливают (т. е. высушивают при ПО—120 °С и доводят до постоянной массы) фильтрующий тигель № 3 или 4. Вставив его в горло колбы для отсасывания, соединяют колбу с водоструйным насосом. Перед фильтрованием проверяют полноту осаждения, прибавив к прозрачной жидкости над осадком несколько капель раствора диметилглиоксима. Далее, включив насос, приступают к фильтрованию. Осадок переносят в тигель и тщательно промывают его до отрицательной реакции на Cl—HOH в порции промывных вод, подкисленной HNO3. Промытый осадок высушивают до постоянной массы при ПО—120°С.
Вычисление. По формуле осадка (C4H7N2O2)2№ и его массе находят количество никеля в навеске и процентное содержание его в стали.
Вопросы и задачи (к § 36—46)
1. В каких случаях кристаллогидраты выветриваются на воздухе?
2. Почему происходит разложение кристаллогидратов с образованием соответствующей безводной соли при нагревании их до более или менее высокой температуры?
3. Как определяют содержание кристаллизационной воды в кристаллогидратах? О чем свидетельствует достижение постоянной массы при этом?
4. Что такое гигроскопическая вода? Как ее определяют? Какие возможны источники ошибок при определении гигроскопической воды в различных веществах?
5. Исследуемое вещество содержит 15,00% гигроскопической воды. При анализе содержание в нем азота найдено равным 4,25%. Каково процентное содержание азота в абсолютно сухом веществе?
6. Почему SO4-осаждают BaCl2, а не Ba (N03)2?
7. Обсудите условия осаждения SO4-. Почему это осаждение ведут в присутствии HCl?
8. Что происходит с BaSO4 при, озолении фильтра и при дальнейшем прокаливании осадка?
9. Какую цель преследует прокаливание до постоянной массы: а) пустого тигля; б) тигля с осадком?
10. Сколько граммов H2SO4 содержится в 1 л раствора серной кислоты, если при действии на 50,00 мл ее раствором BaCl2 получено 0,2126 г BaSO4?
11. Для чего раствор при осаждении AgCl подкисляют, нагревают и энергично перемешивают?
12. Почему при длительном промывании чистой водой хлорид серебра начинает под конец проходить сквозь фильтр и фильтрат получается мутным? Будет ли это наблюдаться при промывании AgCl раствором HNO3?
13. Почему AgCl нельзя прокаливать вместе с фильтром? Почему в этом случае лучше пользоваться стеклянными фильтрующими тиглями?
14. Выпадет ли осадок AgCl при смешении равных объемов растворов, полученных путем разбавления 1 мл 0,01 M растворов AgNO3 и KCl до объема 1 л?
Ответ: осадок не выпадет.
15. Для чего добавляют в раствор соли железа(Ш) NH4Cl перед прибавлением в раствор аммиака?
16. Почему осадок водной окиси железа можно промывать горячей водой?
17. Почему осадок при определении железа не следует прокаливать при слишком высокой температуре?
18. В чем заключаются преимущества оксихинолинового метода определения алюминия по сравнению с определением его действием NH4OH?
19. Для определения содержания металлического алюминия в бронзе прежде всего находят титриметрическим методом содержание в ней железа. Затем железо и алюминий осаждают прибавлением аммиака и, прокалив полученный осадок, находят суммарную массу Fe2O3 + Al2O3. Из полученных данных вычисляют содержание алюминия следующим образом. Найденную массу Fe, умноженную на 1,4297, вычитают из массы Fe2O3 + Al2O3 и полученную разность умножают на 0,5293. Какое значение имеют в данном случае множители 1,4297 и 0,5293?
20. Почему осаждение Ca2+ в виде оксалата выгоднее вести из кислого раствора, постепенно нейтрализуя кислоту аммиаком?
21. Какой процент от общего количества кальция, равного 0,1000 г, составляет погрешность взвешивания осадка (0,0002 г) в случае; а) весовой формы CaO; б) весовой формы CaC2O4 • H2O?
22. Как определяют содержание CO2′ в карбонатах?
23. При анализе карбоната кальция получено; а) 0,5493 г CaC2O4 • H2O из навески 0,3768 г; б) 0,4013 г CO2 из навески 0,9160 г. Насколько найденная сумма процентного содержания CaO и CO2 отличается от 100%?
24. Почему осаждение Mg2+ в виде MgNH4PO4 ведут в присутствии NH4Cl? Почему большого избытка последнего следует избегать?
25. Почему осадок MgNH4PO4 промывают не чистой водой, а разбавленным раствором NH4OH? Как проводится проба на полноту промывания?
26. Почему необходимо озоление фильтра при прокаливании MgNH4PO4 проводить осторожно?
27. Сколько процентов MgSO4 • 7H2O содержит технический препарат сульфата магния, если из навески 0,4285 г его получено 0,1920 г Mg2P2O??
28. При определении процентного содержания Mg (ж) в цементе вычисление проводят по формуле
где а — масса прокаленного осадка Mg2P2O7; g—навеска цемента. Как вычислен множитель 36,22?
29. При определении фосфора в чугунах и сталях после растворения навески в HNO3 и окислении образовавшейся фосфористой кислоты до фосфорной фосфат-ион осаждают в виде (NH4)3Р04- 12MoO3. Отфильтровав осадок, его растворяют в аммиаке, после чего осаждают молибденовую кислоту в виде PbMoO4, по массе которого и вычисляют содержание фосфора. Вычислить фактор пересчета для этого определения.
Ответ: F = 0,007031.
30. Почему при определении Ca2+ в присутствии Mg2+ приходится прибегать к переосаждению CaCaO4 • HsO? Почему при вторичном осаждении последний получается более чистым, чем при первом осаждении?
31. Почему из раствора, полученного после отделения Ca2+, приходится перед осаждением Mg2+ удалять соли аммония?
32. Какую навеску вещества, содержащего железо, нужно взять, чтобы процентное содержание железа в нем можно было найти простым умножением массы прокаленного осадка Fe2O3 на 100?
Ответ: навеска должна быть равна фактору пересчета — 0,6994.
33. Какую навеску силиката следует взять при определении в нем MgO, чтобы процентное содержание последней можно было вычислить путем умножения массы прокаленного осадка MgP2O7 на 100?
34. Какие свойства диметилглиоксимата никеля делают его весьма ценным для количественного определения иона Ni2+?
35. Почему полнота осаждения иона Ni2+ диметилглиоксимом зависит от величины рН раствора? В каких условиях обычно проводят осаждение?
36. Почему определению Ni2+ при помощи реакции с диметилглиоксимом мешает присутствие Fe2+? Как устраняют его влияние? Уравнение реакции?
37. Зачем перед осаждением никеля прибавляют винную кислоту? Как убедиться в том, что количество ее достаточно?
38. Почему выгоднее отфильтровывать осадок диметилглиоксимата никеля через фильтрующий тигель и высушивать его до постоянной массы, а не прокаливать после отделения фильтрованием через бумажный фильтр?
39. Процентное содержание никеля вычисляют по следующим формулам: а) при взвешивании в виде диметилглиоксимата никеля
📸 Видео
1.3. Алканы: Химические свойства. Подготовка к ЕГЭ по химииСкачать

Реакция Сульфата Никеля, Сульфата Аммония и Фосфата Аммония. Реакция NiSO4, (NH4)2SO4 и Na3PO4Скачать

Уравнивание реакций горения углеводородовСкачать

Реактивы ГриньяраСкачать

Реакции ионного обмена. 9 класс.Скачать

7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Именные реакции в органической химии | Химия ЕГЭСкачать

Реакции присоединения | Химия 10 класс | УмскулСкачать

Реакции ионного обмена. 9 класс.Скачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Качественная реакция на никель 2+ и калий (qualitative reaction for K+ and Ni2+)Скачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Классификация реакций: ионные и радикальные реакцииСкачать