электролиз воды это разложение воды на ее элементарные составляющие под действием электрического тока. При этом водород и молекулярный кислород образуются на двух инертных поверхностях, H2 и O2. Эти две поверхности более известны под названием электродов.
Теоретически, объем Н2 образуется должен быть в два раза больше объема O2. Почему? Поскольку молекула воды имеет отношение H / O, равное 2, то есть два H для каждого кислорода. Это соотношение проверяется непосредственно с помощью его химической формулы H2О. Однако многие экспериментальные факторы влияют на полученные объемы.
Если электролиз проводят внутри труб, погруженных в воду (верхнее изображение), столб воды меньшей высоты соответствует водороду, поскольку на поверхности жидкости присутствует большее количество газа, оказывающего давление. Пузырьки окружают электроды и в конечном итоге поднимаются после истечения давления пара воды.
Обратите внимание, что трубки отделены друг от друга таким образом, что существует низкая миграция газов от одного электрода к другому. В низких масштабах это не представляет неизбежного риска; но в промышленных масштабах газовая смесь Н2 и O2 Это очень опасно и взрывоопасно.
По этой причине электрохимические ячейки, в которых проводится электролиз воды, очень дороги; им нужны конструкция и элементы, которые гарантируют, что газы никогда не смешиваются, выгодная подача тока, высокая концентрация электролитов, специальные электроды (электрокатализаторы) и механизмы для хранения H.2 произведенный.
Электрокатализаторы представляют собой трение и в то же время крылья для прибыльности электролиза воды. Некоторые состоят из оксидов благородных металлов, таких как платина и иридий, цены на которые очень высоки. Именно в этот момент исследователи объединяют усилия для разработки эффективных, стабильных и дешевых электродов..
Причиной этих усилий является ускорение образования О2, который дается на более низких скоростях по сравнению с H2. Это замедляется электродом, где образуется О2 как общее следствие, применение потенциала намного больше, чем необходимо (перенапряжение); что то же самое, чтобы снизить производительность и более высокие расходы.
- 1 Реакция электролиза
- 1.1 Полуклеточные реакции
- 2 Процедура
- 3 Техники
- 3.1 Электролиз щелочной водой
- 3.2 Электролиз с полимерной электролитической мембраной
- 3.3 Электролиз с твердыми оксидами
- 4 Какая польза от электролиза воды??
- 4.1 Производство водорода и его использование
- 4.2 Как метод отладки
- 4.3 Как поставка кислорода
- 5 Домашний эксперимент
- 5.1 Домашние переменные
- 6 Ссылки
- Реакция электролиза
- Полуклеточные реакции
- процесс
- методы
- Электролиз щелочной водой
- Электролиз с полимерной электролитической мембраной
- Электролиз с твердыми оксидами
- Какая польза от электролиза воды?
- Производство водорода и его использование
- Как метод отладки
- В качестве источника кислорода
- Домашний эксперимент
- Домашние переменные
- Электролиз воды
- Что такое электролиз
- Электролиз воды
- Что мы узнали?
- Как происходит процесс разложения воды электрическим током
- 📸 Видео
Видео:Разложение воды на водород и кислород сигналом звуковой и ультразвуковой частоты. Ячейка Пухарича.Скачать

Реакция электролиза
Электролиз воды включает в себя много сложных аспектов. Однако в общих чертах его основа лежит в простой глобальной реакции:
Как видно из уравнения, вмешиваются две молекулы воды: одну обычно нужно уменьшить или получить электроны, а другую — окислить или потерять электроны..
H2 Это продукт восстановления воды, потому что усиление электронов способствует протонов H + может быть ковалентно связан, и кислород превращается в ОН — . Поэтому Н2 происходит на катоде, который является электродом, где происходит восстановление.
В то время как O2 происходит от окисления воды, потому что она теряет электроны, которые позволяют ей связываться с водородом, и, следовательно, высвобождает протоны H + . O2 происходит на аноде, электроде, где происходит окисление; и в отличие от другого электрода, pH вокруг анода является кислым, а не основным.
Полуклеточные реакции
Вышеизложенное можно обобщить следующими химическими уравнениями для полуклеточных реакций:
2H2O + 2e — => H2 + 2OH — (Катод, основной)
2H2O => O2 + 4H + + 4e — (Анод, кислота)
Однако вода не может потерять больше электронов (4e — ) из которых другая молекула воды побеждает на катоде (2e — ); следовательно, первое уравнение должно быть умножено на 2, а затем вычтено со вторым уравнением, чтобы получить чистое уравнение:
Но 4Н + и 4OH — они образуют 4H2Или, таким образом, они устраняют четыре из шести молекул H2Или оставив два; и в результате глобальная реакция только что изложил.
Реакции полуэлемента изменяются в зависимости от значений рН, методов, а также имеют потенциальные потенциалы восстановления или окисления, которые определяют, какой ток необходимо подавать, чтобы электролитический процесс воды происходил самопроизвольно..
Видео:Водород и кислород. 1 часть. 8 класс.Скачать

процесс
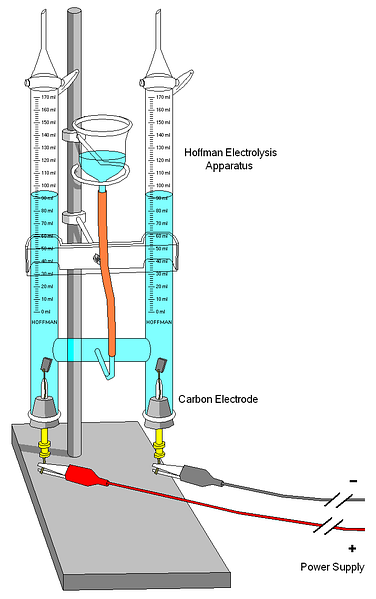
На верхнем изображении показан вольтметр Хоффмана. Цилиндры заполняются водой и выделенными электролитами через среднее сопло. Роль этих электролитов заключается в повышении проводимости воды, потому что в нормальных условиях очень мало ионов H3О + и ОН — продукты вашего авто ионизации.
Два электрода обычно платиновые, хотя на изображении они были заменены угольными электродами. Оба связаны с батареей, с которой применена разность потенциалов (ΔV), которая способствует окислению воды (образование O).2).
Электроны перемещаются по всему контуру, пока вы не достигнете другого электрода, где вода выигрывает и становится Н2 и ОН — . На данный момент анод и катод уже определены, которые могут быть дифференцированы по высоте водяных столбов; тот, который имеет меньшую высоту, соответствует катоду, где образуется Н2.
В верхней части цилиндров есть несколько клавиш, позволяющих выпускать образующиеся газы. Вы можете тщательно проверить наличие H2 заставляя его реагировать с пламенем, сгорание которого дает газообразную воду.
Видео:Опыты по химии. Разложение воды электрическим токомСкачать

методы
Методы электролиза воды варьируются в зависимости от количества Н2 и O2 что предлагается генерировать. Оба газа очень опасны, если их смешивать друг с другом, и поэтому электролизеры имеют сложную конструкцию, чтобы минимизировать увеличение газовых давлений и их диффузию через водную среду..
Кроме того, методы колеблются в зависимости от элемента, электролита, добавляемого в воду, и самих электродов. С другой стороны, некоторые подразумевают, что реакция проводится при более высоких температурах, уменьшая потребление электроэнергии, а другие используют огромные давления для поддержания H.2 хранится.
Среди всех методов можно упомянуть следующие три:
Электролиз щелочной водой
Электролиз проводят с основными растворами щелочных металлов (КОН или NaOH). С помощью этой техники происходят реакции:
Как видно, как на катоде, так и на аноде вода имеет основной pH; и кроме того, ОН — мигрировать на анод, где они окисляются до O2.
Электролиз с полимерной электролитической мембраной
В этой технике используется твердый полимер, который служит проницаемой мембраной для H + , но водонепроницаемый для газов. Это гарантирует большую безопасность при электролизе.
Полуклеточные реакции для этого случая:
Ионы Н + они мигрируют от анода к катоду, где они уменьшаются, чтобы стать H2.
Электролиз с твердыми оксидами
Очень отличающийся от других методов, он использует оксиды в качестве электролитов, которые при высоких температурах (600-900ºC) функционируют в качестве среды переноса анионов. 2- .
Обратите внимание, что на этот раз оксидные анионы, или 2- , те, кто путешествует на анод.
Видео:🔥 ЭЛЕКТРОЛИЗ ВОДЫ. ЛУЧШИЕ ЭЛЕКТРОДЫ ДЛЯ ПОЛУЧЕНИЯ ВОДОРОДА И КИСЛОРОДА.Скачать

Какая польза от электролиза воды?
Электролиз воды дает H2 (г) и О2 (G). Приблизительно 5% газообразного водорода, производимого в мире, образуется в результате электролиза воды..
H2 это побочный продукт электролиза водных растворов NaCl. Присутствие соли облегчает электролиз за счет увеличения электропроводности воды.
Глобальная реакция, которая имеет место:
Чтобы понять огромную важность этой реакции, будут упомянуты некоторые виды использования газообразных продуктов; потому что, в конце концов, именно они стимулируют разработку новых методов для достижения электролиза воды более эффективным и экологичным способом..
Из всех них наиболее желательным является использование ячеек, которые энергетически заменяют использование сжигания ископаемого топлива..
Производство водорода и его использование
-Водород, получаемый при электролизе, может быть использован в химической промышленности, действующей в реакциях зависимости, в процессах гидрирования или в качестве восстановителя в процессах восстановления..
-Кроме того, это важно в некоторых действиях, имеющих коммерческое значение, таких как: производство соляной кислоты, перекиси водорода, гидроксиламинов и т. Д. Участвует в синтезе аммиака по каталитической реакции с азотом.
-В сочетании с кислородом он производит пламя с высокой калорийностью, с температурами в диапазоне от 3000 до 3500 К. Эти температуры могут использоваться для резки и сварных швов в металлургической промышленности, для роста синтетических кристаллов, производства кварца и т. Д..
-Обработка воды: слишком высокое содержание нитратов в воде может быть уменьшено путем их удаления в биореакторах, в которых бактерии используют водород в качестве источника энергии
-Водород вмешивается в синтез пластмасс, полиэстера и нейлона. Кроме того, он является частью производства стекла, увеличивая сгорание во время выпекания.
-Реагирует с оксидами и хлоридом многих металлов, в том числе серебра, меди, свинца, висмута и ртути с образованием чистых металлов.
-И, кроме того, он используется в качестве топлива в хроматографических анализах с детектором пламени..
Как метод отладки
Электролиз растворов хлорида натрия используется для очистки воды бассейна. Во время электролиза водород образуется в катоде и хлоре (Cl2) на аноде. Говорят об электролизе в этом случае как хлоратор соли.
Хлор растворяется в воде с образованием хлорноватистой кислоты и гипохлорита натрия. Хлорноватистую кислоту и гипохлорит натрия стерилизуют водой.
В качестве источника кислорода
Электролиз воды также используется для генерации кислорода на Международной космической станции, которая служит для поддержания кислородной атмосферы на станции..
Водород можно использовать в топливном элементе, способе накопления энергии и использовать воду, которая генерируется в элементе для потребления астронавтами..
Видео:Проклятая химическая реакция 😜 #shortsСкачать

Домашний эксперимент
Эксперименты по электролизу воды проводились на лабораторных весах с помощью вольтметров Хоффмана или другой сборки, которая позволяет вместить все необходимые элементы электрохимической ячейки..
Из всех возможных сборок и оборудования самым простым может быть большой прозрачный контейнер для воды, который будет служить ячейкой. Кроме того, вы должны иметь под рукой любую металлическую или электропроводящую поверхность, которая будет выполнять функцию электродов; один для катода, а другой для анода.
Для этой цели могут быть полезны даже карандаши с острыми точками на обоих концах. И, наконец, небольшой аккумулятор и несколько кабелей, которые соединяют его с импровизированными электродами..
Если не сделать в прозрачном контейнере, образование пузырьков газа не может быть оценено.
Домашние переменные
Хотя электролиз воды является предметом, который содержит много интригующих и обнадеживающих аспектов для тех, кто ищет альтернативные источники энергии, домашний эксперимент может быть скучным для детей и других зрителей..
Следовательно, достаточное напряжение может быть приложено для формирования H-образования2 и O2 чередуя определенные переменные и отмечая изменения.
Первый — это изменение pH воды с использованием уксуса для подкисления воды или Na.2Колорадо3 немного подвести Изменение количества наблюдаемых пузырьков должно произойти.
Кроме того, тот же эксперимент можно повторить с холодной и горячей водой. Таким образом, влияние температуры на реакцию будет затем рассматриваться.
Наконец, чтобы сделать сбор данных немного менее бесцветным, вы можете прибегнуть к очень разбавленному раствору сока фиолетовой капусты. Этот сок является основным кислотным индикатором природного происхождения..
Добавляя его в емкость с введенными электродами, можно заметить, что на аноде вода станет розовой (кислотной), а на катоде окраска будет желтой (основной).
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Электролиз воды

Средняя оценка: 4.4
Всего получено оценок: 198.
Средняя оценка: 4.4
Всего получено оценок: 198.
Процесс электролиза – это окислительно-восстановительная реакция, возможная только под действием электричества. Электролиз протекает в расплавах и растворах. В лабораториях для получения чистых газов – водорода и кислорода – проводят электролиз воды.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Что такое электролиз
Для осуществления процесса электролиза в раствор или в расплав помещают два электрода, подключённых к противоположным полюсам источника тока. В качестве электродов чаще всего используется металл или графит, так как эти материалы пропускают электрический ток.

Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду – отрицательно заряженные анионы.
Катод является окислителем, на нём происходит процесс восстановления катионов. На аноде протекает процесс окисления: анод восстанавливает анионы и окисляется.
Процесс электролиза можно разделить на два этапа. Сначала происходит диссоциация – распад электролита (раствора или расплава) на ионы. Затем протекают реакции на электродах.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Электролиз воды
Если пропустить через воду электрический ток, жидкость начнёт диссоциироваться на составляющие молекулу воды атомы. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов можно получить озон и перекись водорода.
Схема электролиза воды:
Вода – слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока.
Электролит выбирается так, чтобы исключить конкуренцию между катионами электролита и катионами воды (H + ). В противном случае водород не будет произведён. Чтобы исключить конкуренцию, необходимо подобрать электролит, катионы которого будут иметь меньший электродный потенциал, чем H + воды. На роль катиона электролита подходят:
Для исключения конкуренции анионов, наоборот, подбирают электролит с анионами большего электродного потенциала, чем анион OH – воды. В качестве такого электролита применяется щелочь для образования гидроксильного иона OH – .
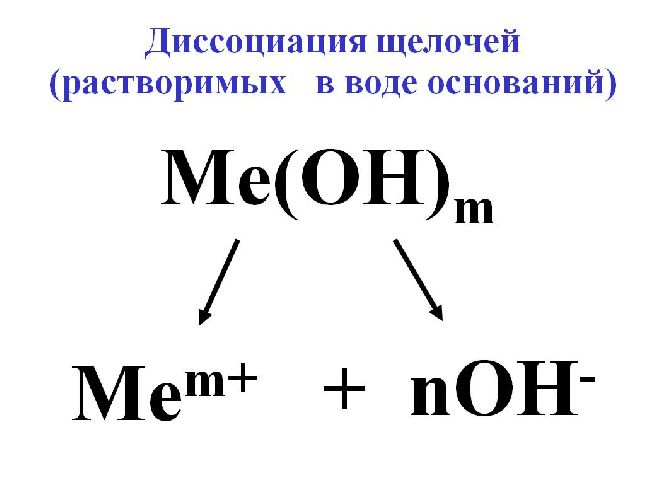
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Видео:Водород. 8 класс.Скачать

Что мы узнали?
Электролиз – процесс образования и оседания на электродах ионов вещества под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциируется на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляется сильный электролит, не мешающий образованию водорода и кислорода. Чаще всего добавляется щёлочь или сильная кислота.
Видео:Водород и кислород в воде расщепляются электролизомСкачать

Как происходит процесс разложения воды электрическим током
Чистая, дистиллированная вода почти совершенно не проводит электрического тока.
Она обладает огромным сопротивлением. Например, сопротивление кубического сантиметра дважды перегнанной воды равно сопротивлению медной проволоки сечением в квадратный миллиметр, длина которой равна примерно 200 тысячам километров. Таким количеством проволоки можно больше чем 20 раз соединить между собой Москву и Владивосток. Для электролиза дистиллированная вода не годится. Нужна такая вода, которая бы хорошо проводила электрический ток, то есть была бы электропроводной.
Чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
Большинство химических соединений, растворяясь в воде, распадаются на части, которые приобретают при этом тот или иной заряд. Образующиеся заряженные частицы называются ионами, а разложение вещества на ионы — электролитической диссоциацией.
Обыкновенная поваренная соль (NaCl) при растворении в воде распадается на ион натрия (Na + ), заряженный положительно, и ион хлора (Сl — ), заряженный отрицательно. Ионы натрия и хлора, имеющие только по одному заряду, называются одновалентными ионами. Ионы, которые имеют два или три заряда, называются двух- или трехвалентными. В качестве примера двухвалентного иона можно привести ион кальция (Са). Хлористый кальций (СаСl2), диссоциируя на ионы, дает два одновалентных отрицательных иона хлора (2Сl) и один двухвалентный ион кальция (Са), заряженный положительно. Треххлористое железо (FeCl3) при диссоциации на ионы дает три одновалентных отрицательных иона хлора (3Сl — ) и один трехвалентный положительный ион железа (Fe +++ ).
Итак, при электролитической диссоциации соли образуются отрицательно заряженные ионы, которые называются анионами, и положительно заряженные ионы — катионы.
Кислоты при диссоциации образуют положительно заряженный ион водорода и отрицательно заряженный кислотный остаток. Серная кислота (H2SO4) распадается на два положительно заряженных иона водорода (2Н + ) и кислотный остаток — анион (SO4 — ), обладающий двумя отрицательными зарядами.
Щелочи при диссоциации образуют положительный ион металла и отрицательный ион гидроксила. Положительные и отрицательные ионы, образующиеся при растворении в воде солей, кислот и оснований, переносят через раствор электрический ток.
Если в раствор, содержащий ионы, поместить две металлические пластинки и подключить к ним постоянный ток от аккумулятора, то положительные ионы — катионы — сразу же начнут передвигаться к отрицательному электроду, который называется катодом, а отрицательные ионы — анионы — направятся к положительному полюсу — аноду. Находящиеся у электрода анионы отдадут ему свои отрицательные заряды — электроны (е) — и разрядятся. В то же самое время разрядятся и катионы, получив электроны от своего электрода. Их места тут же занимают новые ионы, и через раствор начинает проходить электрический ток. Чем больше ионов в растворе, тем лучше через него будет проходить электрический ток и тем больше электропроводность такого раствора.
Чтобы получить много ионов, недостаточно растворить много вещества. Необходимо, чтобы взятая соль, кислота или основание хорошо распадались на ионы, то есть хорошо диссоциировали. Имеются такие химические соединения, которые диссоциируют очень хорошо, и почти все молекулы растворенного вещества распадаются на ионы. Но есть и такие, которые диссоциируют плохо: только очень незначительная часть всех растворенных молекул распадается на ионы, а остальные остаются в виде недиссоциированных молекул.
Отношение числа распавшихся молекул к общему числу растворенных молекул называется степенью диссоциации. Чем меньше степень диссоциации, тем хуже электропроводность раствора.
К соединениям, обладающим плохой электропроводностью, относится дистиллированная вода. Подсчитано, что из 10 миллионов молекул воды на ионы распадается только одна молекула, образуя один положительно заряженный ион водорода (Н + ) и один отрицательно заряженный ион гидроксила (ОН — ). Понятно, что при такой малой диссоциации электропроводность дистиллированной воды должна быть совершенно ничтожной и она не может быть использована для электролиза. Вот почему для получения из воды кислорода необходимо иметь подкисленную или подщелоченную воду.
Прохождение электрического тока через раствор: 1 — катод; 2 — анод; 3 — положительно заряженные ионы — катионы; 4 — отрицательно заряженные ионы — анионы.
Нам уже известно, что кислота в воде диссоциирует на ионы водорода и кислотный остаток, а щелочь — на ионы металла и ионы гидроксила. Естественно было бы ожидать, что в растворе, подкисленном серной кислотой, на катоде будут разряжаться ионы водорода, а на аноде — ионы SO4 — . Ионы водорода, разрядившись, перейдут в атомы, которые, соединяясь попарно, дадут молекулу водорода, а ионы SO4 — , отдав свой заряд электроду, перейдут в раствор в виде незаряженного кислотного остатка — радикала SO4. Соединяясь с водой, этот радикал образует серную кислоту и кислород.
Можно было бы ожидать, что в щелочных растворах ионы натрия (Na + (e) → Na) разрядятся на катоде, переходя в атомы натрия, которые, соединяясь с водой, дадут щелочь и водород (2Na + 2H2O → 2NaOH + H2). На аноде ионы гидроксила, потеряв свои электроны, соединятся попарно, образуя из радикалов воду, освобождая кислород (4OH — — 4(e) → 2H2O + O2).
Однако в действительности в кислых и щелочных растворах процесс образования кислорода и водорода происходит иначе.
Несмотря на то, что в щелочных растворах имеется очень много ионов натрия и мало ионов водорода, на катоде в первую очередь разряжаются ионы водорода.
В растворах, подкисленных серной кислотой, на аноде прежде всего разряжаются ионы гидроксила, полученные за счет диссоциации воды, а не ионы SO4 — , которых неизмеримо больше. Это объясняется тем, что разряд ионов водорода или гидроксила происходит легче, чем ионов натрия или SO4 — . Поэтому в щелочных растворах, которые обычно применяются для электролиза воды, на катоде разряжаются главным образом ионы водорода, а на аноде — ионы гидроксила. Как только эти ионы разрядятся, немедленно образуются новые ионы за счет диссоциации молекул воды.
Таким образом, при электролитическом получении кислорода и водорода расходуется только вода. Литр воды дает примерно 1360 литров водорода и 680 литров кислорода.
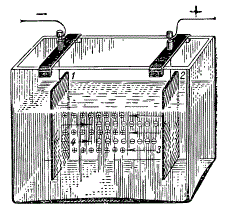
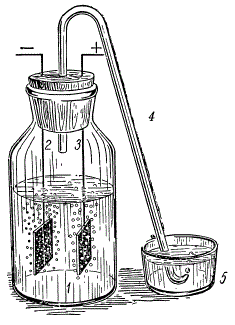
Электролиз воды: 1 — банка с электролитом; 2 — катод, на котором выделяется водород; 3 — анод, на котором выделяется кислород; 4 — трубка для отвода газов; 5 — чашечка с водой.
Под руководством учителя и соблюдая меры предосторожности, можно сделать опыт, показывающий, как разлагается вода.
Возьмите банку с широким горлом и наполните ее на две трети 20-процентным водным раствором щелочи. Плотно закройте банку пробкой, в которую вставлены две никелевые проволочки с небольшими пластинками на концах — электродами. В середину пробки вставьте коротким концом загнутую стеклянную трубку, через которую будут выходить газы. Второй, длинный конец трубки опустите в чашку с водой, чтобы в нее во время опыта не попадал воздух. Подключите к верхним концам электродов постоянный ток от двухвольтового аккумулятора. На электродах под раствором сразу же появятся пузырьки газа. Это кислород и водород, которые, смешиваясь, образуют гремучий газ.
Вспомним свойство этой смеси газов. Если ее поджечь, она легко взрывается.
Поэтому подходить с огнем к банке опасно.
Чтобы убедиться, что в банке образовались кислород и водород, пропустите сначала немного газа через чашечку с чистой водой, а затем поставьте вместо нее чашечку с мыльной водой.
Образуются мыльные пузыри, наполненные гремучим газом. Раздастся легкий взрыв.
В пузыре была гремучая смесь — смесь одного объема кислорода с двумя объемами водорода.
Мы пока только разложили воду, но не разделили образовавшиеся газы и не получили кислорода.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
📸 Видео
Физические и химические свойства водыСкачать

Водород/химические свойства водорода/8 классСкачать

Разложение воды недетским напряжением. Механизм диссоциации. H2-13Скачать

Галилео. Эксперимент. Разложение перекиси водородаСкачать

Кислород. Физические свойства. Получение. Урок 17. Химия 7 класс.Скачать

ННО 1. Разложение воды на водород и кислород при минимальных нагрузкахСкачать

Почему при электролизе воды водород и кислород выделяется на электродах, а не в объеме.Скачать

Электролиз с получением чистого водорода, химическая сепарация водорода и кислорода.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Электролиз воды на водород и кислородСкачать