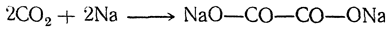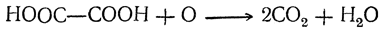Щавелевая кислота образуется часто при окислении, различных органических веществ. Раньше ее получали окислением древесных опилок кислородом воздуха при нагревании их с расплавленными едкими щелочами. При этом для прохождения реакции обязательно требуется присутствие хотя бы небольшого количества едкого кали; с чистым едким натром получение щавелевой кислоты невозможно. Окисление сахара азотной кислотой в присутствии пятиокиси ванадия как катализатора применяется и теперь для технического получения щавелевой кислоты
(отсюда и произошло в свое время название этой кислоты — «сахарная соль»). Другой промышленный способ получения щавелевой кислоты основан на том, что при быстром нагревании до 360° С формиат натрия (а также калия) отщепляет водород, превращаясь в оксалат натрия. Так как формиат натрия получается из окиси углерода и едких щелочей, то практически щавелевую кислоту можно получить непосредственно из этих веществ.
Существует много способов получения щавелевой кислоты, представляющих теоретический интерес. Например, при взаимодействии щелочных металлов с углекислым газом при 360° С получается соль щавелевой кислоты:
При кристаллизации из воды щавелевая кислота обыкновенно получается в виде гидрата С2Н2О4 ∙ 2Н2О. Этот гидрат начинает диссоциировать уже выше 30° С. При очень быстром нагревании он плавится при 101,5° С. Безводная кислота в виде ромбических октаэдров может быть получена кристаллизацией из 70%-ной серной кислоты, а также высушиванием при осторожном нагревании (лучше — в вакууме). При возгонке щавелевая кислота получается в двух кристаллических формах: при низких температурах в вакууме — иглы, при более высоких — октаэдры. Безводная кислота плавится при 180° С с разложением.
На этом основано применение щавелевой кислоты и ее солей как восстановителей, а также использование ее в анализе для установления титра растворов перманганата.
При нагревании щавелевая кислота разлагается (особенно легко в присутствии концентрированной серной кислоты) на окись углерода, углекислоту и воду:
Таким образом, теоретически возможный ангидрид щавелевой кислоты оказывается неспособным к существованию.
Щавелевая кислота как двухосновная дает кислые и средние соли (оксалаты). Известны также и молекулярные соединения кислых оксалатов со щавелевой кислотой («тетраоксалаты»), как, например, кисличная соль КНС2О4 ∙ Н2С2О4 ∙ 2Н2О, употребляемая для выведения чернильных пятен.
Из солей щавелевой кислоты растворимы в воде лишь соли щелочных металлов. Щавелевокислый кальций нерастворим в воде и уксусной кислоте, но растворим в соляной кислоте; эти его свойства используются в качественном и количественном анализе для определения кальция. При обыкновенной температуре он кристаллизуется с одной молекулой воды, при более низких температурах — с тремя молекулами воды.
Щавелевая кислота легко дает комплексные соли, например K2[Fe(C2O4)2] и K3[Fe(C2O4)3]. В растворах этих солей содержатся комплексные ионы — двухзарядный ион Fe(C2O4)2 2– и трехзарядный ион Fe(C2O4)3 3– . Растворы первой из указанных солей имеют желтый цвет; эта соль применяется в качестве проявителя в фотографии.
Растворы второй соли окрашены в зеленый цвет.
Видео:ЩАВЕЛЕВАЯ КИСЛОТАСкачать

Разложение щавелевой кислоты при нагревании уравнение

С целью установления причин такого явления рассмотрим процессы, происходящие при нагревании щавелевой кислоты.
В первую очередь происходит разрушение входящего в состав технической кислоты кристаллогидрата, который плавится при температуре 101,5 о С (чистая кислота — при 189 о С). При 200 о С щавелевая кислота разлагается с образованием муравьиной кислоты и углекислого газа. При более высокой температуре, что часто имеет место при работе на пасеках с использованием простых, нерегулируемых способов нагрева (примуса, паяльной лампы, раскаленных углей), происходит деструкция муравьиной кислоты до воды и окиси углерода (угарного газа). Так как окись углерода—токсичное вещество, то, возможно, ее действие и есть одна из причин гибели маток или ухудшения их качества, приводящих к тихой смене.
Разложение образующейся муравьиной кислоты до воды и окиси углерода можно избежать, если проводить нагрев щавелевой кислоты в глицерине, которая образует с ним моноглицерооксалат, легко декарбоксилирующийся с образованием моноформина и углекислого газа.
Моноформин при избытке щавелевой кислоты образует снова моноглицерооксалат с выделением муравьиной кислоты. Температура кипения муравьиной кислоты 101 о С, и она испаряется не перегреваясь. Из-за наличия в реакционной среде воды моноформин частично гидролизуется до глицерина, который вновь принимает участие в реакции со следующим количеством щавелевой и муравьиной кислот.
Массовое соотношение исходных компонентов в реакционной смеси примерно одинаковое. Уменьшение количества глицерина и возможный перегрев реакционной массы, вероятность которого мала вследствие испарения образующихся высоколетучих веществ (воды, муравьиной кислоты), могут привести к дегидратации глицерина с образованием акролеина — непредельного альдегида, обладающего лакриматорным (слезоточивым) действием.
Таким образом, используя реакцию образования сложного эфира из глицерина и щавелевой кислоты с последующей его деструкцией, можно обработать большое число пчелиных семей образующейся муравьиной кислотой, значительно уменьшив вероятность ее разложения до высокотоксичной окиси углерода, приводящей к гибели маток, снижению их продуктивности или склонности пчел к их смене.
Военный университет радиационной,
химической и биологической защиты
(филиал, г. Тамбов)
Аннотация:
в статье рассказано о реакциях, протекающих при нагревании щавелевой кислоты в процессе обработки пчел от клеща варроа. Применение глицерина позволяет снизить температуру, вызывающую разложение щавелевой кислоты до муравьиной, и предотвратить нежелательные последствия для пчел.
Видео:Разложение щавелевой кислотыСкачать

Опыт 5. Разложение муравьиной и щавелевой кислот при нагревании с концентрированной серной кислотой
Лабораторная работа №3.
Тема: Карбоксильные соединения (Карбоновые кислоты).
Цель: исследовать химические свойства карбоксильных соединений: карбоновых кислот и сложных эфиров.
Опыт 1. Кислотные свойства карбоновых кислот.
Реактивы и материалы: уксусная кислота, 0,1 н. раствор; магний (порошок или стружка); карбонат натрия; баритовая вода; метиловый оранжевый, раствор; лакмус синий, раствор; фенолфталеин, 1 %-ный спиртовой раствор.
1.В три пробирки помещают по 1 капле раствора уксусной кислоты. В первую пробирку добавляют 1 каплю метилового оранжевого, во вторую – 1 каплю лакмуса и в третью — 1 каплю фенолфталеина. В пробирке с метиловым оранжевым появляется красное окрашивание, в пробирке с лакмусом — розовое. Фенолфталеин остается бесцветным.
2.В пробирку помещают 2 капли раствора уксусной кислоты и добавляют немного магния. К отверстию пробирки подносят горящую лучинку. При этом наблюдается вспышка, сопровождающаяся резким звуком, характерным для вспышки смеси водорода и воздуха.
3. В пробирку наливают 2-3 капли раствора уксусной кислоты и добавляют несколько крупинок углекислого натрия. К отверстию пробирки подносят горящую лучинку. Лучинка гаснет.
Карбоновые кислоты в водном растворе диссоциируют с образованием карбоксилат-аниона и протона:
R-COOH ↔ RCOO — + H +
Протон гидроксида в карбоксильной группе отщепляется легче, чем в спиртах (влияние полярной карбонильной группы). Образование карбоксилат-аниона является причиной увеличения кислотности карбоновых кислот по сравнению со спиртами.
На легкость отщепления протона влияет также радикал, связанный с карбоксильной группой. Поэтому карбоновые кислоты дают характерное окрашивание с индикаторами, проводят электрический ток, т. е. являются электролитами. Карбоновые кислоты по сравнению с неорганическими — слабые кислоты. Константа диссоциации у них порядка 10 -5 .
Опыт 2. Образование и гидролиз уксуснокислого железа.
Реактивы и материалы: уксуснокислый натрий кристаллический; хлорид железа FeCl3, 0,1 н. раствор.
В пробирку помещают несколько кристалликов уксуснокислого натрия, 3 капли воды и 2 капли раствора хлорида железа (III). Раствор окрашивается в желтовато-красный цвет в результате образования железной соли уксусной кислоты. Раствор нагревают до кипения. Тотчас же выпадают хлопья основных солей красно-бурого цвета.
Уксусная кислота, как и большинство карбоновых кислот, слабая кислота. Поэтому ее соли легко гидролизуются с образованием основных солей и продуктов водного гидролиза.
Опыт 3. Качественная реакция α-оксикислот с хлоридом железа (III).
Реактивы и материалы: хлорид железа (III), 0,1 н. раствор; фенол, водный раствор; молочная кислота; уксусная кислота концентрированная.
В две пробирки вводят по 1 капле раствора хлорида железа и добавляют по 2 капли раствора фенола. Растворы окрашиваются в фиолетовый цвет. В одну пробирку добавляют 2 капли молочной кислоты, а в другую — столько же капель уксусной кислоты. В пробирке с молочной кислотой появляется зеленовато-желтое окрашивание, в пробирке с уксусной кислотой цвет раствора не изменяется.
α-Оксикислоты вытесняют фенол из комплексного фенолята, и фиолетовая окраска раствора переходит в желтую.
В присутствии молочной кислоты фиолетовый цвет железного комплекса изменяется на зеленовато-желтый вследствие образования лактата железа (молочнокислого железа):
Эта реакция представляет большой интерес и используется в клинической практике для определения молочной кислоты (как патологического продукта) в желудочном соке.
Опыт 4. Цветная реакция салициловой, галловой кислоты и танина с хлоридом железа (III).
Реактивы и материалы: салициловая кислота, насыщенный раствор; этиловый спирт 96%-ный; галловая кислота, танин (насыщенные растворы); хлорид железа (III), 0,1 н. раствор.
В пробирку вводят 2 капли раствора салициловой кислоты и прибавляют I каплю раствора хлорида железа. Раствор окрашивается в темно-фиолетовый цвет, что указывает на наличие в салициловой кислоте фенольного гидроксила. Добавляют к раствору 4 капли этилового спирта; окраска не исчезает (в отличие от фенола).
В одну пробирку вносят 2 капли раствора галловой кислоты, в другую — 2 капли танина, прибавляют в каждую пробирку по капле раствора хлорида железа. Галловая кислота с хлоридом железа дает зеленовато-черное окрашивание, а танин — сине-черное.
Опыт 5. Разложение муравьиной и щавелевой кислот при нагревании с концентрированной серной кислотой.
Реактивы и материалы: муравьиная кислота безводная; серная кислота концентрированная (d == 1,84 г/см 3 ); щавелевая кислота кристаллическая; баритовая вода, насыщенный раствор. Оборудование: газоотводная трубка.
В пробирку приливают 3 капли муравьиной кислоты, 3 капли концентрированной серной кислоты и нагревают смесь в пламени горелки. Бурно выделяется газ. При поджигании газ горит голубоватыми вспышками.
Муравьиная кислота под действием концентрированной серной кислоты разлагается с образованием оксида углерода. Это свойство отличает муравьиную кислоту от остальных карбоновых кислот.
В пробирку помещают несколько кристаллов щавелевой кислоты и добавляют 2 капли серной кислоты. Пробирку закрывают пробкой с газоотводной трубкой и нагревают на пламени горелки. Поджигают выделяющийся газ — он горит голубоватыми вспышками. После этого конец газоотводной трубки опускают в баритовую воду. Баритовая вода мутнеет.
Под действием концентрированной серной кислоты щавелевая кислота в отличие от других двухосновных кислот разлагается.
📹 Видео
Борьба с клещом Варроа парами щавелевой кислотыСкачать

Щавелевая Кислота - КАЧЕСТВЕННАЯ РЕАКЦИЯСкачать

Сублимация VS метод пролива щавелевой кислоты (Боб Бинни, США)Скачать

ИСПАРИТЕЛЬ ДЛЯ ЩАВЕЛЕВОЙ КИСЛОТЫ, ТЕМПЕРАТУРА ИСПАРЕНИЯ И ПРЕВРАЩЕНИЯ.Скачать

Профессор Кашковский про обработку щавелевой кислотой на сахарном сиропеСкачать

ИТОГИ ОБРАБОТКИ ПЧЕЛ. ЩАВЕЛЕВОЙ КИСЛОТОЙ (методом возгонки)Скачать

Щавелевая кислота. Как и когда применять.Скачать

Профессор Кашковский про обработку сублиматором щавелевой кислотойСкачать

Щавелевая кислота убивает пчел.Скачать

Как запомнить название соли щавелевой кислоты #школьнаяхимия #репетиторпохимии #химияскатей #егэСкачать

Щавелевая кислота. Секреты пчеловодства от Кашковского В.Г.Скачать

сублиматор для испарения щавелевой кислотыСкачать

КАК РАБОТАЕТ ЩАВЕЛЕВАЯ КИСЛОТА ПРОТИВ КЛЕЩАСкачать

#Рахматулин Д.К. Сублимация щавелевой кислотыСкачать

Сублиматор щавелевой кислоты Щавелевая кислота и аскосферозСкачать

Щавелевая кислота. Как её использовать и зачем.Скачать

5 ЗОЛОТЫХ ПРАВИЛ ПРИ ОБРАБОТКЕ ОТ ВАРРОА ЩАВЕЛЕВОЙ КИСЛОТОЙ СУБЛИМАТОРОМ. ДЛЯ НАЧИНАЮЩИХ ПЧЕЛОВОДОВСкачать

Качество и срок годности щавелевой кислоты.Скачать