Разложение пероксида водорода это процесс разделения молекулы пероксида водорода на воду и кислород, так как концентрированная перекись непрочное соединение, уже при комнатной температуре на свету разлагается по реакции (формула разложения пероксида водорода):
Реакция ускоряется со прикосновением с катализаторами ( MnO2 , PbO2 и другие ).
- Каталитическое разложение пероксида водорода
- Лабораторное разложение перекиси водорода
- Активность катализатора
- Опыт разложение пероксида водорода
- Физические свойства пероксида водорода Н2О2
- Можно ли получить перекись водорода из водорода и кислорода
- Похожие страницы:
- Leave a Comment
- Получение, строение и свойства пероксида водорода
- ВОДОРОДА ПЕРОКСИД
- Физические свойства.
- Реакция разложения.
- Химические свойства Н2О2.
- Получение Н2О2.
- Применение Н2О2.
- 💥 Видео
Видео:Галилео. Эксперимент. Разложение перекиси водородаСкачать

Каталитическое разложение пероксида водорода
Пероксид водорода весьма удобный объект для иллюстрации каталитического процесса, влияния различных катализаторов на скорость химической реакции.
Измерение объема кислорода, выделяющегося при разложении пероксида водорода, позволяет проводить этот опыт количественно, притом с достаточной степенью точности.
Активные вещества которые участвуют в интенсивном распаде молекулы пероксида водорода являются металлы переменной валентности (Fe, Сu, Мn, Со, Сr) и их соли.
Разложение пероксида водорода катализаторами сводится к увеличению электролитической диссоциации пероксида водорода, что содействует образованию свободного гидроксид – иона и ускорению распада пероксида водорода.
Разложение пероксида водорода обратимая или нет.
Экспериментально доказано, что добавление к перекиси катализатора приводит к полному разложения молекулы пероксида водорода на воду и кислород. Процесс разложения на прямую зависит от температуры вещества.
А также какой катализатор добавлен, также установлено, что на каталитический процесс разложения влияет добавление некоторых кислот и зависимость концентрации перекиси.
Лабораторное разложение перекиси водорода

То, что было осуществлено в науке химии как нечто новое, может быть повторено на внеурочных и факультативных занятиях как интересные ученические исследования.
Pис. 2 Установка для количественного опыта разложения пероксида водорода:
1-колба для перегонки, 2 — пробирка с катализатором. 3 — чаша кристаллизационная, 4 — эвдиометр.
Во время проведения демонстрационных экспериментов следует знать о пероксиде водорода (обычно 3%-ном) как о веществе, которое подвергается бурному разложению под действием различных катализаторов.
С этой целью в демонстрационные пробирки приливают по 30 мл раствора пероксида водорода и в каждый вносят одно из следующих веществ: оксид марганца (IV), оксид железа (III), активированный уголь, раствор перманганата калия, раствор хлорида железа (III), раствор дихромата калия, кусочек сырого мяса, содержащий фермент каталазу, находящуюся обычно в крови млекопитающих и человека.
Наблюдают за выделением пузырьков газа. Выделение кислорода подтверждают тлеющей лучинкой. Демонстрационные пробирки размещают в штативе с подсветом.
Количественный опыт каталитического разложения пероксида водорода может быть осуществлен в установке, показанной на рисунке 2.
Для собирания газа можно использовать промышленный эвдиометр, имеющий градуировку. Различную скорость образования кислорода можно наблюдать в приборе, описание которого дано В. С. Полосиным, с использованием двух медицинских шприцев, а также с помощью установки для проецирования опытов на экран.
Активность катализатора

Рис. 3. Определение активности различных катализаторов:
1 — пробирка с пероксидом водорода, 2 — колба с катализатором, 3 — стеклянная трубка с пробкой, 4 — Г образная газоотводная трубка, 5 — колба с водой, 6 — сифон, 7 — стакан с водой, 8 — зажимы.
Опыт разложение пероксида водорода
Рекомендуется проводить опыты в следующей последовательности:
- Проверяют герметичность прибора (рис. 3), для чего закрывают пробки и открывают зажимы 8: вода не должна вытекать в стакан.
- В пробирку 1 наливают 5 мл пероксида водорода (30%-ного) и перекрывают резиновую трубку зажимом 8.
- В колбу 2 вносят катализатор и вставляют в нее трубку 3, соединенную с пробиркой 1.
- Выравнивают давление внутри прибора с атмосферным давлением. С этой целью открывают зажим 8 сифона 6 и поднимают стакан 7 с водой так, чтобы вода в нем и в колбе находилась на одинаковом уровне, и затем снова закрывают зажим.
- Воду выливают из стакана и наливают в него точный ее объем — 100 мл, предварительно отмерив его мензуркой.
- Опускают кончик сифона 6 в стакан 7 с водой.
- Открывают оба зажима 8 на приборе и быстро вливают пероксид водорода в колбу 2 с катализатором.
- Через 3 мин вновь приводят давление внутри прибора к атмосферному давлению.
- Закрывают зажим сифона 6 и измеряют объем воды, вытесненной в стакан кислородом.
- Из измеренного объема воды вычитают 100 мл, т. е. объем воды, ранее добавленной в стакан.
По количеству выделившегося кислорода располагают испытанные катализаторы в порядке возрастания их каталитической активности.
Физические свойства пероксида водорода Н2О2
Сильный окислитель. Мол. массе 34,01; коэф. рефр. 1,4067 при 25 °С; плотн. 1448 кг/м3; т. кил 69,7 °С при 3,72 кПа и 80,2 °С при 6,25 кПа. Смешивается в любых соотношениях с водой.
При воздействии 65% -ного р-ра Н2О2 на бумагу, опилки и другие горючие вещества происходит их воспламенение.
Концентрированный раствор может взрываться. Для раствора пероксида водорода низкой концентрации возможно саморазложение при воздействии тепла.
В присутствии органической пыли или веществ, действующих каталитически (металлы, соли металлов).
Хранить растворы пероксида водорода в темном прохладном месте. В присутствии Н2О2 средства тушения обильные струи воды.
Можно ли получить перекись водорода из водорода и кислорода
Можно ли получить Н2О2 непосредственным взаимодействием водорода и кислорода? В реакции взаимодействия водорода с кислородом образуется пероксид водорода в качестве промежуточного продукта при горении водорода:
Так как температура горения водорода очень высока перекись водорода сразу же разлагается на воду и кислород:
Для определения образования перекиси водорода можно воспользоваться кусочком льда. Для этого нужно направить водородное пламя на кусок льда.
В образующейся воде можно обнаружить следы пероксида водорода. Также пероксид водорода можно получить при действии атомарного водорода на кислород.
Непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Статья на тему Разложение пероксида водорода
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Опыты по химии. Каталитическое разложение пероксида водородаСкачать

Получение, строение и свойства пероксида водорода
Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н + , а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н + + 2 
На аноде: 2HSО4 — — 2 
или 2H2SO4 = H2S2O8 + 2H + + 2
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде — HSО4 — . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2 
На аноде: 2HSО4 — — 2 
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Решение:
Молекула H2O2 неплоская, имеет строение H−O−O−H с 
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О—О (210 кДж/моль) почти в 2 раза меньше энергии связи О—Н (468 кДж/моль), длина связи О—О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150 °С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( 
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Уравнения электронного баланса:
4О — = О2 0 + 2О 2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10 -3 м 3 . Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
где w% — массовая доля вещества В; m(B) – масса вещества В; m(р-ра) – масса раствора.
Видео:Гомогенное каталитическое разложение пероксида водородаСкачать

ВОДОРОДА ПЕРОКСИД
ВОДОРОДА ПЕРОКСИД – (старое название – перекись водорода), соединение водорода и кислорода Н2О2, содержащее рекордное количество кислорода – 94% по массе. В молекулах Н2О2 содержатся пероксидные группы –О–О– (см. ПЕРОКСИДЫ), которые во многом определяют свойства этого соединения.
Впервые пероксид водорода получил в 1818 французский химик Луи Жак Тенар (1777 – 1857), действуя сильно охлажденной соляной кислотой на пероксид бария:
BaO2 + 2HCl ® BaCl2 + H2O2. Пероксид бария, в свою очередь, получали сжиганием металлического бария. Для выделения из раствора Н2О2 Тенар удалил из него образовавшийся хлорид бария: BaCl2 + Ag2SO4 ® 2AgCl + BaSO4. Чтобы не использовать дорогую соль серебра в последующем для получения Н2О2 использовали серную кислоту: BaO2 + H2SO4 ® BaSO4 + H2O2, поскольку при этом сульфат бария остается в осадке. Иногда применяли другой способ: пропускали углекислый газ во взвесь ВаО2 в воде: BaO2 + H2O + CO2 ® BaCO3 + H2O2, поскольку карбонат бария также нерастворим. Этот способ предложил французский химик Антуан Жером Балар (1802–1876), прославившийся открытием нового химического элемента брома (1826). Применяли и более экзотические методы, например, действие электрического разряда на смесь 97% кислорода и 3% водорода при температуре жидкого воздуха (около –190° С), так был получен 87%-ный раствор Н2О2.
Концентрировали Н2О2 путем осторожного упаривания очень чистых растворов на водяной бане при температуре не выше 70–75° С; так можно получить примерно 50%-ный раствор. Сильнее нагревать нельзя – происходит разложение Н2О2, поэтому отгонку воды проводили при пониженном давлении, используя сильное различие в давлении паров (и, следовательно, в температуре кипения) Н2О и Н2О2. Так, при давлении 15 мм рт.ст. сначала отгоняется в основном вода, а при 28 мм рт.ст. и температуре 69,7° С, отгоняется чистый пероксид водорода. Другой способ концентрирования – вымораживание, так как при замерзании слабых растворов лед почти не содержит Н2О2. Окончательно можно обезводить поглощением паров воды серной кислотой на холоде под стеклянным колоколом.
Многие исследователи 19 в., получавшие чистый пероксид водорода, отмечали опасность этого соединения. Так, когда пытались отделить Н2О2 от воды путем экстракции из разбавленных растворов диэтиловым эфиром с последующей отгонкой летучего эфира, полученное вещество иногда без видимых причин взрывалось. В одном из таких опытов немецкий химик Ю.В.Брюль получил безводный Н2О2, который обладал запахом озона и взорвался от прикосновения неоплавленной стеклянной палочки. Несмотря на малые количества Н2О2 (всего 1–2 мл) взрыв был такой силы, что пробил круглую дыру в доске стола, разрушил содержимое его ящика, а также стоящие на столе и поблизости склянки и приборы.
Видео:Разложение пероксида водородаСкачать

Физические свойства.
Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см 3 ). Замерзает Н2О2 при температурой немного меньшей, чем температура замерзания воды – при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30° С, а 60%-ный – при минус 53° С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2° С. Смачивает стекло Н2О2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
В статье, посвященной получению пероксида водорода, Тенар не очень удачно сравнил это вещество с сиропом, возможно, он имел в виду, что чистый Н2О2, как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н2О2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода – «густая сиропообразная жидкость», и даже объясняют это теоретически – образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп.
Видео:Реакции разложенияСкачать

Реакция разложения.
Чистый пероксид водорода – вещество очень опасное, так как при некоторых условиях возможно его взрывное разложение: Н2О2 ® Н2О + 1/2 О2 с выделением 98 кДж на моль Н2О2 (34 г). Это очень большая энергия: она больше, чем та, которая выделяется при образовании 1 моля HCl при взрыве смеси водорода и хлора; ее достаточно, чтобы полностью испарить в 2,5 раза больше воды, чем образуется в этой реакции. Опасны и концентрированные водные растворы Н2О2, в их присутствии легко самовоспламеняются многие органические соединения, а при ударе такие смеси могут взрываться. Для хранения концентрированных растворов используют сосуды из особо чистого алюминия или парафинированные стеклянные сосуды.
Чаще приходится встречаться с менее концентрированным 30%-ным раствором Н2О2, который называется пергидролем, но и такой раствор опасен: вызывает ожоги на коже (при его действии кожа сразу же белеет из-за обесцвечивания красящих веществ), при попадании примесей возможно взрывное вскипание. Разложение Н2О2 и его растворов, в том числе и взрывное, вызывают многие вещества, например, ионы тяжелых металлов, которые при этом играют роль катализатора, и даже пылинки.
Взрывы Н2О2 объясняются сильной экзотермичностью реакции, цепным характером процесса и значительным снижением энергии активации разложения Н2О2 в присутствии различных веществ, о чем можно судить по следующим данным:
| Катализатор | Энергия активации, кДж/моль | Относительная скорость реакции при 25° С |
| Без катализатора | 73 | 1 |
| Ионы I – | 56 | 1,1·10 3 |
| Платина | 48 | 2,3·10 4 |
| Ионы Fe 2+ | 42 | 2,5·10 5 |
| Каталаза | 7 | 3·10 11 |
Фермент каталаза содержится в крови; именно благодаря ей «вскипает» от выделения кислорода аптечная «перекись водорода», когда ее используют для дезинфекции порезанного пальца. Реакцию разложения концентрированного раствора Н2О2 под действием каталазы использует не только человек; именно эта реакция помогает жуку-бомбардиру бороться с врагами, выпуская в них горячую струю (см. ВЗРЫВЧАТЫЕ ВЕЩЕСТВА). Другой фермент – пероксидаза действует иначе: он не разлагает Н2О2, но в его присутствии происходит окисление других веществ пероксидом водорода.
Ферменты, влияющие на реакции пероксида водорода, играют большую роль в жизнедеятельности клетки. Энергию организму поставляют реакции окисления с участием поступающего из легких кислорода. В этих реакциях промежуточно образуется Н2О2, который вреден для клетки, так как вызывает необратимое повреждение различных биомолекул. Каталаза и пероксидаза совместно превращают Н2О2 в воду и кислород.
Реакция разложения Н2О2 часто протекает по радикально-цепному механизму (см. ЦЕПНЫЕ РЕАКЦИИ), при этом роль катализатора заключается в инициировании свободных радикалов. Так, в смеси водных растворов Н2О2 и Fe 2+ (так называемый реактив Фентона) идет реакция переноса электрона с иона Fe 2+ на молекулу H2O2 с образованием иона Fe 3+ и очень неустойчивого анион-радикала [H2O2] . –, который сразу же распадается на анион ОН – и свободный гидроксильный радикал ОН . (см. СВОБОДНЫЕ РАДИКАЛЫ). Радикал ОН . очень активен. Если в системе есть органические соединения, то возможны их разнообразные реакции с гидроксильными радикалами. Так, ароматические соединения и оксикислоты окисляются (бензол, например, превращается в фенол), непредельные соединения могут присоединить гидроксильные группы по двойной связи: СН2=СН–СН2ОН + 2ОН . ® НОСН2–СН(ОН)–СН2–ОН, а могут вступить в реакцию полимеризации. В отсутствие же подходящих реагентов ОН . реагирует с Н2О2 с образованием менее активного радикала НО2 . , который способен восстанавливать ионы Fe 2+ , что замыкает каталитический цикл:
H2O2 + Fe 2+ ® Fe 3+ + OH . + OH –
ОН . + Н2О2 ® H2O + HO2 .
HO2 . + Fe 3+ ® Fe 2+ + O2 + H +
При определенных условиях возможно цепное разложение Н2О2, упрощенный механизм которого можно представить схемой
ОН . + Н2О2 ® H2O + HO2 . 2 . + H2O2 ® H2O + O2 + OH . и т.д.
Реакции разложения Н2О2 идут в присутствии различных металлов переменной валентности. Связанные в комплексные соединения, они часто значительно усиливают свою активность. Например, ионы меди менее активны, чем ионы железа, но связанные в аммиачные комплексы [Cu(NH3)4] 2+ , они вызывают быстрое разложение Н2О2. Аналогичное действие оказывают ионы Mn 2+ связанные в комплексы с некоторыми органическими соединениями. В присутствии этих ионов удалось измерить длину цепи реакции. Для этого сначала измерили скорость реакции по скорости выделения из раствора кислорода. Затем в раствор ввели в очень малой концентрации (около 10 –5 моль/л) ингибитор – вещество, эффективно реагирующее со свободными радикалами и обрывающее таким образом цепь. Выделение кислорода сразу же прекратилось, но примерно через 10 минут, когда весь ингибитор израсходовался, снова возобновилось с прежней скоростью. Зная скорость реакции и скорость обрыва цепей, нетрудно рассчитать длину цепи, которая оказалась равной 10 3 звеньев. Большая длина цепи обусловливает высокую эффективность разложения Н2О2 в присутствии наиболее эффективных катализаторов, которые с высокой скоростью генерируют свободные радикалы. При указанной длине цепи скорость разложения Н2О2 фактически увеличивается в тысячу раз.
Иногда заметное разложение Н2О2 вызывают даже следы примесей, которые почти не обнаруживаются аналитически. Так, одним из самых эффективных катализаторов оказался золь металлического осмия: сильное каталитическое действие его наблюдалось даже при разведении 1:10 9 , т.е. 1 г Os на 1000 т воды. Активными катализаторами являются коллоидные растворы палладия, платины, иридия, золота, серебра, а также твердые оксиды некоторых металлов – MnO2, Co2O3, PbO2 и др., которые сами при этом не изменяются. Разложение может идти очень бурно. Так, если маленькую щепотку MnO2 бросить в пробирку с 30%-ным раствором Н2О2, из пробирки вырывается столб пара с брызгами жидкости. С более концентрированными растворами происходит взрыв. Более спокойно протекает разложение на поверхности платины. При этом на скорость реакции сильное влияние оказывает состояние поверхности. Немецкий химик Вальтер Шпринг провел в конце 19 в. такой опыт. В тщательно очищенной и отполированной платиновой чашке реакция разложения 38%-ного раствора Н2О2 не шла даже при нагревании до 60° С. Если же сделать иглой на дне чашки еле заметную царапину, то уже холодный (при 12° С) раствор начинает выделять на месте царапины пузырьки кислорода, а при нагревании разложение вдоль этого места заметно усиливается. Если же в такой раствор ввести губчатую платину, обладающую очень большой поверхностью, то возможно взрывное разложение.
Быстрое разложение Н2О2 можно использовать для эффектного лекционного опыта, если до внесения катализатора добавить к раствору поверхностно-активное вещество (мыло, шампунь). Выделяющийся кислород создает обильную белую пену, которую назвали «зубной пастой для слона».
Некоторые катализаторы инициируют нецепное разложение Н2О2, например:
Нецепная реакция идет и в случае окисления ионов Fe 2+ в кислых растворах: 2FeSO4 + H2O2 + H2SO4 ® Fe2(SO4)3 + 2H2O.
Поскольку в водных растворах почти всегда есть следы различных катализаторов (катализировать разложение могут и ионы металлов, содержащихся в стекле), к растворам Н2О2, даже разбавленным, при их длительном хранении добавляют ингибиторы и стабилизаторы, связывающие ионы металлов. При этом растворы слегка подкисляют, так как при действии чистой воды на стекло получается слабощелочной раствор, что способствует разложению Н2О2.
Все эти особенности разложения Н2О2 позволяют разрешить противоречие. Для получения чистого Н2О2 необходимо проводить перегонку при пониженном давлении, поскольку вещество разлагается при нагревании выше 70° С и даже, хотя очень медленно, при комнатной температуре (как сказано в Химической энциклопедии, со скоростью 0,5% в год). В таком случае, как же получена фигурирующая в той же энциклопедии температура кипения при атмосферном давлении, равная 150,2° С? Обычно в таких случаях используют физико-химическую закономерность: логарифм давления пара жидкости линейно зависит от обратной температуры (по шкале Кельвина), поэтому если точно измерить давление пара Н2О2 при нескольких (невысоких) температурах, то легко можно рассчитать, при какой температуре это давление достигнет 760 мм рт.ст. А это и есть температура кипения при обычных условиях.
Теоретически радикалы ОН . могут образоваться и в отсутствие инициаторов, в результате разрыва более слабой связи О–О, но для этого нужна довольно высокая температура. Несмотря на относительно небольшую энергию разрыва этой связи в молекуле Н2О2 (она равна 214 кДж/моль, что в 2,3 раза меньше, чем для связи Н–ОН в молекуле воды), связь О–О все же достаточно прочная, чтобы пероксид водорода был абсолютно устойчив при комнатной температуре. И даже при температуре кипения (150° С) он должен разлагаться очень медленно. Расчет показывает, что при этой температуре разложение на 0,5% должно происходить тоже достаточно медленно, даже если длина цепи равна 1000 звеньев. Несоответствие расчетов и опытных данных объясняется каталитическим разложением, вызванным и мельчайшими примесями в жидкости и стенками реакционного сосуда. Поэтому измеренная многими авторами энергия активации разложения Н2О2 всегда значительно меньше, чем 214 кДж/моль даже «в отсутствие катализатора». На самом деле катализатор разложения всегда есть – и в виде ничтожных примесей в растворе, и в виде стенок сосуда, именно поэтому нагревание безводного Н2О2 до кипения при атмосферном давлении неоднократно вызывало взрывы.
В некоторых условиях разложение Н2О2 происходит очень необычно, например, если нагреть подкисленный серной кислотой раствор Н2О2 в присутствии иодата калия KIO3, то при определенных концентрациях реагентов наблюдается колебательная реакция, при этом выделение кислорода периодически прекращается, а потом возобновляется с периодом от 40 до 800 секунд.
Видео:Разложение пероксида водорода под действием дихромата калияСкачать

Химические свойства Н2О2.
Пероксид водорода – кислота, но очень слабая. Константа диссоциации H2O2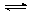
Растворы Н2О2, особенно концентрированные, обладают сильным окислительным действием. Так, при действии 65%-ного раствора Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие органические соединения, например, индиго. Необычно идет окисление формальдегида: Н2О2 восстанавливается не до воды (как обычно), а до свободного водорода: 2НСНО + Н2О2 ® 2НСООН + Н2. Если взять 30%-ный раствор Н2О2 и 40%-ный раствор НСНО, то после небольшого подогрева начинается бурная реакция, жидкость вскипает и пенится. Окислительное действие разбавленных растворов Н2О2 больше всего проявляется в кислой среде, например, H2O2 + H2C2O4 ® 2H2O + 2CO2, но возможно окисление и в щелочной среде:
Окисление черного сульфида свинца до белого сульфата PbS + 4H2O2 ® PbSO4 + 4H2O можно использовать для восстановления потемневших свинцовых белил на старых картинах. Под действием света идет окисление и соляной кислоты:
H2O2 + 2HCl ® 2H2O + Cl2. Добавление Н2О2 к кислотам сильно увеличивает их действие на металлы. Так, в смеси H2O2 и разбавленной H2SO4 растворяются медь, серебро и ртуть; иод в кислой среде окисляется до иодной кислоты HIO3, сернистый газ – до серной кислоты и т.д.
Необычно происходит окисление калий-натриевой соли винной кислоты (сегнетовой соли) в присутствии хлорида кобальта в качестве катализатора. В ходе реакции KOOC(CHOH)2COONa + 5H2O2 ® KHCO3 + NaHCO3 + 6H2O + 2CO2 розовый CoCl2 изменяет цвет на зеленый из-за образования комплексного соединения с тартратом – анионом винной кислоты. По мере протекания реакции и окисления тартрата комплекс разрушается и катализатор снова розовеет. Если вместо хлорида кобальта использовать в качестве катализатора медный купорос, то промежуточное соединение, в зависимости от соотношения исходных реагентов, будет окрашено в оранжевый или зеленый цвет. После окончания реакции восстанавливается синий цвет медного купороса.
Совершенно иначе реагирует пероксид водорода в присутствии сильных окислителей, а также веществ, легко отдающих кислород. В таких случаях Н2О2 может выступать и как восстановитель с одновременным выделением кислорода (так называемый восстановительный распад Н2О2), например:
Последняя реакция интересна тем, что в ней образуются возбужденные молекулы кислорода, которые испускают оранжевую флуоресценцию (см. ХЛОР АКТИВНЫЙ). Аналогично из растворов солей золота выделяется металлическое золото, из оксида ртути получается металлическая ртуть и т.д. Такое необычное свойство Н2О2 позволяет, например, провести окисление гексацианоферрата(II) калия, а затем, изменив условия, восстановить продукт реакции в исходное соединение с помощью того же реактива. Первая реакция идет в кислой среде, вторая – в щелочной:
(«Двойственный характер» Н2О2 позволил одному преподавателю химии сравнить пероксид водорода с героем повести известного английского писателя Стивенсона Странная история доктора Джекила и мистера Хайда, под влиянием придуманного им состава он мог резко изменять свой характер, превращаясь из добропорядочного джентльмена в кровожадного маньяка.)
Видео:Разложение ПЕРЕКИСИ ВОДОРОДАСкачать

Получение Н2О2.
Молекулы Н2О2 всегда получаются в небольших количествах при горении и окислении различных соединений. При горении Н2О2 образуется либо при отрыве атомов водорода от исходных соединений промежуточными гидропероксидными радикалами, например: HO2 . + CH4 ® H2O2 + CH3 . , либо в результате рекомбинации активных свободных радикалов: 2ОН . ® Н2О2, Н . + НО2 . ® Н2О2. Например, если кислородно-водородное пламя направить на кусок льда, то растаявшая вода будет содержать в заметных количествах Н2О2, образовавшийся в результате рекомбинации свободных радикалов (в пламени молекулы Н2О2 немедленно распадаются). Аналогичный результат получается и при горении других газов. Образование Н2О2 может происходить и при невысокой температуре в результате различных окислительно-восстановительных процессов.
В промышленности пероксид водорода уже давно не получают способом Тенара – из пероксида бария, а используют более современные методы. Один из них – электролиз растворов серной кислоты. При этом на аноде сульфат-ионы окисляются до надсульфат-ионов: 2SO4 2– – 2e ® S2O8 2– . Надсерная кислота затем гидролизуется:
На катоде, как обычно, идет выделение водорода, так что суммарная реакция описывается уравнением 2H2O ® H2O2 + H2. Но основной современный способ (свыше 80% мирового производства) – окисление некоторых органических соединений, например, этилантрагидрохинона, кислородом воздуха в органическом растворителе, при этом из антрагидрохинона образуются Н2О2 и соответствующий антрахинон, который потом снова восстанавливают водородом на катализаторе в антрагидрохинон. Пероксид водорода извлекают из смеси водой и концентрируют перегонкой. Аналогичная реакция протекает и при использовании изопропилового спирта (она идет с промежуточным образованием гидропероксида): (СН3)2СНОН + О2 ® (СН3)2С(ООН)ОН ® (СН3)2СО + Н2О2. При необходимости образовавшийся ацетон также можно восстановить до изопропилового спирта.
Видео:Каталитическое разложение пероксида водорода. Химический опытСкачать

Применение Н2О2.
Пероксид водорода находит широкое применение, а его мировое производство исчисляется сотнями тысяч тонн в год. Его используют для получения неорганических пероксидов, как окислитель ракетных топлив, в органических синтезах, для отбеливания масел, жиров, тканей, бумаги, для очистки полупроводниковых материалов, для извлечения из руд ценных металлов (например, урана путем перевода его нерастворимой формы в растворимую), для обезвреживания сточных вод. В медицине растворы Н2О2 применяют для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. В пеналах для хранения контактных линз в крышку иногда помещают очень небольшое количество платинового катализатора. Линзы для их дезинфекции заливают в пенале 3%-ным раствором Н2О2, но так как этот раствор вреден для глаз, пенал через некоторое время переворачивают. При этом катализатор в крышке быстро разлагает Н2О2 на чистую воду и кислород.
Когда-то модно было обесцвечивать волосы «перекисью», сейчас для окраски волос существуют более безопасные составы.
В присутствии некоторых солей пероксид водорода образует как бы твердый «концентрат», который удобнее перевозить и использовать. Так, если к сильно охлажденному насыщенному раствору борнокислого натрия (буры) добавить Н2О2 в присутствии, постепенно образуются большие прозрачные кристаллы пероксобората натрия Na2[(BO2)2(OH)4]. Это вещество широко используется для отбеливания тканей и как компонент моющих средств. Молекулы Н2О2, как и молекулы воды, способны внедряться в кристаллическую структуру солей, образуя подобие кристаллогидратов – пероксогидраты, например, К2СО3·3Н2О2, Na2CO3·1,5H2O; последнее соединение широко известное под названием «персоль». Так называемый «гидроперит» CO(NH2)2·H2O2 представляет собой клатрат – соединение включения молекул Н2О2 в пустоты кристаллической решетки мочевины.
В аналитической химии с помощью пероксида водорода можно определять некоторые металлы. Например, если к раствору соли титана(IV) – сульфата титанила добавить пероксид водорода, раствор приобретает ярко-оранжевый цвет вследствие образования надтитановой кислоты:
TiOSO4 + H2SO4 + H2O2 ® H2[TiO2(SO4)2] + H2O. Бесцветный молибдат-ион MoO4 2– окисляется Н2О2 в интенсивно окрашенный в оранжевый цвет пероксидный анион. Подкисленный раствор дихромата калия в присутствии Н2О2 образует надхромовую кислоту: K2Cr2O7 + H2SO4 + 5H2O2 ® H2Cr2O12 + K2SO4 + 5H2O, которая довольно быстро разлагается: H2Cr2O12 + 3H2SO4 ® Cr2(SO4)3 + 4H2O + 4O2. Если сложить эти два уравнения, получится реакция восстановления пероксидом водорода дихромата калия:
Надхромовую кислоту можно извлечь из водного раствора эфиром (в растворе эфира она значительно более устойчива, чем в воде). Эфирный слой при этом окрашивается в интенсивный синий цвет.
💥 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Разложение перекиси водорода в присутствии катализатораСкачать

Разложение пероксида водорода под действием каталазыСкачать

Каталитическое разложение пероксида водорода (37)Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Эксперименты с ПЕРЕКИСЬЮСкачать

Каталитическое разложение перекиси водорода иодид-иономСкачать

Бурное разложение перекиси водородаСкачать

Каталитическое разложение пероксида водородаСкачать

Каталитическое разложение пероксида водородаСкачать

ПЕРОКСИД ВОДОРОДА | Химические свойства перекиси водорода | ПЕРЕКИСЬ | Химические реакции | ХимияСкачать

Каталитическое разложение перекиси водорода #химия #химическиеопытыСкачать





