Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5∙10 -4 . Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50% N2O.
| Дано: | Решение | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Т, К | |||
| k, моль -1 ∙дм 3 ∙с -1 | 5,41·10 -3 | 0,11 | 0,82 |
Найдите графическим и аналитическим методами энергию активации этой реакции.
11. Некоторая реакция при t=25ºC завершается за 2 часа. через какое время закончится эта реакция при t=75ºC, если её температурный коэффициент равен 2?
Вариант 3.
10. Реакция взаимодействия триэтиламина с метилиодидом в растворе четырёххлористого углерода
является реакцией второго порядка. При Т=293 К константа скорости реакции равна 2,48·10 -2 дм 3 /(моль·мин). Начальные концентрации обоих реагентов равны 0,224моль/дм 3 . Определить концентрацию триэтиламина через 5 часов после начала реакции.
11. Реакция разложения SO2Cl2:
является реакцией первого порядка. При 552 К константа скорости реакции равна 0,609·10 -4 мин -1 ; а при 593 К – 13,20·10 -4 мин -1 . Рассчитайте период полупревращения этой реакции при 688 К.
Вариант 4.
10. Реакция взаимодействия триэтиламина с метилиодидом в растворе четырёххлористого углерода
является реакцией второго порядка. При Т=293 К константа скорости реакции равна 2,48·10 -2 дм 3 /(моль·мин). Начальные концентрации обоих реагентов равны 0,224моль/дм 3 . Определить время, в течение которого концентрация (C2H5)3N уменьшится в 1,5 раза.
11. Для реакции первого порядка:
протекающей при температуре 1085 К, энергия активации равна 256,75 кДж/моль, предэкспоненциальный множитель константы скорости реакции равен 1,33·10 9 с -1 . Определите время, в течение которого концентрация N2O изменится от 0,21 моль/дм 3 до 0,07 моль/дм 3 .
Вариант 5.
10. Для некоторой реакции первого порядка период полупревращения составляет 2 года. Сколько потребуется времени, чтобы концентрация исходного вещества уменьшилась в 10 раз?
11. Для реакции, протекающей по уравнению:
при 288 К константа скорости равна 0,31·10 -3 дм 3 /(моль·мин). Энергия активации равна 97,06 кДж/моль. Чему будет равна константа скорости этой реакции при температуре 313 К?
Вариант 6.
10. Как изменятся скорости прямой и обратной реакции
при увеличении давления в два раза и постоянной температуре?
11. При одинаковой концентрации реагирующих веществ скорость некоторой реакции, протекающей при 35ºC, в два раза выше, чем при 25ºC. Вычислить энергию активации данной реакции.
Вариант 7.
10. Во сколько раз увеличится скорость прямой реакции
протекающей в закрытом сосуде, если увеличить давление в пять раз без изменения температуры?
11. Для реакции первого порядка А → С период полупревращения при 450 К равен 40 мин. Предэкспоненциальный множитель константы скорости реакции равен 5,4·10 11 с -1 . Определить, чему равна величина энергии активации данной реакции.
Вариант 8.
10. В закрытом сосуде находится смесь газов, состоящая из 1 моль азота и 3 моль водорода, которая реагирует по уравнению
Во сколько раз уменьшится скорость прямой реакции после того, как прореагирует 0,65 моль азота?
11. Энергия активации реакции второго порядка, протекающей при температуре 627 К,
равна 111,2 кДж/моль. Предэкспоненциальный множитель константы скорости реакции равен 3,36·10 9 дм 3 /(моль·с). Начальная концентрация NO2 равна 0,09 моль/дм 3 . Определите период полупревращения для этой реакции.
Вариант 9.
10. разложение закиси азота на поверхности золота при высоких температурах протекает по уравнению
Константа скорости данной реакции 0,0005 при 900ºС. начальная концентрация закиси азота 3,2 моль/л. определить скорость реакции при указанной температуре в начальный момент и когда произойдёт разложение 78% закиси азота.
11. Константа скорости омыления уксусноэтилового эфира гидроксидом натрия при 282,6 К равна 2,37 дм 3 /(моль·мин), а при 287,6 К – 3,20 дм 3 /(моль·мин). При какой температуре константа скорости будет равна 4,00 дм 3 /(моль·мин)?
Вариант 10.
10. Реакция между веществами А и В протекает по уравнению
Концентрация вещества А равна 1,5 моль/л, а В – 3 моль/л. Константа скорости реакции 0,4. Вычислить скорость химической реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 75% А.
11. Вычислить по правилу Вант-Гоффа, при какой температуре реакция закончится в течение 20 мин, если при 20ºC на это требуется 3 ч. Температурный коэффициент скорости принять равным 2.
Видео:РАЗЛОЖЕНИЕ Тиомочевины. Разложение CS(NH2)2.Скачать

Читать учебное пособие по всему другому: «Методические указания и контрольные задания для учащихся заочников по специальности 2 48 01 35 «Переработка нефти и газа» Новополоцк» Страница 34
321. Разложение оксида азота (I) на поверхности золота при высоких температурах протекает по уравнению N2О N2 + О. Константа скорости данной реакции при 900 ºС 5х10-4. Начальная концентрация N2О 3,2 моль/л. Определите скорость реакции при указанной температуре в начальный момент и когда произойдет разложение 78 % начального количества оксида.
322. Константа распада Rа А равна 3,79х10-3 с-1. Определите период половины превращения 1/2 и время, за которое Rа А распадается на 90 %.
323. В сосуде имеется 0,025 г радона. Период половины превращения 1/2 радона 3,82 дня. Какое количество радона (в масс.долях, %) останется в сосуде через 14 дней?
324. Период половины превращения тория С равен 60,5 мин. Через какое время активность тория С будет составлять 20 % от первоначальной?
325. Реакция НСОН + Н2О2 = НСООН + Н2О является двумолекулярной. При смешении равных объемов 1 М растворов Н2О2 и муравьиного альдегида через 2 ч при 60 ºС концентрация муравьиной кислоты становится 0,215 моль/л. Вычислите константу скорости реакции и определите, за какое время (1/2) прореагирует половины исходных веществ.
326. Константа скорости двумолекулярной реакции омыления этилового эфира уксусной кислоты едким натром при 10 ºС равна 2,38 (концентрация выражена в моль/л, время – в мин). Какое время потребуется на омыление 80 % эфира, если смешать при 10 ºС 1 л 0,04 н. Раствора уксусноэтилового эфира с 1 л 0,04 н. NаОН? Как изменится время реакции, если исходные растворы будут разбавлены в 10 раз?
327. Термическое разложение окиси этилена является реакцией первого порядка. При 378,5 ºС период половины превращения окиси этилена равен 363 мин. Определите константу скорости реакции при 450 ºС. Энергия активации данной реакции 217 кДж/моль.
328. Константа скорости реакции разложения органической кислоты в водном растворе при 20 ºС 4,75х10-4, а при 40 ºС – 5,76х10-3 (время выражено в минутах). Определите период половины превращения кислоты при 30 ºС, если разложение ее протекает по закону реакции первого порядка.
329. Соль диазония в водном растворе разлагается по уравнению СН3С6Н4N2Сl + Н2О = СН3С6С4ОН + N2 + НСl Процесс разложения при большом избытке воды является реакцией первого порядка. Константы скорости реакции при 24,7 и 30 ºС соответственно равны 9х10-3 и 1,3х10-2 мин-1. Вычислить константу скорости этой реакции при 35 ºС и время, в течение которого при этой температуре распадается 99,9 % соли диазония.
330. При 25 и 40 ºС константы скорости реакции разложения гипохлорита натрия в растворе равны соотвественно 0,0093 и 0,0342. Вычислите по уравнению Аррениуса, использовав приближенное правило Вант-Гоффа, константу скорости этой реакции при 50 ºС.
331. Золь йодида серебра получен при постепенном добавлении к 20 см3 0,01 н. Раствора КI 15 см3 0,2 %-ного раствора нитрата серебра. Напишите формулу мицеллы образовавшегося золя и определите направление движения частиц его в электрическом поле. Плотность раствора нитрата серебра принять равной единице.
332. Какой объем 0,005 н. AgNО3 надо прибавить к 20 см3 0,015 н. КI, чтобы получить положительный золь йодида серебра? Напишите формулу мицеллы.
333. Золь гидроксида железа (III) получен при добавлении к 85 см3 кипящей дистиллированной воды 15 см3 2%-ного раствора хлорида железа (III). При этом соль частично подвергается гидролизу: FеСl3 + 3Н2О Fе(ОН)3 + 3НСl Напишите возможные
Видео:Разложение нитратовСкачать

Разложение n2o на поверхности золота при высоких температурах протекает по уравнению
Практическая работа 2
Тема: Решение задач по определению кинетики сложных химических реакций различного порядка
Цель: Научиться решать задачи по определению кинетики сложных химических реакций различного порядка
Теоретические основы
Химическая кинетика изучает скорость и механизм протекания химических реакций, а также зависимость скорости от различных факторов. О скорости химических реакций судят по изменению концентраций реагирующих веществ в единицу времени.
Скорость для мономолекулярной реакции (реакция первого порядка)
откуда после интегрирования получим
Скорость для бимолекулярной реакции (реакция второго порядка)
откуда после интегрирования получим
где a — начальная концентрация первого вещества; в – начальная концентрация второго вещества; х – количество вещества, вступившее в реакцию к моменту времени от начала опыта.
Если начальные концентрации веществ одинаковы, т.е. С1=С2, то
откуда после интегрирования получим
Иногда о скорости химической реакции судят по величине периода половины превращения t1/2, который выражается временем, в течение которого претерпевает превращение половина взятого вещества. Для t1/2 х = a/2, тогда формулу (2) можно записать так:
На скорость химических реакций существенное влияние оказывает даже незначительное изменение температуры. Соотношение
называется температурным коэффициентом скорости реакции, где k – константы скорости при температурах t + 10 и t 0 С.
На основании (9) можно записать, что
Более точная зависимость константы скорости от температуры выражается уравнением Аррениуса
Реакции бывают первого, второго , третьего и дробного порядков. Порядок определяется опытным путем. Константа скорости для реакции первого порядка должна оставаться постоянной в течение любого промежутка времени.
Варианты заданий:
Вариант
Номера задач
Порядок выполнения работы
Решить следующие задачи:
Задача 1. Подсчитать константу скорости омыления уксусноэтилового эфира:
если: а) эта реакция второго порядка, б) исходные концентрации эфира и щелочи по 16 моль/дм 3 , в) через 5 мин в результате реакции концентрация каждого из них понизилась до 10,24 моль/дм 3 .
Задача 2. Перекись водорода, начальная концентрация которой равна 25,4 моль/дм 3 , разлагается в присутствии катализатора. Через 15 минут в растворе осталось перекиси водорода 9,83 моль/дм3, а через 30 минут – 3,81моль/дм 3 . Определить порядок реакции.
3адача 3. Константа мономолекулярной реакции равна 0,0635 мин -1 . Подсчитать полупериод «жизни» продуктов реакции.
Задача 4. Как изменятся скорости прямой и обратной реакций 2NO + O2↔2NO2 при увеличении давления в три раза при постоянной температуре?
Задача 5. Во сколько раз увеличится скорость растворения железа в 5%-ной соляной кислоте при повышении температуры с 18 до 32 0 С, если температурный коэффициент скорости растворения равен 2,8?
Задача 6. Константа скорости омыления этилового эфира уксусной кислоты едким натром при 10 0 С 2,38. Определить время (мин), необходимое для омыления 90% уксусноэтилового эфира, если смешать при 10 0 С 1л 0,05н. раствора эфира с 1л 0,05н. NаОН.
Задача 7. Во сколько раз увеличится скорость прямой реакции 2SO2 + O2 ↔2SO3, протекающей в закрытом сосуде, если увеличить давление в 5 раз без изменения температуры?
Задача 8. Константа скорости омыления этилацетата едким натром при 9,4 0 С равна 2,37, а при 14,4 0 С – 3,204. Рассчитать температурный коэффициент скорости реакции в указанном интервале температур и энергию активации.
Задача 9. Перекись водорода, начальная концентрация которой равна 48,6 моль/дм 3 , разлагается в присутствии катализатора. Через 20 минут в растворе осталось перекиси водорода 25,5 моль/дм3, а через 30 минут – 10,5 моль/дм 3 . Определить порядок реакции.
Задача 10. Разложение оксида азота (Ι) на поверхности золота при высоких температурах протекает по уравнению N2O ↔ N2 + O. Константа скорости реакции при 900 0 С 5·10 -4 . Начальная концентрация N2O 3,2 моль/л. Определить скорость реакции при указанной температуре в начальный момент времени и когда произойдет разложение 78% начального количества оксида.
Задача 11. Константа скорости омыления этилового эфира уксусной кислоты едким натром при 10 0 С 4,56. Определить время (мин), необходимое для омыления 90% уксусноэтилового эфира, если смешать при 10 0 С 1л 0,05н. раствора эфира с 1л 0,1н. NаОН.
Задача 12. Константа мономолекулярной реакции равна 0,0826 мин -1 . Подсчитать полупериод «жизни» продуктов реакции.
Задача 13. Как изменятся скорости прямой и обратной реакций 2NO + O2↔2NO2 при увеличении давления в шесть раз при постоянной температуре?
Задача 14. Реакция разложения перекиси водорода в водном растворе протекает как реакция первого порядка. Период половины превращения Н2О2 при заданных условиях равен 15,86 мин. Определить, какое время потребуется для разложения (при тех же условиях) 99% Н2О2.
Задача 15. Кинетическое уравнение имеет вид W = kCC во сколько раз увеличится скорость реакции, если увеличить концентрацию реагента А в четыре раза или если увеличить концентрацию реагента В в четыре раза?
Контрольные вопросы:
1. Дайте определение скорости химической реакции.
2. Как определяют константу скорости для реакций первого порядка?
3. Как определяют константу скорости для реакций второго порядка?
4. Как определяют период половины превращения?
5. Какое влияние оказывает на скорость химических реакций температура?
Видео:Химическая кинетика и равновесиеСкачать

Примеры решения задач. Исследовалась кинетика процесса разложения N2O на золотом катализаторе при 900 °С
Пример1.
Исследовалась кинетика процесса разложения N2O на золотом катализаторе при 900 °С. Получены следующие данные:
р 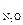 ·10 –5 , Н/м 2 ·10 –5 , Н/м 2 | 0,267 | 0,181 | 0,093 | 0,059 |
| T,с |
Известно, что N2O слабо сорбируется на Au, а продукты разложения не сорбируются совсем. Нужно рассчитать константу скорости данного процесса.
Скорость процесса зависит от степени заполнения катализатора сорбентом:
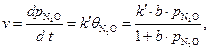
Для слабой адсорбции исходного вещества (b ’ ·b.
То есть данная каталитическая реакция является реакцией первого порядка, для которой константа скорости равна:

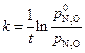
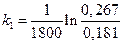
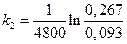
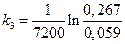
Пример 2.
Исследовалась кинетика процесса разложения SbH3 на катализаторе из Sb при 25 °С. Давление SbH3 в реакторе менялось во времени следующим образом:
р 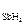 10 –2 ,Н/м 2 · 10 –2 ,Н/м 2 · | 1.013 | 0,740 | 0,516 | 0,331 | 0,191 | 0,074 |
| t,мин |
Считая, что SbH3 сорбируется на катализаторе умеренно (b =1,824·10 -5 м 2 /Н), а продукты разложения не сорбируются совсем, рассчитать константу скорости данного процесса.
Скорость процесса зависит от степени заполнения катализатора сорбентом:
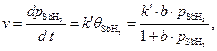
Для средней адсорбции исходного вещества константа скорости процесса может быть рассчитана по уравнению:
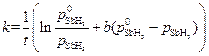
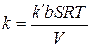
Подсчитаем значения констант в различные моменты времени протекания реакции.
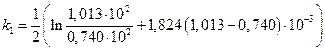

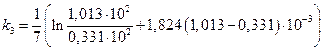
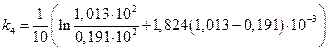
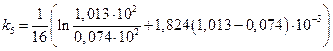
📸 Видео
Реакции металлов с кислородом и водой. 8 класс.Скачать

Способы повышения извлечения золота при автоклавной переработке концентратов двойной упорностиСкачать

YM 2021 секция ВТ 7Скачать

А.В.Григорьева, М.В.Берекчиян. ЗНТШ21: Задачи по химии.Скачать

Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать

Вебинар по химии Химическая кинетика и равновесие А21, А22 15 00 43Скачать

Урок 201. Задачи на поверхностное натяжение - 2Скачать

Разложение sin(z)/z^2 в окрестности z=0 и z=∞ в ряд Лорана. Разложение в бесконечно удаленной точке.Скачать

Проект "Cупер восстановитель золота" Часть перваяСкачать

Кинетика || Лекция 4 || Реакции второго порядка, общий интеграл кинетического уравненияСкачать

Часть 2. Найти все лорановские разложения функции по степеням z. Получить все возможные разложения.Скачать

ЭлектролизСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать





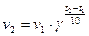 , (96)
, (96)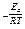 , (97)
, (97)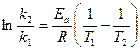 , (98)
, (98)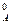 ) 2 ·с
) 2 ·с 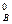 = 0,75·(3,2) 2 ·1,6 = 12,29.
= 0,75·(3,2) 2 ·1,6 = 12,29.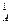 ) 2 ·с
) 2 ·с 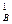 или
или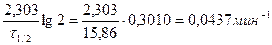 .
.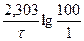 ;
; 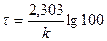 ;
;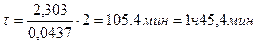
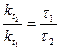 ,
,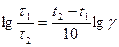 ,
,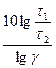 ,
,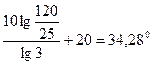 .
.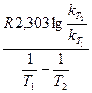 ,
,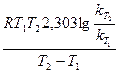 ,
,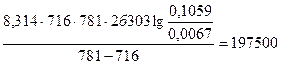 Дж/моль = 197,5 кДж/моль.
Дж/моль = 197,5 кДж/моль.