- Кремниевая кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Силикаты
- Особенности получения и применения кремниевой кислоты
- Кремниевая кислота — что это такое, формула
- Химические и физические свойства
- Особенности получения и применения кремниевой кислоты
- Влияние на организм человека: польза и вред
- Кремниевая кислота — формула, физические и химические свойства
- Общая информация
- Особенности силикатов
- Физические и химические свойства
- Способы получения
- Применение в различных отраслях
- 💥 Видео
Кремниевая кислота
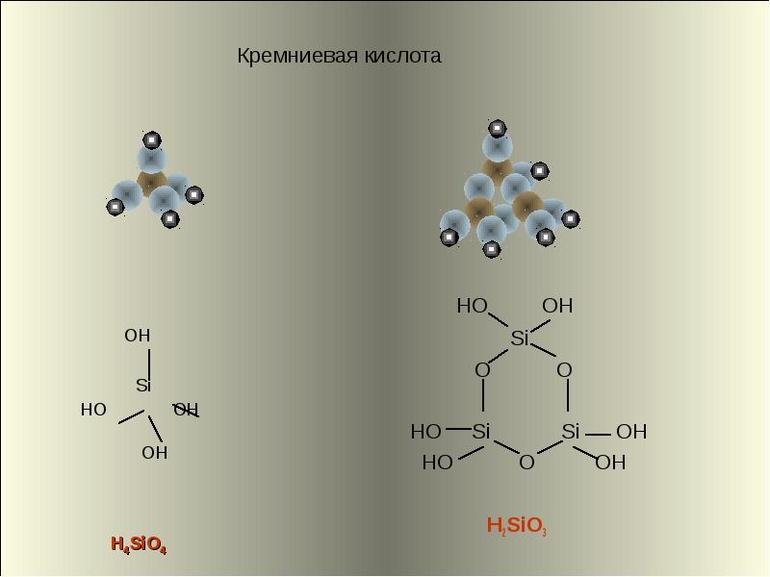
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Видео:Кремниевая кислота и её соли. 9 класс.Скачать

Особенности получения и применения кремниевой кислоты
Видео:10 Разложение кремниевой кислоты РСкачать

Кремниевая кислота — что это такое, формула
Кремниевая кислота (метакремниевая кислота) — является сложным соединением неорганического происхождения, имеет вид аморфного белого вещества. Плотность вещества составляет 3,71 г / с м 3 .
Конечный продукт получения кремниевой кислоты представляет собой студенистую массу, которая содержит воду, или коллоидный раствор (золь). Кислота в процессе нагревания достаточно легко распадается на оксид кремния (IV) и воду, как и угольная. Данный процесс протекает очень быстро.
H 2 S i O 3 S i O 2 + H 2 O
Химическая формула кремниевой кислоты:
При анализе данной формулы можно заключить, что молекула кремниевой кислоты состоит из:
- двух атомов водорода (Ar = 1 а.е.м.);
- одного атома кремния (Ar = 28 а.е.м);
- трех атомов кислорода (Ar = 16 а.е.м.).
Исходя из химической формулы соединения, рассчитывают характеристику молекулярной массы кремниевой кислоты:
- M r ( H 2 S i O 3 ) = 2 × A r ( H ) + A r ( S i ) + 3 × A r ( O ) ;
- M r ( H 2 S i O 3 ) = 2 × 1 + 28 + 3 × 16 = 2 + 28 + 48 = 78 .
Молярная масса кремниевой кислоты составляет 78 г/моль.
Структурная формула кремниевой кислоты демонстрирует характер связей между атомами внутри молекулы соединения:
Кремниевая кислота представляет собой слабую двухосновную кислоту и обладает способностью диссоциировать на ионы в водном растворе ступенчато и обратимо, согласно следующим ионным уравнениям:
Из-за склонности к полимеризации известен целый ряд кремниевых кислот. Состав веществ можно описать общей формулой n S i O 2 • m H 2 O . Все кремниевые кислоты являются очень слабыми. Соединения малорастворимы в воде, образуют коллоидные растворы.
Кремниевая кислота включает в состав тетраэдрические структурные звенья (в каждом таком звене атом кремния расположен в центральной точке тетраэдра, а в вершинах находятся атомы кислорода). При объединении в цепочки структурные звенья формируют поликремниевые кислоты с более высокой степенью устойчивости:
Классификация кремниевых кислот:
- метакремниевая H 2 S i O 3 ;
- ортокремниевая H 4 S i O 4 ;
- дикремниевые H 2 S i 2 O 5 и H 10 S i 2 O 3 ;
- пирокремниевая H 6 S i 2 O 7 ;
- поликремниевые n S i O 2 • m H 2 O .
Примечание
Соответствующие кремниевым кислотам соли носят название силикатов. В качестве примеров можно привести метасиликаты, ортосиликаты и другие соединения.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические и физические свойства
Все поликремниевые кислоты отличаются плохой растворимостью в воде. Образование коллоидного раствора протекает, согласно общей схеме реакции:
( S i O 2 ) x + 2 H 2 O ⇄ H 4 S i O 4 + ( S i O 2 ) x — 1 ( S i O 2 ) x + 2 H 2 O ⇄ H 4 S i O 4 + ( S i O 2 ) x — 1
Ортокремниевая кислота, которая образовалась в результате химической реакции, может вступать в реакции поликонденсации:
2 H 4 S i O 4 → ( H O ) 3 S i O S i ( O H ) 3 + H 2 O 2 H 4 S i O 4 → ( H O ) 3 S i O S i ( O H ) 3 + H 2 O
Конечным результатом являются сложные линейные, разветвленные и смешанные структуры.
Изоэлектрическая точка поликремниевых кислот соответствует интервалу pH 2,0-3,0, в котором скорость реакции поликонденсации характеризуется минимальным значением.
Кремниевые кислоты относятся к слабым:
• для метакремниевой кислоты H 2 S i O 3 константы диссоциации K 1 = 1 , 3 • 10 — 10 , K 2 = 1 , 6 • 10 — 12 ;
• для ортокремниевой H 4 S i O 4 K 1 = 2 • 10 — 10 , K 2 = K 3 = K 4 = 2 • 10 — 12 .
Кремниевые кислоты реагируют с растворами и расплавами щелочей. В результате образуются силикаты, к примеру:
H 2 S i O 3 + 2 K O H → K 2 S i O 3 + 2 H 2 O H 2 S i O 3 + 2 K O H → K 2 S i O 3 + 2 H 2 O
Кремниевые кислоты могут вступать в химические реакции с плавиковой кислотой ( H F ) . Данный процесс сопровождается образованием фторида кремния в газообразном состоянии:
H 2 S i O 3 + 6 H F → H 2 S i F 6 + 3 H 2 O → S i F 4 ↑ + ( 2 H F + 3 H 2 O ) H 2 S i O 3 + 6 H F → H 2 S i F 6 + 3 H 2 O → S i F 4 ↑ + ( 2 H F + 3 H 2 O )
Ортокремниевая кислота при наличии катализаторов на основе щелочи (как правило, NaOH) формирует ортосиликаты-эфиры, которые в общем случае характеризуются видом:
R 1 R 2 R 3 R 4 S i O 4 ,
где R 1 — 4 являются органическими радикалами, обычно, в виде спиртовых остатков.
Известный массовый продукт — тетраэтилортосиликат состава S i ( C 2 H 5 O ) 4 .
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Особенности получения и применения кремниевой кислоты
Kремниевые кислоты получают с помощью взаимодействия сильных кислот с растворимыми силикатами натрия или калия, при этом сильные неорганические кислоты вытесняют кремниевые из растворов их солей:
N a 2 S i O 3 + 2 H C l → H 2 S i O 3 ↓ + 2 N a C l N a 2 S i O 3 + 2 H C l → H 2 S i O 3 ↓ + 2 N a C l
Получить соединения в виде кремниевых кислот можно с помощью другого способа, который представляет собой гидролиз хлорсиланов:
S i H 2 C l 2 + 3 H 2 O → H 2 S i O 3 + 2 H C l + 2 H 2 O S i H 2 C l 2 + 3 H 2 O → H 2 S i O 3 + 2 H C l + 2 H 2 O
Гидрозоли кремниевых кислот используют в качестве наполнителей и связующих веществ в производстве изделий из керамики и разнообразных покрытий. Данные материалы играют роль носителей катализаторов и светочувствительных слоев в фотоматериалах. Их используют, как сырье в производстве следующих видов продукции:
- кварцевое стекло;
- разные адсорбенты;
- поглотители паров воды и газов;
- фильтры очистки воды и масел.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Влияние на организм человека: польза и вред
Кремниевая кислота является неорганическим соединением, которое имеет большое значение в осуществлении метаболических процессов организма:
- участие в усвоении витаминов и минералов;
- нейтрализация тяжелых металлов и токсинов;
- поддержание нормального функционирования сердца;
- влияние на синтез коллагена, то есть белка, являющегося основой для соединительной ткани.
Кремниевая кислота играет важную роль в метаболизме. Организм человека во взрослом возрасте содержит до 1-2 грамм кремния. Самой высокой концентрацией элемента обладают:
По мере старения организма содержание кремния может снижаться на фоне атеросклероза и опухолевых заболеваний. Данный процесс оказывает негативное влияние на состояние всех внутренних органов и систем.
Польза кремниевой кислоты для организма человека заключается в следующем:
- Соединение взаимодействует с более чем 70 минеральными солями и витаминами, улучшает процесс усвоения кальция, увеличивает скорость минерализации костей и зубов, оказывает укрепляющее действие на соединительную ткань суставов, связок и сухожилий.
- Кремневая кислота обеспечивает работоспособность сердечно-сосудистой системы. Соединение укрепляет внутреннюю оболочку ткани, из которой состоят артерии, снижает уровень вредного холестерина в крови, уменьшает вероятность закупорки сосудов и предотвращает атеросклеротические поражения в сосудах.
- Стимулирует ряд процессов, протекающих в пищеварительной системе. Кремнийорганические вещества восстанавливают и поддерживают слизистые оболочки органов желудочно-кишечного тракта, обладают оздоровительным эффектом, позволяет исключить распространенные расстройства желудка и пищеварительной системы.
- Кремниевая кислота способна восстанавливать строение слабых истонченных волос, устранять ломкость и расслаивание ногтевых пластин, поддерживать нормальный уровень влаги в кожных покровах. Соединение стимулирует выработку коллагена, укрепляет и разглаживает кожу, ускоряет регенерацию тканей.
- Кремниевая кислота необходима для выведения из организма алюминия, излишки которого являются одной из причин развития болезни Альцгеймера. Соединение удаляет токсины, соли тяжелых металлов и вредные продукты метаболизма.
- Кремниевая кислота улучшает когнитивные функции и физическую работоспособность. Согласно одной из гипотетических теорий, данный процесс обеспечивает способность соединения уменьшать содержание алюминия в организме.
Кремниевую кислоту содержат многие растительные продукты. Самой высокой концентрацией вещества обладают культурные растения с повышенным содержанием клетчатки:
Рацион питания, в котором присутствуют богатые кремнием продукты, восполняет баланс кремниевой кислоты частично. С пищей человек потребляет примерно 1 мг вещества. Норма потребления вещества составляет 5-10 мг ежедневно.
Кремниевая кислота является безопасной биологической добавкой. В том случае, когда человек рационально употребляет ее в пищу, наблюдается положительный эффект. При длительном приеме вещества в больших дозах развиваются следующие осложнения:
- образование камней в почках;
- развитие ревматоидного артрита;
- возникновение аутоиммунных заболеваний.
Медицинские препараты, содержащие кремний, не рекомендованы к употреблению людям, которые страдают диабетом. Причиной такого ограничения являются риски падения уровня сахара в крови. Кремниевая кислота способна усиливать реакции определенных лекарственных средств, в том числе, диуретиков, БАДов хрома. В связи с этим, перед приемом добавок необходимо проконсультироваться с лечащим специалистом.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Кремниевая кислота — формула, физические и химические свойства
Видео:Получение геля кремниевой кислотыСкачать

Общая информация
Основная формула кремниевой кислоты — H2SiO3 (так как кислота не имеет постоянного состава, её обозначение иногда принимает вид nSiO2 • mH2O, что соответствует поликремниевым видам). Номенклатура кислоты включает в себя и её подвиды. Условное обозначение их химического состава выглядит следующим образом:
- Ортокремниевая — H4SiO4. Наряду с метакремниевой кислотой, чья формула считается основной, ортокремниевая является наиболее распространённым химическим соединением кислот этого вида.
- Дикремниевая — H2Si2O5, H6Si2O7 и H10Si2O9 (показатель растворимости в воде при t = 20 градусов по цельсию составляет 2,9310 в минус 4 степени моль/л).
- Пирокремниевая — H6Si2O7.
Соли кремниевых кислот обозначаются как силикаты. Поликремниевые кислоты состоят из структурных звеньев, соединяющихся в сложные линейные и разветвлённые цепи. Несмотря на различие в формулах и отдельных характеристиках кремниевой кислоты, все виды этих химических соединений имеют тетраэдрическое строение.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Особенности силикатов
В природе широко распространены (в частности, к ним относятся полевые шпаты, асбест, тальк, слюда и различные виды глины). Соли кремниевой кислоты в большинстве своём плохо растворимы в воде (исключения составляют силикаты калия и натрия). Получение солей происходит при сплавлении едких щёлочей или карбонатами натрия и калия с диоксидом кремния. В остатке выходит диоксид углерода с высокой массовой долей вещества или вода. Примерами таких уравнений могут послужить следующие реакции:
- SiO2 + K2CO3 = K2SiO3 + CO2 (образование углекислого газа).
- SiO2 + 2NaOH = Na2SiO3 + H2O.
- SiO2 + Na2CO3 = Na2SiO3 + CO2.
К свойствам солей относится высокая температура плавления: в среднем — от 1000 до 1300 градусов по Цельсию (такая разновидность силикатов, как каолинит, плавится при t = 1800 и выше). Твёрдость этих веществ по шкале Мооса составляет 6−8 баллов, что является высоким показателем.
Несмотря на то что силикаты не реагируют на отдельные соединения и в целом относятся к классу химически пассивных веществ, они способны взаимодействовать со слабыми кислотами и растворимыми солями. Формула гидролиза представляет собой уравнение: Na2SiO3 + H2O = NaHSiO3 + NaOH. Расплавленные силикаты имеют высокие электролитические свойства.
Ещё одной особенностью солей кремниевых соединений является их возможность замещать атомы кремния на атомы алюминия, образуя при этом алюмосиликаты. Они также нерастворимы в воде и обладают абсорбционными, ионообменными, диэлектрическими и термостойкими свойствами.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Физические и химические свойства
Неорганическая кислота образуется при действии сильных кислот на растворимые силикаты. Вещество представляет собой белый аморфный и стекловидный полимер, имеющий цепочечную структуру. Не вступает в реакцию с другими кислотами и не гидратом аммиака. Так как все поликремниевые соединения относятся к малорастворимым веществам, они образуют коллоидные растворы при реакции с водой. Молярная масса вещества равна 78 а. е. м. (H2SiO3 — 2 атома водорода = 1 • 2, 1 атом кремния = 28 и 3 атома кислорода = 16 • 3).
Кислотные свойства выражены очень слабо (у молекулы вещества степень окисления кремния равна +4), вещество не имеет кислого вкуса или запаха, а также не изменяет окраску индикатора. Согласно таблице сильных и слабых кислот, кремниевая занимает последнюю строчку). Константа диссоциации для метакремниевых соединений составляет K1 = 1,3•10 -10 , K2 = 1,6•10 -12 , а для ортокремниевой K1 = 2•10 -10 , K2 = K3 = K4 = 2•10 -12 .
Вследствие своей неустойчивости химическое вещество при нагревании либо длительном хранении разлагается на оксид кремния и воду (реакция термического разложения H2SiO3 = H2O + SiO2). Каждый атом кремния в кристаллах (SiO2) окружён 4 атомами кислорода, которые, будучи связаны друг с другом, образуют кристаллическую трёхмерную решётку, что обусловливает твёрдость вещества. Некоторые другие химические свойства кремниевых кислот можно проиллюстрировать следующими уравнениями:
- H2SiO3 + 4KOH = K2SiO3 + 4H2O (растворение студенистого кислотного остатка и образование средней соли метасиликата калия и воды).
- 2H4SiO4 = (HO)3SiOSi (OH)3 + H2O (эта реакция называется поликонденсацией).
- Пример взаимодействия с плавиковой кислотой и образованием газообразного фторида кремния: H2SiO3 + 6HF = H2SiF6 + 3H2O = SiF4 (образование газа) + 2HF (фтороводород) + 3H2O.
- CaCl2 + Na2SiO3 = 2NaCl + CaSiO3 (химическая реакция двух солей с выпадением осадка).
В присутствии щёлочных катализаторов — к примеру, NaOH — ортокремниевая кислота может образовывать эфиры-ортосиликаты. В большинстве своём они имеют вид R1R2R3R4SiO3, где R1−4 являются органическими радикалами. Примером такого эфира является распространённый тетраэтилортосиликат с формулой Si (C2H5O)4.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Способы получения
Основной способ получения кремниевой кислоты — косвенным путём, воздействуя сильной кислотой на силикат калия или натрия (Na2SiO3 + 2HCl = H2SiO3 + 2NaCl). При этом невозможно получить кислоту в чистом виде — в водном растворе образуется золь, который через малый промежуток времени превращается в гель.
Кремниевые соединения также можно получить посредством гидролиза хлорсиланов (SiH2Cl2 + 3H2O = H2SiO3 +2HCl + 2H2); конечным продуктом гидролитического расщепления является H2SiO3. Наконец, для промышленных масштабов, а также для лабораторных экспериментов и отдельных опытов по химии могут использоваться методы электродиализа и ионного обмена. Большое внимание уделяется и получению силикагеля — другое название вещества, образовывающегося от перенасыщенных растворов кремниевых кислот. Технология производства включает в себя несколько стадий:
- Возникновение золя и его застудневание в однородную массу (гидрогель).
- Созревание (последующее гелеобразование и разжижение вещества).
- Очищение и промывка геля от солей.
- Высушивание и превращение вещества в ксерогель.
Опытным путём доказано, что наиболее чистый силикагель получается при гидролизе соединений кремния (SiCl4), а также ортокремниевых соединений. Химическая формула получения геля выглядит так: Na2SiO3 + H2SO4 = nSiO2 • mH2O + Na2SO4, где nSiO2 • mH2O — гидратированный аморфный кремнезём.
Применение в различных отраслях
Благодаря пористой структуре силикагеля его часто применяют в качестве абсорбента для поглощения вредных газов и смесей. Для общественности известны медицинские высокопористые гели, эффективные при различного рода отравлениях и недомоганиях. Помимо этого, вещество используется и для создания технических фильтрационных систем.
Кремниевые соединения являются важным строительным элементом для кожи, волос и ногтей, поэтому эти вещества широко используются для производства косметики и лекарственных препаратов. Препараты на основе кремния обеспечивают гибкость соединительных тканей внутренних органов (в частности, кишечника и желудка) и улучшают усвоение кальция, что способствует восстановлению костной ткани.
В нефтяной промышленности гели на основе кремнийсодержащих веществ используются для очистки углеводородов от смол, а в ядерной отрасли при помощи силикагеля производится не только очистка сточных вод, но и разделение изотопов радиоактивных веществ.
Любопытно, что вещества на основе кремниевых соединений находят массу применений в повседневной жизни. К примеру, процесс сушки обуви займёт куда меньше времени, если в промокшие ботинки положить пакетик с соответствующим абсорбентом. Силикагель позволит избавиться от неприятных запахов в помещении или в сумке с вещами. Столовое серебро можно спасти от почернения, положив в шкаф с ценными приборам гелевые шарики на основе силикагеля.
Если необходимо продлить срок службы бритвенных лезвий, то для спасения от ржавчины нужно положить к ним несколько гранул с силикагелем. Это же относится и к хранению старых фотографий, а также других вещей, которые со временем могут потускнеть или изменить свой внешний вид под воздействием окружающей среды. Автолюбителям могут уменьшить запотевание ветрового стекла, всего лишь положив на приборную панель цветы или пакетик с силикагелем.
💥 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химия 9 класс (Урок№20 - Кремний и его соединения. Стекло. Цемент.)Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Получение кремниевой кислотыСкачать

кремниевая кислота ( формула )Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Получение кремниевой кислотыСкачать

Кремниевая кислота получениеСкачать

Получение геля кремниевой кислотыСкачать