При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
- Разложение оксидов
- Разложение гидроксидов
- Разложение кислот
- Разложение солей
- Разложение хлоридов
- Разложение нитратов
- Разложение карбонатов и гидрокарбонатов
- Разложение сульфатов
- Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Разложение сульфитов
- Разложение солей аммония
- Разложение перманганата калия
- Разложение хлората и перхлората калия
- Состав хлорида натрия (NaCl), свойства, применение, токсичность
- Структура хлорида натрия
- Унитарная ячейка
- Разложение солей при нагревании
- 📹 Видео
Видео:Электролиз. 10 класс.Скачать

Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Видео:Термическое разложение хлорида аммония NH4ClСкачать

Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Видео:Опыты по химии. Разложение гидрокарбоната натрия при нагреванииСкачать

Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Видео:Получение хлората калия, бертолетовой соли из отбеливателя (химия)Скачать

Разложение солей
Видео:электролиз хлорида натрияСкачать
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Видео:Электролиз NaClСкачать

Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Видео:Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Видео:Натрия хлорид раствор инструкция по применению препарата: Показания, как применять, обзор препаратаСкачать

Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Видео:Натрия хлорид в работеСкачать
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Разложение перманганата калия
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Видео:🔥 Получил МЕТАЛЛ из СОДЫ. Старинный способ ДОБЫЧИ НАТРИЯ.Скачать

Состав хлорида натрия (NaCl), свойства, применение, токсичность
хлорид натрия, также называемая поваренной солью или поваренной солью, представляет собой бинарную неорганическую соль натрия щелочного металла и галогена хлора. Это самый большой компонент пищевой соли, а его минеральная форма известна как галит. Молекулярная формула NaCl, и описывает стехиометрическое соотношение его ионов (Na + Cl — ), а не у дискретной молекулы (Na-Cl)
Хлорид натрия представляет собой кристаллическое белое твердое вещество, которое образуется в результате сочетания натрия, серебристо-белого металла, который бурно реагирует с водой, и элемента хлора, ядовитого, едкого, бледно-зеленого газа..
На верхнем изображении показана часть кристаллов NaCl. Как это возможно, что два элемента столь же опасны, как Na и Cl2, может образовываться пищевая соль? Во-первых, химическое уравнение его образования:
Ответ заключается в природе ссылки в NaCl. Будучи ионным, свойства Na + и Cl — они по диагонали отличаются от их нейтральных атомов.
Натрий является жизненно важным элементом, но в его ионной форме. На + является основным внеклеточным катионом с концентрацией приблизительно 140 мг-экв / л, и вместе с сопровождающими его анионами Cl — и HCO3 — (бикарбонат), в основном ответственны за величину осмолярности и внеклеточного объема.
Кроме того, Na + отвечает за генерацию и проведение нервных импульсов в нейрональных аксонах, а также за инициацию сокращения мышц.
NaCl использовался с древних времен для придания аромата пище и сохранения мяса благодаря его способности уничтожать бактерии и предотвращать порчу.
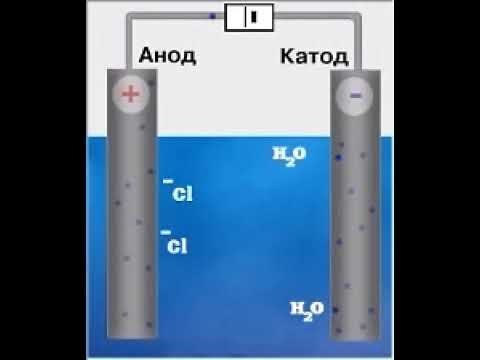
Это также необходимо для производства гидроксида натрия (NaOH) и молекулярного хлора (Cl2) путем взаимодействия NaCl с водой при гидролизе:
В катоде (-) Н накапливается2 (г) и NaOH. Между тем Cl накапливается на аноде (+)2 (G). Гидроксид натрия используется при производстве мыла и хлора при производстве пластика ПВХ.
- 1 Структура хлорида натрия
- 1.1 Унитарная ячейка
- 2 свойства
- 2.1 Молекулярная формула
- 2.2 Молекулярный вес
- 2.3 Физическое описание
- 2,4 Цвет
- 2.5 Вкус
- 2.6 Точка кипения
- 2.7 Точка плавления
- 2.8 Растворимость в воде
- 2.9 Растворимость в органических растворителях
- 2.10 Плотность
- 2.11 Давление пара
- 2.12 Стабильность
- 2.13 Разложение
- 2.14 Вязкость
- 2.15 Коррозия
- 2,16 рН
- 3 использования
- 3.1 В еду
- 3.2 Промышленное использование
- 3.3 Дома
- 3.4 Другое использование
- 3.5 Терапевтическое использование
- 4 Токсичность
- 4.1 Проглатывание
- 4.2 Раздражение и физический контакт
- 5 ссылок
Видео:Опыты по химии. Электролиз раствора сульфата натрияСкачать

Структура хлорида натрия
Компактная кубическая структура хлорида натрия представлена на верхнем рисунке. Объемные зеленые сферы соответствуют анионам Cl — , в то время как белый, к катионам Na + . Обратите внимание, что кристалл NaCl состоит из сети ионов, упорядоченных по электростатическим взаимодействиям в соотношении 1: 1..
Хотя столбцы показаны на изображении, связи не ковалентные, а ионные. Использование столбцов полезно при отображении координационной геометрии вокруг иона. Например, в случае NaCl каждый Na + окружен шестью Cl — (белый октаэдр), и каждый Cl — из шести Na + (зеленый октаэдр).
Следовательно, он имеет координацию (6,6), номера которой указывают, сколько соседей окружает каждый ион. Число справа указывает на соседей Na + , в то время как слева — .
Другие представления опускают использование полос, чтобы выделить октаэдрические отверстия, которые имеет структура, которые являются результатом межузельного пространства между шестью анионами Cl. — (или катионы Na + упаковано. Такое расположение наблюдается в других моно (MX) или многоатомных неорганических солях и называется солью драгоценного камня..
Унитарная ячейка
Элементарная ячейка каменной соли является кубической, но какие именно кубы точно представляют ее на изображении выше? Октаэдры дают ответ. Оба покрывают в общей сложности четыре маленьких кубика.
У этих кубиков есть части ионов в их вершинах, краях и гранях. Соблюдая осторожность, ион Na + он расположен в центре и двенадцать из них по краям. Ион на одном ребре может быть разделен на четыре куба. Таким образом, есть 4 иона Na + (12 × 1/4 + 1 = 4).
Для ионов Cl — , восемь расположены в вершинах и шесть по краям. Поскольку ионы, расположенные в вершинах, делят пространство с восемью другими кубами, а на краях с шестью, они имеют 4 иона Cl — (8 × 1/8 + 6 × 1/2 = 4).
Предыдущий результат интерпретируется следующим образом: в элементарной ячейке NaCl имеется четыре катиона Na + и четыре Cl-аниона — ; пропорция, которая соответствует химической формуле (Na + для каждого Cl — ).
Видео:Хлор – жёлтый газ (часть 1). Химия – ПростоСкачать

Разложение солей при нагревании
Разложение солей при нагревании

При этом, как правило, выделяется NH3
* Нитраты металлов, стоящих в ряду напряжений до (левее, выше) Mg, разлагаются до нитритов (кроме LiNO3).
Иногда вместо NH3 выделяется N2 или N2O
Характер образующихся продуктов зависит от того, каким металлом образована соль, но во всех случаях выделяется O2.
* Нитраты металлов, стоящих в ряду напряжений до (левее, выше) Mg, разлагаются до нитритов (кроме LiNO3)
* Нитраты металлов, стоящих в ряду напряжений от Mg до Cu (включительно), разлагаются до оксида металла:
* Нитраты металлов, стоящих после Cu, разлагаются до металла:
При этом в результате диспропорционирования образуется сульфид и сульфат.
Гидросульфиты разлагаются до дисульфитов.
· Практически все соли угольной кислоты (карбонаты).
Исключения составляют только карбонаты щелочных металлов (кроме Li2CO3).
Гидрокарбонаты разлагаются все – сначала до соответствующего карбоната, а при более высокой температуре до оксида металла и CO2
Гидрокарбонаты щелочных металлов разлагаются до карбонатов. Исключение LiHCO3
· Многие соли серной кислоты (сульфаты).
Следует помнить, что разложение сульфатов происходит только при t > 700–800 ̊С. При это образуется оксид металла и SO3 или SO2+O2, т. к. при такой температуре SO3 разлагается
Сульфаты щелочных металлов и щелочноземельных металлов термостойки.
Гидросульфаты при прокаливании разлагаются сначала до дисульфатов, а затем до сульфатов.
(например, марганцовой HMnO4, двухромовой H2Cr2O7. Хлорноватой HClO3 и тд.)
При нагревании (кипячении) растворов разлагаются все комплексные соли, образованные амфотерными металлами.
При прокаливании разлагаются многие основные соли.
Некоторые соли разлагаются под действием света (фотохимические реакции).
Термостойки (плавятся без разложения)
фосфорной кислоты – фосфаты,
галогеноводородных кислот – фториды, хлориды, бромиды, иодиды.
Большинство солей щелочных металлов.
📹 Видео
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Распознавание растворов хлорида бария, сульфата натрия и серной кислотыСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать























