- Ca(HCO3)2 CaCO3 + CO2 + H2O
- Гидрокарбонат кальция
- Содержание
- Свойства
- Применение
- Получение
- Реакции разложения
- Разложение оксидов
- Разложение гидроксидов
- Разложение кислот
- Разложение солей
- Разложение хлоридов
- Разложение нитратов
- Разложение карбонатов и гидрокарбонатов
- Разложение сульфатов
- Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Разложение сульфитов
- Разложение солей аммония
- Разложение перманганата калия
- Разложение хлората и перхлората калия
Видео:Опыты по химии. Разложение гидрокарбоната натрия при нагреванииСкачать

Ca(HCO3)2  CaCO3 + CO2 + H2O
CaCO3 + CO2 + H2O
Реакция термического разложения гидрокарбоната кальция с образованием карбоната кальция, оксида углерода(IV) и воды. Реакция протекает при кипении.
Способ устранения временной жесткости воды путем кипячения.
Видео:Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Гидрокарбонат кальция
| Гидрокарбонат кальция | |
|---|---|
| Систематическое наименование | Гидрокарбонат кальция |
| Традиционные названия | Бикарбонат кальция, кислый углекислый кальций, двууглекислый кальций |
| Хим. формула | Ca(HCO3)2 |
| Молярная масса | 162.1124 г/моль |
| Рег. номер CAS | 3983-19-5 |
| PubChem | 10176262 |
| SMILES | |
| ChemSpider | 8351767 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрокарбонат кальция — неорганическое соединение, кислая соль кальция и угольной кислоты. Химическая формула — Ca(HCO3)2 .
Видео:Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

Содержание
Видео:Реакции разложения. Как понять?Скачать

Свойства
Как известно, все гидрокарбонаты растворимы в воде. Гидрокарбонат кальция обусловливает временную жёсткость воды. В организме гидрокарбонаты выполняют важную физиологическую роль — регулируют постоянство реакций в крови. При нагревании раствора гидрокарбоната кальция он разлагается:
Таким образом, реакция разложения гидрокарбоната кальция является обратной реакцией его образования. Именно это уравнение является основным, по которому образуется накипь в чайниках и водонагревательных системах, так как в исходной воде почти всегда содержится гидрокарбонат кальция, который более растворим, чем карбонат.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Применение
Нормативы рекомендуют концентрацию гидрокарбонатов в питьевой воде в диапазоне 30—400 мг/дм³ .
Видео:Опыты по химии. Превращение гидрокарбоната кальция в карбонат кипячениемСкачать

Получение
Гидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Реакции разложения
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Видео:Химия. ЕГЭ. Решение расчетных задач -1Скачать

Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Видео:Разложение гидрокарбоната натрияСкачать

Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Видео:Химия. 10 класс. Расчеты по уравнениям химических реакций /04.11.2020/Скачать

Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Разложение солей
Видео:Химия. КарбонатыСкачать

Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Видео:Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Видео:Карбонат натрия из пищевой содыСкачать

Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Видео:Разбор варианта ЕГЭ химия 2023. ДЕМО ФИПИ.Скачать

Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Видео:Проклятая химическая реакция 😜 #shortsСкачать

Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Видео:9 класс. Химия. ОГЭ. Задание 11. Классификация химических реакций.Скачать

Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Видео:Разложение солей в неорганической химии | Химия с Сашей Сильвер | ЕГЭ 2024 | SMITUPСкачать

Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Видео:Способы получения оксидовСкачать

Разложение перманганата калия
Видео:Гидрокарбонат натрия и лакмусСкачать

Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
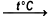 CaCO3 + CO2 + H2O
CaCO3 + CO2 + H2O