При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
- Разложение оксидов
- Разложение гидроксидов
- Разложение кислот
- Разложение солей
- Разложение хлоридов
- Разложение нитратов
- Разложение карбонатов и гидрокарбонатов
- Разложение сульфатов
- Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Разложение сульфитов
- Разложение солей аммония
- Разложение перманганата калия
- Разложение хлората и перхлората калия
- Формиат натрия
- Содержание
- Физико-химические свойства
- Основные свойства
- Требования безопасности
- Применение
- Формиат натрия
- Физико-химические свойства вещества
- Реакции получения
- Сферы применения
- Основные правила хранения и транспортировки
- Безопасность вещества
- Особенности фасовки
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Видео:Опыты по химии. Разложение гидрокарбоната натрия при нагреванииСкачать

Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Разложение солей
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Видео:Составление уравнений реакций (по валентности). 8 класс.Скачать

Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Видео:Гидроксид натрия.Цветные реакции с едким натром.Получение щелочи и опыты.Сульфид,сульфит из натрия!Скачать

Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Видео:9. ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ НИТРАТОВ/ Нужно знать/ ЕГЭ химия 2020Скачать

Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Разложение перманганата калия
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Видео:Формиат натрия из доступных реагентовСкачать

Формиат натрия
| Формиат натрия | |
|---|---|
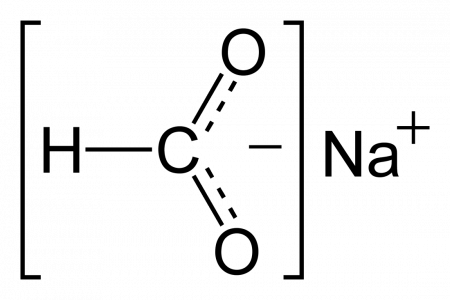 | |
| Хим. формула | HCO2Na |
| Состояние | твёрдое |
| Молярная масса | 68,01 г/моль |
| Плотность | 1,92 г/см³ |
| Температура | |
| • плавления | 253 °C |
| ГОСТ | ТУ 2432-011-00203803-98 |
| Рег. номер CAS | 141-53-7 |
| PubChem | 2723810 |
| Рег. номер EINECS | 205-488-0 |
| SMILES | |
| Кодекс Алиментариус | E237 |
| ChEBI | 62965 |
| ChemSpider | 8517 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Формиат натрия (натрий муравьинокислый) — химическое соединение с формулой HCOONa, побочный продукт производства пентаэритрита. Используется как восстановитель в органическом синтезе. Формиат натрия технический представляет собой формиат натрия с незначительной примесью пентаэритрита и его производных. Формиат натрия технический используется в качестве противоморозной добавки в производстве строительных конструкций, в кожевенной промышленности как агент в преддубильных операциях, как сырьё в производстве муравьиной кислоты.
Видео:ФОРМИАТ НАТРИЯ на́трий муравьиноки́слый, (химическая формула — HCOONa)! ГДЕ КУПИТЬ?Скачать

Содержание
- 1 Физико-химические свойства
- 2 Основные свойства
- 3 Требования безопасности
- 4 Применение
Видео:25. Схема реакции и химическое уравнениеСкачать

Физико-химические свойства
Кристаллический порошок белого или серого цвета без посторонних примесей, видимых невооружённым глазом. Допускается зеленоватый оттенок.
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Основные свойства
Хорошо растворим в воде, слабо растворим в спиртах, не растворим в эфирах. Не взрывается и не горит.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Требования безопасности
По степени воздействия на организм относится к веществам класса опасности 4. Опасность для человека: в высоких концентрациях формиат натрия может вызывать раздражение верхних дыхательных путей и слизистых оболочек. Индивидуальные средства защиты: при работе с формиатом натрия следует применять индивидуальные средства защиты — халат, респиратор, резиновые перчатки. В аварийных ситуациях необходимо использовать противогаз марки А или М.
Формиат натрия технический взрывобезопасен и не горюч, однако в местах хранения и работы с ним следует запрещать курение и применение открытого огня.
Видео:Карбонат натрия из пищевой содыСкачать

Применение
Как добавка в противогололедные материалы для снижения воздействия на окружающую среду и на металлические части транспорта, искусственных сооружений объектов дорожного хозяйства (ингибитор коррозии).
Как противоморозная добавка формиат натрия применяется при возведении монолитных бетонных и железобетонных конструкций, монолитных частей сборно-монолитных конструкций и замоноличивания стыков сборных конструкций, а также при изготовлении сборных бетонных и железобетонных изделий на полигонах при установившейся среднесуточной температуре наружного воздуха ниже 5 °C.
Бетон с данной добавкой запрещается применять в предварительно напряжённых конструкциях, армированных сталью классов AT-IY, AT-YI, A-IY и А-У, в бетонных и железобетонных конструкциях, предназначенных для эксплуатации в водных и газовых средах при относительной влажности воздуха более 60 % при наличии в заполнителе включений реакционноспособного кремнезёма, в железобетонных конструкциях для электрифицированного транспорта и промышленных предприятий, применяющих постоянный электрический ток.
Формиат натрия вводится в бетонную смесь в количестве:
- 2 % от массы цемента в пересчете на сухой формиат натрия при расчетной температуре твердения до -5 °C;
- 3 % от массы цемента в пересчете на сухой формиат натрия при расчетной температуре твердения до −10 °C;
- 4 % от массы цемента при пересчете на сухой формиат натрия при расчетной температуре твердения до −15 °C.
При приготовлении бетона (раствора) добавку необходимо растворить в тёплой воде. Полученный раствор добавляется вместе с водой затворения. Полученный раствор следует дозировать в бетоносмеситель через дозатор химических добавок или через дозатор воды, при этом следует снизить расход воды затворения на 7-13 %
Видео:Формиат натрия в домашних условияхСкачать

Формиат натрия
Формиат натрия является химическим соединением, которое получают в результате переработки пентаэритрита. Также его называют натриевой солью муравьиной кислоты. Основой этого вещества является пентаэритрит, вместе с его производными. Широкое применение формиата натрия сосредоточено в строительной, химической и кожевенной промышленности.
Физико-химические свойства вещества
Натриевая соль муравьиной кислоты в чистом виде имеет кристаллическую структуру. Зачастую это химическое вещество производится белого цвета, но иногда оно может иметь оттенки зеленого и серого. Инородные включения в основной массе зачастую отсутствуют.
Формула формиата натрия HCO2Na. Допустимая влажность сухого кристаллического вещества не должна превышать 3%.
Это соединение быстро растворяется в водной среде, более низкая растворяемость замечается при взаимодействии формиата натрия со спиртами, не растворяется в эфирах. Само по себе это вещество не способно к возгоранию, но стоит отметить, что при взаимодействии и работе с формиатом натрия категорически запрещено наличие открытого огня.
Также формиат натрия не относится к токсичным химическим соединениям. При взаимодействии с водой и другими материалами не образовывает вредных для человека элементов. Это вещество при попадании в сточные воды не приносит вреда окружающей среде. Уровень качества технического формиата натрия проверяют по ТУ 2432-011-00203803-98.
Реакции получения
Получение формиата натрия может основываться на реакциях с муравьиной кислотой, угарным газом, этилформиатом или углекислым газом.
• получение формиата натрия из угарного газа
• образование формиата натрия из муравьиной кислоты
• получение углекислого газа с помощью формиата натрия
5НСООNa + 2KMnO4 + 8H2SO4 = 2MnSO4 + K2SO4 + 5СО2↑ + 5NaHSO4 + 8Н2О
NaH + CO2 = HCOONa
• реакция образования формиата натрия при взаимодействии с метанолом
• Существуют и обратные реакции, позволяющие получить из формиата натрия муравьиную кислоту.
NaOH + CO → HCOONa
HCOONa + H2SO4 → Na2SO4 + HCOOH
Во время этой реакции формиат натрия взаимодействует с серной кислотой.
Сферы применения
Пластифицирующие свойства формиата натрия нашли свое место в строительстве. Формиат натрия, например, как добавку вводят в бетонные и железобетонные конструкции как монолитные, так и разборные. Это химическое соединение выступает в качестве противоморозной добавки, функционирующей при температуре ниже -5°C.
Допустимое количество формиата натрия в бетоне составляет:
- • 2% от всей массы при температурном режиме -5°C,
- • 3% от всей массы при -10°C,
- • 4% от всей массы при -15°C.
Перед непосредственным введением раствора формиата натрия в бетон, его разводят в теплой воде. Для получения более однородной и пластичной массы в полученный состав вводят суперпластификаторы, например, суперластификатор С-3.
Стоит отметить, что подобная добавка запрещена для применения в строительстве напряженных конструкций. Ее нельзя вводить в бетонные смеси, которые будут использоваться для водных и газовых хозяйств, строительства конструкций для электрифицированного транспорта.
Формиат натрия используют в процессе изготовления противогололедных материалов. Он помогает снизить уровень негативного воздействия на металлические узлы транспорта. Его считают ингибитором коррозии. Формиат натрия добавляют в бетонные конструкции для полигонов. В результате, это химическое вещество способствует увеличению прочности бетона, снижает температуру замерзания воды, продлевает устойчивость бетонного покрытия.
Основные правила хранения и транспортировки
В соответствии с техническими условиями формиат натрия транспортируют любым видом крытого транспорта. Формиат натрия допускается хранить в чистом виде только в сухих и хорошо вентилируемых помещениях. Мешки с этим вещество должны складироваться на деревянные поддоны.
Также необходимо следить, чтобы тара с формиатом натрия была герметично закрыта, так как это вещество имеет высокую гидрофильность. Допустимый срок годности этого вещества – 12 месяцев со дня производства.
Безопасность вещества
Во время работы с формиатом натрия необходимо придерживаться соответствующих правил безопасности. Рабочий персонал должен быть обеспечен защитной формой одежды, респиратором и резиновыми перчатками. Допустимой нормой концентрации в воздухе считается 10 мг/м3. Этот показатель рассчитан для рабочей зоны.
Формиат натрия – это химическое соединение, относящееся к 3 классу опасности для человека.При длительном взаимодействии с формиатом натрия можно замечать длительный кашель. Человек может почувствовать следующие симптомы:
- • покраснение горла,
- • удушливый кашель,
- • слезоточивость,
- • насморк.
Если случилась аварийная ситуация, то рабочий персонал должен надеть противогазы.
Особенности фасовки
Для того чтобы это вещество не насыщалось влагой, его должны герметично упаковывать. Одним из самых распространенных видов паковки считается плотный бумажный мешок. Он должен состоять из 5-6 слоев плотной бумаги. В середине мешка должна быть пакет-вкладка, в которую непосредственно проходит фасовка вещества. Допустимая масса 1 мешка составляет 35 кг.
Цена 1 кг формиата натрия в Российской Федерации в среднем составляет 40-50 рублей.






