- Понятие о растворах
- Электролитическая диссоциация
- Ионно-молекулярные уравнения реакций
- Понятие о рН (водородном показателе)
- Гидролиз солей
- Выводы
- Растворы
- Растворы
- Численное выражение состава растворов
- Растворимость веществ в воде
- Тепловые явления при растворения
- Электролиты и неэлектролиты
- Теория электролитической диссоциации
- Механизм диссоциации
- Гидратация ионов
- Диссоциация кислот, оснований и солеи в водных растворах
- Степень дмссоциации
- Сильные и слабые электролиты
- Реакции ионного обмена
- Диссоциация воды. рН
- Протолитическая теория кислот и оснований
- Растворы и растворимость
- Растворение веществ в воде
- Решение задач на тему: растворимость веществ
- Определение масс растворенного вещества и растворителя для приготовления насыщенного раствора при определенной температуре
- Расчет масс растворяемого вещества и для приготовления насыщенного раствора по известной массе растворителя
- Расчет массы растворителя, необходимого для растворения определенной массы вещества при определенной температуре
- Определение растворимости вещества выпариванием
- Массовая доля растворенного вещества
- Молярная концентрация вещества в растворе
- Расчет молярной концентрации раствора
- Расчет массы вещества, необходимой для приготовления раствора
- Массовые доли растворенного вещества
- Расчет массы вещества и массы растворителя, необходимых для приготовления раствора определенной концентрации
- Расчет массы (объема) раствора по известной концентрации раствора и по массе растворенного вещества
- Расчет массы растворенного вещества по известной массе растворителя и концентрации раствора
- Расчет объема раствора
- Пересчет процентной концентрации раствора на молярную
- Расчет объема раствора процентной концентрации для приготовления раствора молярной концентрации
- Расчётные задачи по уравнениям реакций с использованием концентрации раствора
- Способы изменения концентрации раствора
- Определение концентрации раствора, полученного смешением двух растворов с известными концентрациями
- Определение концентрации раствора после разбавления
- Определение концентрации после увеличения массы растворенного вещества в растворе
- Химическая реакция растворения
- Растворение — что это за процесс
- Основные этапы: физическая и химическая стадия
- Признаки химического взаимодействия при растворении
- Факторы растворимости веществ
- Примеры растворения твердых веществ в воде
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Понятие о растворах
Нет на Земле человека, который никогда не видел бы растворов. А что это такое?
Раствор — это однородная (гомогенная) смесь двух или более компонентов (составных частей, или веществ).
Что такое однородная смесь? Однородность смеси предполагает, что между составляющими её веществами отсутствует поверхность раздела. В этом случае невозможно, по крайней мере, визуально, определить, сколько веществ образовало данную смесь. Например, глядя на стакан водопроводной воды, трудно предположить, что в ней, кроме молекул воды, содержится еще добрый десяток ионов и молекул (О2, СО2, Са 2+ и другие). И никакой микроскоп не поможет увидеть эти частицы.
Но отсутствие поверхности раздела — не единственный признак однородности. В однородной смеси состав смеси в любой точке одинаков. Поэтому для получения раствора нужно тщательно перемешать образующие его компоненты (вещества).
Растворы могут иметь разное агрегатное состояние:
- газообразное (например, смесь газов: О2, N2, СО2, Аr образуют воздух);
- жидкое (например, одеколон, сироп, рассол);
- твёрдое (например, сплавы).
Одно из веществ, которые образуют раствор, называется растворителем. Растворитель имеет то же агрегатное состояние, что и раствор. Так, для жидких растворов — это жидкость: вода, масло, бензин и т. д. Чаще всего на практике применяются водные растворы. О них и пойдет далее речь (если не будет сделана соответствующая оговорка).
Что происходит при растворении различных веществ в воде? Почему одни вещества хорошо растворяются в воде, а другие — плохо? От чего зависит растворимость — способность вещества растворяться в воде?
Представим себе, что в стакан тёплой водой положили кусочек сахара. Полежал он, уменьшился в размерах и… исчез. Куда? Неужели нарушается Закон сохранения вещества (его массы, энергии)? Нет. Сделайте глоток полученного раствора, и вы убедитесь, что вода сладкая, сахар не исчез. Но почему его не видно?
Дело в том, что в ходе растворения происходит дробление (измельчение) вещества. В данном случае кусочек сахара распался на молекулы, а их мы видеть не можем. Да, но почему сахар, лежащий на столе, не распадается на молекулы? Почему кусочек маргарина, опущенный в воду, тоже никуда не исчезает? Дело в том, что дробление растворяемого вещества происходит под действием растворителя, например воды. Но растворитель сможет «растащить» кристалл, твёрдое вещество на молекулы, если сумеет «уцепиться» за эти частицы. Другими словами, при растворении вещества должно быть взаимодействие между веществом и растворителем. Такое взаимодействие между веществом и растворителем называется сольватацией, а в случае воды — гидратацией.
Когда возможно такое взаимодействие? Только в том случае, когда строение веществ (и растворяемого, и растворителя) похоже, подобно. Издавна известно правило алхимиков: «подобное растворяется в подобном». В наших примерах молекулы сахара полярны, и между ними и полярными молекулами воды существуют определённые силы взаимодействия. Такие силы отсутствуют между неполярными молекулами жира и полярными молекулами воды. Поэтому жиры в воде не растворяются. Таким образом, растворимость зависит от природы растворяемого вещества и растворителя.
В результате взаимодействия между растворяемым веществом и водой образуются соединения — гидраты. Это могут быть очень прочные соединения:
Такие соединения существуют как индивидуальные вещества: основания, кислородсодержащие кислоты*.
Их общее название — гидроксиды.
Естественно, при образовании таких прочных соединений возникают прочные химические связи, выделяется теплота. Так, при растворении СаО (негашёная известь) в воде выделяется так много теплоты, что смесь закипает.
Но почему при растворении сахара или соли в воде полученный раствор не нагревается? Во-первых, далеко не все гидраты так прочны, как серная кислота или гидроксид кальция. Существуют гидраты солей (кристаллогидраты), которые легко разлагаются при нагревании:
Многие гидраты не выделены в свободном виде, а это означает, что при их образовании выделяется сравнительно мало теплоты.
Во-вторых, всегда при растворении, как уже упоминалось, идёт процесс дробления. А на это, естественно, затрачивается энергия, поглощается теплота.
Поскольку оба процесса происходят одновременно, раствор может нагреваться или охлаждаться в зависимости от того, какой процесс преобладает.
Вопрос. Какой процесс: дробление или гидратация преобладает в каждом случае:
- при растворении серной кислоты в воде, если раствор нагрелся;
- при растворении нитрата аммония в воде, если раствор охладился;
- при растворении поваренной соли в воде, если температура раствора практически не изменилась в ходе растворения.
Поскольку при растворении изменяется температура раствора, естественно предположить, что растворимость зависит от температуры. Действительно, растворимость большинства твёрдых веществ увеличивается при нагревании. Растворимость газов при нагревании уменьшается. Поэтому твёрдые вещества обычно растворяют в тёплой или горячей воде, а газированные напитки хранят на холоде.
Растворимость (способность растворяться) веществ не зависит от измельчения вещества или интенсивности перемешивания. Но, измельчая вещество, перемешивая готовый раствор, можно ускорить процесс растворения. Таким образом, изменяя условия получения раствора, можно получать растворы разных составов. Естественно, существует предел, достигнув которого легко обнаружить, что вещество больше не растворяется в воде. Такой раствор называется насыщенным. Для хорошо растворимых веществ насыщенный раствор будет содержать много растворённого вещества. Так, насыщенный раствор KNO3 при 100 °C содержит 245 граммов соли на 100 граммов воды (в 345 граммах раствора), это концентрированный раствор. Насыщенные растворы плохо растворимых веществ содержат ничтожные массы растворённых соединений. Так, насыщенный раствор хлорида серебра содержит 0,15 мг AgCl в 100 г воды. Это очень разбавленный раствор.
Таким образом, если раствор содержит много растворённого вещества по отношению к растворителю, то он называется концентрированным, если вещества мало — то разбавленным. Очень часто от состава раствора зависят его свойства, а значит, и применение.
Так, разбавленный раствор уксусной кислоты (столовый уксус) используют как вкусовую приправу, а концентрированный раствор этой кислоты (уксусная эссенция) может вызвать смертельный ожог при неосторожном применении (приёме внутрь).
Для того чтобы точно отразить состав растворов, используют величину, равную массовой доле растворенного вещества ω:
где m(вещества) — масса растворённого вещества в растворе; m(раствора) — общая масса раствора, содержащая растворённое вещество и растворитель.
Так, если 100 граммов уксуса содержат 6 граммов уксусной кислоты, то речь идёт о 6 %-ном растворе уксусной кислоты (это — столовый уксус). Способы решения задач с использованием понятия массовой доли растворённого вещества рассмотрены в уроке 30.2.
Видео:Как понять что вещество выпадает в осадок или образуется газСкачать

Электролитическая диссоциация
Всем известно, что металлы проводят электрическим ток. А проводят ли электрический ток растворы? Если бы мы попытались ответить на этот вопрос при помощи опыта, то убедились бы, что раствор сахара не проводит электрический ток, а раствор поваренной соли проводит. Почему? Может быть, исходные вещества — вода или сухой хлорид натрия — электропроводны? Но аналогичный опыт показывает — эти вещества, каждое само по себе, электрический ток проводить не могут.
Для того чтобы объяснить результаты этих опытов и понять смысл явления, необходимо ответить на вопрос: почему вообще некоторые вещества, например металлы, проводят электрический ток? Это происходит потому, что в металлах имеются «свободные» заряженные частицы — электроны. С направленным движением этих заряженных частиц связана электропроводность металлов. Таким образом, если раствор NаСl проводит электрический ток, то, значит, в этом растворе тоже образуются какие-то заряженные частицы. Если раствор сахара не проводит электрический ток, значит, в растворе сахара заряженных частиц не образуется. Исходя из этого, такие вещества называют:
- NаСl — электролит;
- Сахар — неэлектролит.
Итак: ЭЛЕКТРОЛИТЫ — это вещества, растворы (и расплавы) которых проводят электрический ток. А ПОЧЕМУ?
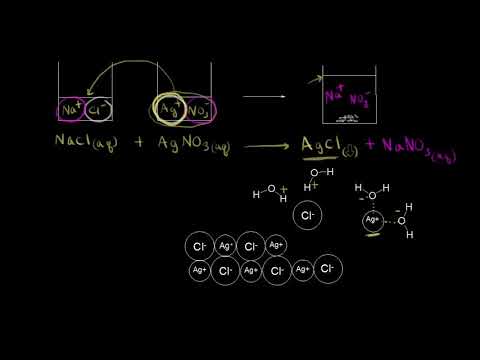
Теперь нам осталось выяснить: откуда в растворе NаСl появились заряженные частицы? Вспомните, какой тип химической связи имеется в кристалле поваренной соли? Ионная связь! То есть связь между заряженными частицами — ионами. Значит, хлорид натрия состоит из разноимённо заряженных частиц! Но почему тогда сухой хлорид натрия не проводит электрический ток? Потому что между ионами в кристалле существуют достаточно сильные электростатические взаимодействия. А в воде? Посмотрите на рис. 26.
Между ионами соли и молекулами воды возникают довольно значительные силы электростатического взаимодействия. В результате молекулы воды «растаскивают» кристалл на «кусочки» (ионы). Будут ли возникать такие взаимодействия в следующих случаях (рис. 27)?
Очевидно, нет! В обоих случаях или растворитель (случай I), или вещество (случай II) неполярны, и взаимодействия, притяжение частиц друг к другу, ничтожны.
Вывод. Взаимодействие между веществом и растворителем возможно, если и вещество, и растворитель имеют достаточно полярные связи.
Следствием такого взаимодействия является диссоциация — распад вещества на ионы. При этом образуются положительно заряженные ионы — катионы и отрицательно заряженные ионы — анионы.
Электролитическая диссоциация — процесс распада электролитов на ионы под действием полярных молекул растворителя (чаще всего — воды).
Задание 6.1. Будут ли проводить электрический ток:
- раствор НСl в воде;
- раствор NаСl в бензине;
- раствор азота в воде;
- 100 %-ная серная кислота?
Если вы всё правильно поняли и правильно ответили, то электропроводность возникнет только в первом случае, а в остальных случаях отсутствуют необходимые для этого условия. Попробуйте сформулировать, какие это условия? Итак.
Вещества, способные в растворах или расплавах распадаться на ионы и, как следствие, проводить в этом состоянии электрический ток, называются электролитами.
К электролитам относят:
Это могут быть как неорганические, так и органические вещества. Правда, большинство органических веществ являются неэлектролитами. Это углеводороды (бензин), углеводы (сахар), спирты (глицерин) и другие (см. уроки 17–28 данного самоучителя).
Задание ЕГЭ. Электролитом является каждое из двух веществ:
- глюкоза и этиловый спирт;
- ацетат натрия и гидроксид калия;
- уксусная кислота и бензол;
- сахар и повареная соль.
Задание ЕГЭ. Электрический ток проводят:
- спиртовой раствор йода,
- расплав парафина,
- расплав ацетата калия,
- водный раствор глюкозы.
Если проверить электропроводность растворов электролитов одного класса, например кислот, то окажется, что в одном случае лампочка вспыхивает ярко, в другом — еле светится. Если принять во внимание, что концентрация веществ в обоих растворах одинакова, — как можно объяснить наблюдения?
Объяснение одно — в первом случае образуется большее число ионов (заряженных частиц), во втором — меньшее. То есть в первом случае электролитическая диссоциация идёт в значительней степени. Такие электролиты называются сильными, и в их растворах много ионов или почти нет (а иногда и совсем нет) молекул. Эти вещества построены по ионному типу или содержат сильнополярные ковалентные связи.
К СИЛЬНЫМ электролитам относятся:
- почти все соли;
- кислоты: НСl, НВr, НI, НNО3, Н2SО4, HClO4 и др.;
- щёлочи (кроме NН4ОН).
Вопрос. Что такое «щёлочь»? (В случае затруднений — см. урок 2.3.)
В растворах слабых электролитов много молекул вещества и мало ионов; электролитическая диссоциация идёт не полностью.
К слабым электролитам относятся:
Фосфорная и сернистая кислоты — электролиты средней силы.
Задание 6.2. Выучите наизусть формулы сильных и слабых электролитов. Вспомните их названия.
Силу электролита можно оценить при помощи степени диссоциации α, которая показывает, какая часть растворённых молекул распалась на ионы:
где n — число молекул, распавшихся на ионы; N — общее число молекул электролита в растворе.
В разбавленных растворов сильных электролитов степень диссоциации α = 1 (или близка к этой величине), т. е. молекул практически нет. Для слабых электролитов α + ) и анион ОН – :
Задание 6.4. Составьте уравнения диссоциации гидроксида калия; гидроксида аммония, гидроксида бария.
КИСЛОТЫ диссоциируют на катион водорода и анион кислотного остатка:
Задание 6.5. Составьте уравнения диссоциации соляной кислоты, серной кислоты, фосфорной кислоты.
Для многоосновных кислот диссоциация может происходить ступенчато. Это означает, что на каждой стадии отщепляется только один ион водорода. Например:
Задание 6.6. Составьте уравнения ступенчатой (постадийной) диссоциации фосфорной кислоты.
Вопрос. Какой из этих процессов идёт в большей степени, то есть какие ионы образуются в большей степени: Н2РО4 – , НРО4 2– или РО4 3– ?
Поскольку отрыв катиона от двухзарядного аниона в высшей степени затруднён (более реальным кажется обратный процесс), то последний процесс практически не происходит. Поэтому по первой стадии Н3РО4 диссоциирует как сильная кислота, а по последней — как очень слабая, причём в растворе фосфорной кислоты фосфат-ионов РО4 3– практически нет.
В целом, сила кислоты определяется:
- её составом;
- степенью окисления центрального атома (чем она больше, тем сильнее кислота);
- стадией диссоциации её.
Вопрос. Предположите, какая кислота более сильная:
- азотная или азотистая;
- серная или сернистая?
Задание ЕГЭ. Какие суждения о диссоциации кислот в водных растворах верны?
- Кислоты в воде диссоциируют с образованием в качестве катиона только иона Н + .
- Среди анионов, образующихся при диссоциации кислот, могут присутствовать разные кислотные остатки.
Разумеется, верны оба суждения.
Задание ЕГЭ. В каком из растворов с одинаковой молярной концентрацией содержание фосфат-ионов наибольшее:
Сила оснований также зависит от заряда иона (валентности) металла: чем он больше, тем слабее электролит (при прочих равных условиях). Так, гидроксид кальция слабее гидроксида натрия, а гидроксид железа (III) слабее гидроксида железа (II).
Видео:ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать

Ионно-молекулярные уравнения реакций
Из вышеизложенного следует, что в растворах большинства неорганических веществ, наряду с молекулами, находится значительное число ионов. В таком случае уравнения реакций, которые показывают состав молекул реагирующих веществ, весьма условны. Более точно отражают состав реагирующих частиц ионно-молекулярные уравнения.
Для того чтобы составить ионно-молекулярное уравнение реакции, нужно записать в виде ИОНОВ химические формулы:
- сильныхи одновременно
- растворимых электролитов.
Состав всех остальных веществ изображается в виде молекул.
На практике, при составлении таких уравнений рекомендуется следовать следующему алгоритму:
1. Определить силу реагирующих электролитов:
2. Для сильных электролитов определить растворимость (по таблице растворимости):
3. Формулы сильных и одновременно растворимых электролитов записать в виде ионов, остальные формулы НЕ ИЗМЕНЯТЬ!
4. Одинаковые ионы «вычеркиваем», так как они не участвуют в реакции (не изменили ни состава, ни заряда), получаем краткое ионно-молекулярное уравнение:
Краткое ионно-молекулярное уравнение показывает:
- что реакция возможна;
- что в результате реакции образуется осадок (СuS);
- какие ионы или молекулы должны участвовать в аналогичном процессе.
Для того, чтобы переписать краткое ионно-молекулярное уравнение в молекулярном виде, необходимо вместо:
- ионов H + написать формулу сильной кислоты;
- ионов ОH — написать формулу щёлочи;
- остальных ионов написать формулу растворимой соли.
Например, для того чтобы осуществить процесс:
вместо нитрата меди можно взять любую растворимую соль меди (II), так как она при электролитической диссоциации посылает в раствор ион меди, а анион соли в реакции не участвует:
Задание 6.7. Составьте молекулярные и ионно-молекулярные уравнения реакции для этих процессов и убедитесь, что краткие ионно-молекулярные уравнения реакций у них одинаковые.
Задание 6.8. Записать в молекулярном и молекулярно-ионном виде уравнения, соответствующие предложенным кратким молекулярно-ионным уравнениям:
При составлении ионно-молекулярных уравнений может получиться так, что все частицы будут вычеркнуты, так как не изменят ни состава, ни заряда. В этом случае говорят, что реакция в растворе не идёт. В принципе, можно заранее предсказать возможность такого процесса: реакция ионного обмена в растворе возможна, если происходит связывание ионов, т. е. образуется осадок, газ, слабый электролит или ион нового состава.
Задание 6.9. Составьте ионно-молекулярные уравнения реакций:
- фосфат натрия + хлорид кальция →
- карбонат бария + азотная кислота →
- гидроксид железа III + серная кислота →
- сульфат аммония + гидроксид калия →
- нитрат алюминия + хлорид натрия →
Сделайте заключение: возможны ли эти процессы. Укажите признаки возможных процессов (осадок, газ, слабый электролит).
Вывод: любая реакция ионного обмена протекает в сторону связывания ионов, поэтому в результате такой реакции образуется слабый электролит или осадок, или газ.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Понятие о рН (водородном показателе)
Вода — очень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н + и 1 моль гидроксид-анионов ОН – . Другими словами: в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
Здесь: [Н + ] — равновесная концентрация ионов водорода, моль/л; [OH – ] — равновесная концентрация гидроксид-анионов, моль/л.
Такой раствор (среда) называется «нейтральный».
Характер среды — кислый, нейтральный — можно оценить количественно при помощи рН («пэ-аш»). Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком*:
* Логарифм (lg) — это величина, равная показателю степени при основании 10. Например: lg 100 = lg 10 2 = 2.
Поэтому в случае чистой воды рН = 7.
Раствор, у которого рН = 7, называется нейтральным.
Если к чистой воде добавили кислоту, то увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например 10 –6 моль/л или 10 –2 моль/л.
Такая среда (раствор) называется «кислая», или «кислотная». Причём в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2) — сильнокислой, т. е. в любом случае рН – , и одновременно уменьшается концентрация ионов Н + . Дело в том, что для любого водного раствора
Поэтому, если концентрация ионов ОН – составит 10 –3, то [H + ] = 10 –11 , т. е.
рН > 7, среда щелочная.
Определить реакцию среды конкретного раствора можно при помощи индикаторов.
Индикаторы — это вещества, которые изменяют свой цвет в присутствии избытка ионов Н + или ОН – .
Ионы Н + или ОН – действуют на молекулу индикатора, и индикатор меняет цвет по-разному в зависимости от реакции среды и вида самого индикатора (табл. 7).
Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
- рН + ] = 10 –4 моль/л;
- в растворе есть избыток ОН – ;
- рН = 7;
- [ОН – ] = 10 –8 моль/л;
- в растворе есть НNО3;
- [ОН – ] = 0,1 моль/л.
Окраска индикаторов изменяется в растворах, которые содержат избыток одного из этих ионов. Ионы Н + или ОН – могут образовываться в ходе диссоциации некоторых соединений.
Вопрос. Какие вещества при диссоциации образуют ионы Н + или ОН – ?
Эти ионы могут образовываться при диссоциации растворимых кислот, оснований, некоторых кислых и основных солей. Например, дигидрофосфат натрия образует при диссоциации ионы водорода, а гидрофосфат натрия — нет. Дело в том, что кислые соли могут диссоциировать ступенчато, если полученный на первой стадии анион соответствует сильному электролиту:
остаток слабого электролита → диссоциация не идёт;
остаток сильного электролита → диссоциация идёт:
Образуются ионы Н + , возникает кислая среда.
Кроме того, ионы Н + или ОН – могут образовываться в ходе взаимодействия некоторых веществ с водой. Например, с водой могут взаимодействовать активные металлы, кислотные и основные оксиды.
Задание 6.11. Какую окраску будет иметь индикатор лакмус, если в воде растворить: кальций, оксид лития, оксид серы (IV)?
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Гидролиз солей
Попробуйте ответить на вопрос: изменится ли окраска лакмуса в растворе серной кислоты? гидроксида натрия? сульфата натрия? карбоната натрия? В первых двух случаях можно уверенно сказать «да», так как при диссоциации образуются:
ионы водорода (уравнение 1) или гидроксид-анионы (уравнение 2), а индикаторы реагируют именно на избыток ионов Н + или ОН – . Но при диссоциации упомянутых солей:
ионы Н + и ОН – не образуются! Тем не менее раствор карбоната натрия изменяет окраску индикатора, а сульфата натрия — нет! Почему? Видимо, причина в том, что ионы карбоната натрия вступают в какую-то реакцию с молекулами воды, ведь только из молекулы воды может образоваться избыток Н + или ОН – .
Гидролиз солей — это процесс взаимодействия ионов соли с молекулами воды, в результате чего изменяется рН раствора.
Какой ион карбоната натрия реагирует с водой? Предположим, что оба. Тогда в растворе происходят процессы:
Вспомните, что такое «сильный электролит», «слабый электролит», и ответьте на вопрос: какой из этих процессов (А или Б) НЕВОЗМОЖЕН в растворе?
Очевидно, невозможен процесс (А), так как молекул сильного электролита NаОН в растворе НЕТ, есть только ионы Na + и ОН – , другими словами, связывания ионов не происходит.
Следовательно, происходит процесс (Б), и краткое ионномолекулярное уравнение гидролиза карбоната натрия выглядит так:
pH > 7, среда щелочная, лакмус синий.
И действительно, в растворе карбоната натрия лакмус становится синим. Почему именно карбонат-анион вступает в реакцию гидролиза? Потому что это ион, соответствующий СЛАБОМУ электролиту и в результате его взаимодействия с водой образуется СЛАБЫЙ электролит (вспомните условия протекания ионных процессов).
Вывод. Гидролизу подвергаются соли, содержащие остаток слабого электролита.
Задание 6.12. Определите, происходит ли гидролиз в растворах хлорида железа (III), силиката натрия, нитрата калия. Ответ поясните.
Алгоритм составления уравнений реакции гидролиза:
1. Определить какие электролиты образуют соль, отметить их силу:
2. Составить уравнение диссоциации соли, подчеркнуть ион, соответствующий слабому электролиту:
3. Для иона слабого электролита составить уравнение реакции взаимодействия с одной молекулой воды (уравнение гидролиза):
- из молекулы воды притягивается противоположно заряженный нон, в данном случае ОН – ;
- сумма зарядов до и после реакции равна:
4. Определить реакцию среды в образовавшемся растворе: в данном случае образовались ионы Н + , значит, среда кислая, рН – );
составить полученные формулы по валентности (валентность = заряду иона!):
Задание 6.13. Составить уравнения реакций гидролиза для: сульфата алюминия; силиката калия; хлорида натрия; нитрата меди (II); сульфида калия.
Задание 6.14. Как при помощи лакмуса различить бесцветные растворы солей: нитрата свинца (II), сульфата калия, сульфида натрия?
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Выводы
Растворы — это однородная смесь двух или более компонентов. При образовании растворов в результате сольватации происходит дробление растворяемого вещества до молекул или ионов.
Истинный раствор — это однородная смесь молекул и ионов различных веществ.
Электролиты это вещества, которые в водных растворах распадаются на ионы (диссоциируют). Уравнения реакций для таких веществ составляют с учётом этого процесса в ионно-молекулярной форме. Реакции ионного обмена, в том числе гидролиз, осуществимы, если происходит связывание ионов, т. е. образуется осадок, газ или слабый электролит.
Видео:Электролиз. 10 класс.Скачать

Растворы
Содержание:
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Растворы
Раствор — это однородная (гомогенная) смесь двух или более компонентов (составных частей, или веществ).
Численное выражение состава растворов
В природе и технике растворы имеют огромное значение. Растения усваивают вещества в виде растворов. Усвоение пищи связано с переводом питательных веществ в раствор. Все природные воды являются растворами. Растворами являются важнейшие физиологические жидкости — кровь, лимфа и др. Многие химические реакции протекают в растворах.
Растворы — это однородные (гомогенные) системы, состоящие из двух и более компонентов (составных частей) и продуктов их взаимодействия.
Так, например, раствор серной кислоты состоит из растворителя — воды (первый компонент), растворенного вещества — кислоты (второй компонент) и продуктов их взаимодействия — гидратированных ионов: 




По агрегатному состоянию растворы бывают жидкие, твердые и газообразные. Примером жидких растворов могут быть растворы солей в воде; примером твердых — сплав никеля и меди (из которых делают разменную монету) или сплав серебра и золота; примером газообразных — смеси газов, воздух. Наибольшее значение имеют жидкие (водные) растворы.
Важной характеристикой любого раствора является его состав.
Существуют различные способы численного выражения состава растворов: массовая доля растворенного вещества, молярная концентрация и др.
Массовая доля растворенного вещества — это безразмерная физическая величина, равная отношению массы растворенного вещества к общей массе раствора, т. е.
где 

Массовую долю растворенного вещества 
Молярная концентрация или молярность — это величина, равная отношению количества растворенного вещества к объему раствора, т. е.
где с(Х) — молярная концентрация частиц X, п(Х) — количество вещества частиц X, содержащихся в растворе, V — объем раствора. Основной единицей молярной концентрации является моль/л. Примеры записи молярной концентрации: с(НСl) = 0,1 моль/л, с(



Раствор, в 1 л которого содержится 1 моль растворенного вещества, называется молярным.
Если в 1 л раствора содержится 0,1 моль вещества, то он называется децимолярным, 0,01 моль — сантимолярным, 0,001 моль — миллимолярным. Молярность раствора обычно обозначается буквой М. Например, 1MNaOH — молярный раствор гидроксида натрия, 1 л такого раствора содержит 1 моль вещества или 1 моль

Чтобы приготовить, например, децимолярный раствор гидроксида натрия, надо отвесить 4 г его, внести в литровую мерную колбу, на горлышке которой отмечен объем, точно равный 1 л (рис. 5.1, а), добавить дистиллированной воды до полного растворения вещества и затем раствор довести до метки [нижняя часть мениска должна касаться метки (рис. 5.1, б)].
Пользоваться молярной концентрацией удобно, так как известно число молей (количество вещества), содержащееся в определенном объеме раствора. Например, для нейтрализации 1 л 1М раствора NaOH необходимы в соответствии с уравнениями реакций:
a) 
следующие объемы растворов кислот: 1 л 1М НСl или 0,5 л 1М 


Растворимость веществ в воде
Растворимость — это свойство вещества растворяться в воде или другом растворителе. В воде могут растворяться твердые, жидкие и газообразные вещества.
По растворимости в воде все вещества делятся на три группы: 1) хорошо растворимые, 2) мало растворимые и 3) практически нерастворимые. Последние называют также нерастворимыми веществами. Однако следует отметить, что абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или кусочек золота или серебра, то они в ничтожно малых количествах все же растворяются в воде. Как известно, растворы серебра или золота в воде убивают микробов.
Стекло, серебро, золото — это примеры практически нерастворимых в воде веществ (твердые вещества). К ним следует также отнести керосин, растительное масло (жидкие вещества), благородные газы (газообразные вещества). Примером малорастворимых в воде веществ могут служить гипс, сульфат свинца (твердые вещества), диэтиловый эфир, бензол (жидкие вещества), метан, азот, кислород (газообразные вещества). Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества).
Из приведенных примеров следует, что растворимость прежде всего зависит от природы веществ. Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему растворителя. Если растворитель соприкасается с большим количеством вещества, то через некоторое время раствор становится насыщенным.
Насыщенным называется такой раствор, который находится в динамическом равновесии с избытком растворенного вещества.
Чтобы приготовить насыщенный раствор, надо в воду при данной температуре добавлять при перемешивании вещество до тех пор, пока не образуется осадок, т. е. избыток вещества останется нерастворенным. В этом случае наступит динамическое равновесие между раствором и избытком растворяемого вещества: сколько частиц вещества будет переходить в раствор, столько их будет выделяться (кристаллизоваться) из раствора. В насыщенном растворе при данной температуре содержится максимально возможное количество растворенного вещества.
В ненасыщенном растворе содержится меньше вещества, а в пересыщенном — больше, чем в насыщенном. Пересыщенные растворы весьма неустойчивы. Легкое сотрясение сосуда или введение в раствор кристалла соли вызывает выпадение в осадок избытка растворенного вещества. Пересыщенные растворы образуют сахароза, 



Часто малорастворимые и практически нерастворимые вещества объединяют одним названием — малорастворимые. Тогда говорят только о растворимых и малорастворимых веществах.
Количественно растворимость выражается концентрацией насыщенного раствора. Чаще всего ее выражают максимальным числом граммов вещества, которое можно растворить в 100 г растворителя при данной температуре. Это количество иногда называют коэффициентом растворимости или просто растворимостью вещества. Так, например, при 18°С в 100 г воды растворяется 51,7 г соли нитрата свинца (II) 
Говоря о растворимости вещества, следует указывать температуру при растворении. Чаще всего растворимость твердых веществ с увеличением температуры возрастает. Это наглядно изображается с помощью кривых растворимости (рис. 5.2). По оси абсцисс откладывают температуру, а по оси ординат — коэффициент растворимости. Однако растворимость некоторых веществ при увеличении температуры возрастает незначительно (например, NaСl, 



С помощью кривых растворимости легко рассчитать, сколько соли выпадет из раствора при его охлаждении. Например, если взять 100 г воды и приготовить при 45°С насыщенный раствор нитрата калия, а затем его охладить до 0°С, то, как следует из кривой растворимости (рис. 5.2), должно выпасть 60 г кристаллов соли. По кривым растворимости легко определяют коэффициент растворимости веществ при разных температурах.
Выделение вещества из раствора при понижении температуры называется кристаллизацией. Если в растворе содержались примеси, то при кристаллизации вещество всегда получается чистым, так как по отношению к примесям раствор остается ненасыщенным даже при понижении температуры и примеси не выпадают в осадок. На этом основан метод очистки веществ, называемый перекристаллизацией.
При растворении газов в воде выделяется теплота. Поэтому в соответствии с принципом Ле Шателье при повышении температуры растворимость газов уменьшается, а при понижении — увеличивается (рис. 5.3). Растворимость газов увеличивается при повышении давления. Так как объем газа, растворяющийся в данном объеме воды, не зависит от давления, то растворимость газа обычно выражают в мл, растворяющихся в 100 г растворителя (рис. 5.3).
Тепловые явления при растворения
Растворение веществ сопровождается тепловым эффектом: выделением или поглощением теплоты — в зависимости от природы вещества. При растворении в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т. е. выделение теплоты, а при растворении нитрата аммония — сильное охлаждение раствора, т. е. поглощение теплоты. В первом случае осуществляется экзотермический процесс ( 



В результате химического взаимодействия растворенного вещества с растворителем образуются соединения, которые называют сольватами (или гидратами, если растворителем является вода). Образование таких соединений роднит растворы с химическими соединениями.
Великий русский химик Д. И. Менделеев создал химическую теорию растворов, которую он обосновал многочисленными экспериментальными данными, изложенными в его книге «Исследования водных растворов по их удельному весу», вышедшей в 1887 г. «Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворенным веществом»,— писал он в этой книге. Теперь известна природа этих сил. Сольваты (гидраты) образуются за счет донорно-акцепторного, ион-дипольного взаимодействий, за счет водородных связен, а также дисперсионного взаимодействия (в случае растворов родственных веществ, например бензола и толуола).
Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы (см. § 5.4); поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды.
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами, а вода, входящая в состав кристаллогидратов, называется кристаллизационной. Кристаллогидратами являются многие природные минералы. Ряд веществ (в том числе и органические) получаются в чистом виде только в форме кристаллогидратов. Д. И. Менделеев доказал существование гидратов серной кислоты, а также ряда других веществ. В химических формулах гидратов и кристаллогидратов формулу воды пишут отдельно (через точку), например 





Таким образом, растворение — не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя. Ученик Д. И. Менделеева Д. П. Коновалов всегда подчеркивал, что между химическими соединениями и растворами нет границ.
Жидкие растворы занимают промежуточное положение между химическими соединениями постоянного состава и механическими смесями. Как и химические соединения, они однородны и характеризуются тепловыми явлениями, а также часто наблюдающейся контракцией — сокращением объема при смешивании жидкостей. С другой стороны, в отличие от химических соединений растворы не подчиняются закону постоянства состава. Они, как и смеси, могут быть легко разделены на составные части. Процесс растворения есть физико-химический процесс, а растворы — физико-химические системы.
Много внимания изучению растворов уделял М. В. Ломоносов. Он провел исследования по установлению зависимости растворимости веществ от температуры, изучал выделение и поглощение теплоты при растворении и открыл охлаждающие смеси. М. В. Ломоносов впервые установил, что растворы замерзают (кристаллизуются) при более низкой температуре, чем растворитель. Он же дал молекулярно-кинетическое объяснение растворению, близкое к современному, полагая, что частицы растворенного вещества равномерно распределяются среди частиц растворителя.
Около 40 лет научной работы посвятил изучению растворов Д. И. Менделеев. Его химическая теория растворов оказалась исключительно плодотворной. На ее основе возникли новые научные дисциплины — такие, как физико-химический анализ, химия комплексных соединений, электрохимия неводных растворов. Ныне эта теория общепризнана.
Большой вклад в развитие химической теории растворов сделали известные русские ученые Д. П. Коновалов, И. А. Каблуков, Н. С. Курнаков.
Электролиты и неэлектролиты
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать е помощью простого прибора (рис. 5.4). Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Электролиты — проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
Так, хлорид натрия NaCl при растворении в воде полностью распадается на ионы натрия 



Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Теория электролитической диссоциации
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома — это простые ионы (









2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами.
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация — обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КА на катион 

Теория электролитической диссоциации является одной из основных теорий в неорганической химии и полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Механизм диссоциации
Существенным является вопрос о механизме электролитической диссоциации. В самом деле, почему электролиты диссоциируют на ионы? Учение о химической связи атомов помогает ответить на этот вопрос.
Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов (см. § 3.3). При их растворении
диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом, как показано на рис. 5.5, образуются гидротированные ионы, т. е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентнруются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами — к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гид-ратированные ионы (рис. 5.6). Диссоциация полярных молекул может быть полной или частичной.
Таким образом, электролитами являются соединения с ионной или полярной связью — соли, кислоты и основания. И диссоциировать на ноны они могут в полярных растворителях.
Гидратация ионов
Известный русский химик И. А. Каблуков показал, что электролитическую диссоциацию нельзя объяснить без химической теории растворов Д. И. Менделеева. Как известно, Д. И. Менделеев экспериментально обосновал образование химических соединении при взаимодействии растворенного вещества с растворителем. Действительно, при растворении происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы (см. рис. 5.6). Эти ионы связаны с молекулами воды, т. е. гидратированы. И. А. Каблуков полагал, что в водном растворе содержатся только гидратирован-ные ионы. В настоящее время это представление общепринято.
Итак, гидратация ионов (в общем случае сольватация — химическая связыюнов с молекулами неводного растворителя) — основная причина диссоциации. Она отчасти затрудняет их обратное соединение (ассоциацию).
Гидратированные ионы содержат как постоянное, так и переменное число молекул воды. Гидрат постоянного состава образует ион водорода 



Следует помнить, что в растворах нет иона 


Механизм возникновения прочной ковалентной связи в ионе 
Молекула воды — донор, протон — акцептор.
Однако мнения химиков разделились. Одни полагают, что в растворе существуют только ионы гидроксония 







Но обычно для простоты написания указания в скобках опускают.
Диссоциация кислот, оснований и солеи в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, HCl, 







Двух- и многоосновные кислоты диссоциируют ступенчато (постепенно). Например:
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени — по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами 



Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Основания, растворимые в воде, называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaOH, КОН, RbOH, CsOH, FrOH и 




Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, 


Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными, или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы 

Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода 

Диссоциацию амфотерного гидроксида цннка 
Солями называются электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония 
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Например:
Степень дмссоциации
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа 
Степень диссоциации — это отношение числа распавшихся на ионы молекул п к общему числу растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если 


Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т. е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые (см. ниже).
Рассмотрим смещение равновесия, устанавливающегося между недиссоциированными молекулами и ионами при электролитической диссоциации слабого электролита — уксусной кислоты:
При разбавлении раствора уксусной кислоты водой равновесие сместится в сторону образования ионов, — степень диссоциации кислоты возрастает. Наоборот, при упаривании раствора равновесие смещается в сторону образования молекул кислоты — степень диссоциации уменьшается.
Сильные и слабые электролиты
Различают сильные и слабые электролиты.
Сильные электролиты при растворении в воде полностью диссоциируют на ионы.
К ним относятся:
1) почти все соли;
2) многие минеральные кислоты, например 




3) основания щелочных и щелочноземельных металлов.
Диссоциация сильного электролита, например NaCl, обычно изображается уравнением
Как отмечалось выше, в кристалле хлорида натрия отсутствуют молекулы NaCl. При растворении кристаллическая структура разрушается, гидратированные ноны переходят в раствор. Молекулы в растворе также отсутствуют. Поэтому о недиссоциированных молекулах в растворах сильных электролитов можно говорить лишь условно. Их скорее можно представлять как ионные пары (
Однако для простоты его пишут как уравнение (а), под символом NaCl понимая ионную пару (квазимолекулу). Концентрация квазимолекул в растворе всегда очень мала, а концентрация ионов велика.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
К ним относятся;
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например 




3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также 

К слабым электролитам относится вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Реакции ионного обмена
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций — ионными уравнениями. Они проще уравнений реакций, записанных в молекулярной форме, и имеют более общий характер.
При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые (выпадающие в осадок) и газообразные записываются в молекулярной форме. Знак 

Для закрепления этих положении рассмотрим два примера.
Пример 1. Напишите уравнения реакций между растворами хлорида железа (III) и гидроксида натрия в молекулярной и ионной формах,
Разобьем решение задачи на четыре этапа.
1. Запишем уравнение реакции в молекулярной форме:
2. Перепишем это уравнение, изобразив хорошо диссоциирующие вещества в виде ионов, а уходящие из сферы реакции — в виде молекул:
Эго ионное уравнение реакции.
3. Исключим из обеих частей ионного уравнения одинаковые ионы, т. е. ионы, не участвующие в реакции (они подчеркнуты):
4. Запишем уравнение реакции в окончательном виде:
Это сокращенное ионное уравнение реакции. Как видно из этого уравнения, сущность реакции сводится к взаимодействию ионов 


Пример 2. Напишите уравнения реакций между растворами хлорида калия и нитрата натрия. Так как продукты взаимодействия хорошо растворимы в воде и не уходят из сферы реакции, то данная реакция обратима.
Как и в примере 1, записываем по этапам:
Уравнения для следующих этапов написать нельзя, так как с точки зрения теории электролитической диссоциации реакция не происходит. Однако если выпаривать этот раствор, то будут возникать новые химические связи между ионами и получится смесь четырех солей: 



Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Если при таких реакциях не происходит изменения зарядов ионов (не изменяется степень окисления), то они называются ионообменными.
Диссоциация воды. рН
Вода как слабый электролит в незначительной степени диссоциирует на ионы 

Концентрацию ионов обычно выражают в молях ионов в 1 л. Как видно из уравнения диссоциации воды, в ней величины [






Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (обозначается Кв). При определенной температуре 

Постоянство произведения [














Из постоянства произведения [






Таким образом, кислотность и щелочность раствора можно выражать через концентрацию либо ионов 






Из схемы видно, что чем меньше рН, тем больше концентрация ионов 

Приведем значения рН некоторых наиболее известных растворов и укажем соответствующую им реакцию среды: желудочный сок — рН 1,7 (сильнокислая реакция), торфяная вода — рН 4 (слабокислая), дождевая вода — рН 6 (слабокислая), водопроводная вода — рН 7,5 (слабощелочная), кровь — рН 7,4 (слабощелочная), слюна — рН 6,9 (слабокислая), слезы — рН 7 (нейтральная).
Исключительно велика роль рН в самых различных явлениях и процессах — и в природе, и в технике. Многие производственные процессы в химической, пищевой, текстильной и других отраслях промышленности протекают лишь при определенной реакции среды. Столь же необходима для нормального развития сельскохозяйственных культур и получения высоких урожаев и определенная реакция почвенного раствора. В зависимости от значения рН почвенного раствора почвы подразделяются на сильнокислые (рН 3—4), кислые (рН 4—5), слабокислые (рН 5—6), нейтральные (рН 6—7), слабощелочные (рН 7—8), щелочные (рН 8—9) и, наконец, сильнощелочные (рН 9—11).
Чаще всего растения страдают от повышенной кислотности, для устранения которой применяется известкование почв — внесение в них известняков — карбонатов кальция или магния. Если же почвы отличаются повышенной щелочностью (солонцеватые и солончаковые почвы), то для ее устранения производят гипсование — внесение размолотого гипса 
Необходимость в известковании или гипсовании почв устанавливается с учетом водородного показателя раствора (солевой вытяжки); в зависимости от величины рН устанавливается по таблицам и доза вносимых веществ.
Протолитическая теория кислот и оснований
Теория электролитической диссоциации объяснила многочисленные явления и процессы, протекающие в водных растворах электролитов. Так, например, в разных реакциях нейтрализации
одно и то же значение теплового эффекта (57,3 кДж/моль) объясняется образованием малодиссоцнированных молекул воды из 

При смешении растворов NaCI и
тепловой эффект не наблюдается. Это объясняется тем, что химического взаимодействия между ионами 



Электролитическая диссоциация явилась основой успешного развития теории растворов и изучения процессов, протекающих в них.
В этом заключается ее большое значение в химии. Однако эта теория не объясняет процессов, протекающих в неводных растворах. Так, например, если хлорид аммония в водном растворе ведет себя как соль (диссоциирует на ионы 

Согласно этой теории
кислотами являются вещества, молекулы или ионы, отщепляющие при данной реакции протоны. Основаниями являются вещества, молекулы или ионы, присоединяющие протоны. Как те, так и другие получили общее название протолитов.
Реакция отщепления протона изображается уравнением
Кислота и основание такого процесса называются сопряженными. Это кислотно-основная пара. Например, ион 


Свободные протоны в растворах самостоятельно не существуют. Они переходят от кислоты к какому-либо основанию. Поэтому в растворе всегда протекают два процесса:
и равновесие между ними изображают уравнением
Например, реакцию нейтрализации уксусной кислоты аммиаком можно представить так:
Здесь уксусная кислота является кислотой (отдает протоны 


Аналогично можно изобразить проявление основных свойств азотной кислоты, растворенной в жидком фтороводороде:
Таким образом, из кислоты и основания всегда получаются новые сопряженные кислота и основание. Протолитическая теория рассматривает реакцию нейтрализации как переход протона кислоты к основанию.
Как видно, протолитическая теория расширила круг кислот и оснований по сравнению с представлениями теории электролитической диссоциации: ими могут быть и ионы. Одно и то же вещество в зависимости от того, с чем оно реагирует, может быть или кислотой, или основанием. Теория вскрыла относительность понятий о кислотах и основаниях и показала, что продукты их взаимодействия следует рассматривать как новые кислоты и основания. Протолитическая теория является современной и более общей теорией кислот и оснований.
Раствором называют жидкую или твердую гомогенную систему, состоящую из двух или большего числа исходных веществ (компонентов), относительное содержание которых в системе может изменяться в широких пределах.
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 1Скачать

Растворы и растворимость
Растворимостью называют способность вещества образовывать растворы — одни вещества могут растворяться друг в друге неограниченно; другие — только в ограниченных количествах или же практически не растворяться вообще. Растворимость конкретного вещества зависит от его природы и природы растворителя, а также условий, при которых происходит процесс растворения: температура, давление, наличие третьих веществ.
Растворение веществ в воде
Вода – основная биологическая жидкость, инертный растворитель для многих органических и неорганических веществ. Вода необходима для всех живых организмов (рис. 49). Поваренная соль (NaCl) хорошо растворяется в воде (рис. 50).
Способность веществ переходить в раствор называется растворимостью. На растворимость веществ влияют различные факторы.
Растворимость многих твердых веществ увеличивается при повышении температуры. Для газообразных веществ растворимость повышается с увеличением давления и уменьшается с повышением температуры. Растворимость жидких веществ зависит от их химической природы. Спирт и серная кислота неограниченно растворяются в воде, бензин и растительное масло с ней даже не смешиваются.
Любая природная вода является раствором. Воды Каспийского моря содержат 13 г/л, Черного – 19 г/л, Мертвого – 260 г/л различных солей. Содержание солей в Мертвом море очень велико, поэтому в нем нет жизни. Морская вода является многокомпонентным раствором, так как в ней растворены различные вещества.
Раствор – это однородная система, образованная несколькими веществами, между которыми происходят физические и химические взаимодействия.
Компоненты – это вещества, которые образуют раствор. Один из компонентов раствора – растворитель, другой – растворенное вещество (рис. 51).
При растворении веществ образуются насыщенные, ненасыщенные и перенасыщенные растворы. Раствор, который содержит максимальное количество растворенного вещества при данной температуре, называется насыщенным. В ненасыщенном растворе растворенного вещества содержится меньше, чем в насыщенном при данной температуре. А в перенасыщенном растворе растворенного вещества содержится больше, чем в насыщенном при данной температуре. Количественной характеристикой растворимости является коэффициент растворимости.
Коэффициент растворимости (S) показывает, какая максимальная масса вещества
может раствориться в 100 г (1000 г) воды при данной температуре (рис. 52). Растворимость
в воде выражается в граммах вещества на 100 или 1000 г воды (г/100 г 
Лабораторный опыт № 5
«Изучение растворимости веществ».
Цель: исследовать растворимость различных веществ в воде.
Ход работы
1. В три химических стакана налейте с помощью цилиндра определенный объем дистиллированной воды.
2. Испытайте растворимость трех веществ: 
Вопросы и задания
1. Сравните свои наблюдения по растворимости с табличными данными в конце учебника.
2. Влияние какого фактора на растворимость вы исследовали на данном опыте?
Практическая работа №4
Влияние температуры на растворимость твердых веществ
Цель: уметь рассчитывать растворимость вещества на 100 г воды, используя технику выпаривания, сравнивать полученные результаты со справочными данными.
Ход работы
1. Взвесьте на технических весах 10 г 
2. Налейте 20 мл дистиллированной воды в стакан, насыпьте соль, измерьте температуру.
3. Поставьте на асбестированную сетку и нагрейте до полного растворения, измерьте температуру.
4. Привяжите на стеклянную палочку нить и подвесьте над стаканом и охладите до комнатной температуры. Следите, чтобы нить висела вертикально посередине стакана.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Решение задач на тему: растворимость веществ
Обычно мы пользуемся водными растворами. Плотность воды 1 г/мл, поэтому масса воды численно равна объему.
Определение масс растворенного вещества и растворителя для приготовления насыщенного раствора при определенной температуре
Сколько граммов нитрата калия и воды потребуется для приготовления 500 г насыщенного раствора при температуре 30°C, если растворимость при этой температуре равна 45 г?
Расчет масс растворяемого вещества и  для приготовления насыщенного раствора по известной массе растворителя
для приготовления насыщенного раствора по известной массе растворителя
Сколько граммов нитрата свинца 


Расчет массы растворителя, необходимого для растворения определенной массы вещества при определенной температуре
Сколько воды потребуется для растворения 500 г нитрата калия 


Определение растворимости вещества выпариванием
При какой температуре раствор становится насыщенным, если выпарено 50 г воды из 500 г насыщенного раствора нитрата натрия при температуре 40°С ( 

Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Массовая доля растворенного вещества
Для обозначения соотношения растворенного вещества и растворителя в растворе используется понятие «концентрация».
Концентрация — это величина, определяемая количеством или массой растворенного вещества в единице объема или массы раствора.
Рассмотрим массовую долю растворенного вещества, или процентную концентрацию. В зависимости от количества растворенного вещества растворы подразделяются на
разбавленные и концентрированные. Концентрация веществ выражается массовой долей растворенного вещества в растворе и молярной концентрацией. Вначале рассмотрим процентную концентрацию или массовую долю растворенного вещества в растворе.
В разбавленных растворах количество вещества меньше, чем в насыщенных растворах, а в концентрированных – больше. Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора. Она обозначается греческой буквой 
Если взять определенный объем раствора, то его массу можно выразить следующим образом:
где 
Тогда
Плотность раствора определяют с помощью ареометра (рис. 55, 56).
По этой формуле можно определить следующие величины:
Задача 1. Какова процентная концентрация раствора, если известно, что 20 г вещества содержится в 90 г раствора?
Задача 2. Определите процентную концентрацию раствора, полученного при растворении 45 г соли в 2200 мл воды 
Видео:Как пользоваться таблицей растворимости. Как ее можно применятьСкачать

Молярная концентрация вещества в растворе
Второй способ выражения концентрации – молярная концентрация.
Молярной концентрацией раствора (С) называется число молей растворенного вещества в одном литре раствора.
Преобразуя эту формулу, получим следующую формулу:
Молярная концентрация более точна, чем массовая доля растворенного вещества.
Растворы веществ с определенной молярной концентрацией готовят в специальной посуде (мерных колбах).
По формуле можно определить следующие величины:
Расчет молярной концентрации раствора
Задача 1. Рассчитать молярную концентрацию раствора гидроксида натрия, если 0,8 г вещества растворено в 100 мл раствора.
Задача 2. Определите молярную концентрацию, если 5,3 г карбоната натрия содержится в растворе объемом 0,5 л.
Расчет массы вещества, необходимой для приготовления раствора
Задача 3. Сколько граммов гидроксида калия потребуется для приготовления 250 мл раствора концентрацией 0,1 моль/л?
Практическая работа №5
Приготовление растворов с заданной процентной и молярной концентрацией
Опыт 1
Задание
Приготовить 150 г 5%-ного раствора сахара.
Ход работы
1. Вычислите, какая масса сахара потребуется для приготовления данного раствора.
2. Взвесьте эту массу на технических весах в предварительно взвешенном на технических весах стаканчике.
3. Рассчитайте объем воды для растворения взятой навески.
4. Отмерьте мерным цилиндром этот объем воды.
5. Вылейте воду в стакан, растворите в ней сахар, перемешивая раствор стеклянной палочкой.
Опыт 2
Задание
Приготовить 250 мл 0,25 молярного раствора поваренной соли.
Ход работы
1. Рассчитайте, какая масса поваренной соли потребуется для приготовления 250 мл 0,25 молярного раствора соли.
2. На предварительно взвешенном часовом стекле взвесьте рассчитанную в п. 1 массу соли на электронных весах.
3. Взятую взвешанную массу соли всыпьте через воронку в мерную колбу емкостью 250 мл и тщательно смойте дистиллированной водой с воронки оставшуюся на ней соль.
4. Долейте в колбу воду до метки, закройте пробкой и хорошо перемешайте.
5. Вылейте раствор в сухой цилиндр (узкий) и определите плотность.
Вопросы и задания
1. Какая концентрация более точная? Почему?
2. Как вы считаете, может ли плотность водного раствора быть меньше плотности воды?
Типовые задачи по теме «Концентрация растворов»
Видео:8 класс. Составление уравнений химических реакций.Скачать

Массовые доли растворенного вещества
Массовая доля растворенного вещества – это отношение массы растворенного вещества m1 к общей массе раствора m, выраженное в процентах. Пример 1. Для лечения гипертонической болезни (повышенное давление) применяют 25%-ный раствор сульфата магния MgSO 4 . Это означает, что в 100 г такого раствора содержится 25 г MgSO 4 . Здесь выделено слово “раствора”.
Расчет массы вещества и массы растворителя, необходимых для приготовления раствора определенной концентрации
Сколько граммов соли и воды потребуется для приготовления 300 г 35%-ного раствора?
Расчет массы (объема) раствора по известной концентрации раствора и по массе растворенного вещества
Какой объем 14,3%-ного раствора можно приготовить из 30 г сульфата натрия? 
Расчет массы растворенного вещества по известной массе растворителя и концентрации раствора
Сколько вещества нужно растворить в 250 мл воды для приготовления раствора с концентрацией 12%?
Расчет объема раствора
Какой объем 0,3 молярного раствора гидроксида натрия можно приготовить из 3 г этого вещества?
Пересчет процентной концентрации раствора на молярную
Определите молярную концентрацию 40%-ного раствора серной кислоты плотностью 1,307 г/мл.
Расчет объема раствора процентной концентрации для приготовления раствора молярной концентрации
Рассчитать объем 20%-ного раствора соляной кислоты (r = 1,1 г/мл) необходимый для приготовления 0,5 литров раствора концентрацией 0,1 моль/л.
Расчётные задачи по уравнениям реакций с использованием концентрации раствора
Раствор – смесь, состоящая по крайней мере из двух компонентов – растворенное вещество, растворитель. Поэтому при решении задач по уравнению реакции необходимо рассчитать массу чистого вещества в растворе.
Задача 1
Рассчитать объем (н. у.) и количество вещества водорода по реакции взаимодействия цинка с 12%-ным раствором серной кислоты (r = 1,083 г/мл) объемом 50 мл.
Задача 2
Рассчитать объем раствора гидроксида натрия с концентрацией 0,25 моль/л, необходимого для нейтрализации 20%-ной (r = 1,12 г/мл) азотной кислоты объемом 25 мл. Сколько нитрата натрия образуется?
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Способы изменения концентрации раствора
Существует несколько способов изменения концентрации раствора:
смешение двух растворов с известными концентрациями, разбавление или сгущение путем выпаривания и добавления растворенного вещества.
Определение концентрации раствора, полученного смешением двух растворов с известными концентрациями
Какова концентрация раствора, полученного смешением 400 г 10%-ного и 300 г 25%-ного растворов?

m (3) = m (1) + m (2) =400 + 300 = 700 г

m (общ.) = m (1) + m (2) = 40 + 75 =115 г

Определение концентрации раствора после разбавления
В лабораториях растворы нужной концентрации готовят путем разбавления концентрированных растворов.
К 500 г 15%-ного раствора соли добавили 200 г воды. Опре делите процентную концентрацию полученного раствора.


Определение концентрации после увеличения массы растворенного вещества в растворе
Концентрацию раствора можно повысить двумя способами:
1) добавлением растворенного вещества;
2) испарением части растворителя
а) Определите концентрацию раствора после добавления 30 г вещества к 250 г 5%-ного раствора.


растворе:
б) Определите процентную концентрацию раствора после испарения 200 г воды из 700 г 15%-ного раствора.


- 1. Растворы — однородные системы, состоящие из растворенного вещества и растворителя.
- 2. Вещества характеризуются растворимостью.
- 3. Растворимость зависит от агрегатного состояния вещества, температуры и давления (для газообразных веществ).
- 4. Концентрация растворов выражается массовой долей растворенного вещества и молярной концентрацией.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:Растворы и осадки (видео 1)| Произведение Растворимости | ХимияСкачать
Химическая реакция растворения
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Растворение — что это за процесс
Растворы — однородные (гомогенные) системы, в состав которых входят: растворенные вещества, растворитель и (возможно) продукты химической реакции, протекающей между ними.
Особенностью растворенного вещества является равномерное распределение в объеме вещества, которое играет роль растворителя. Для раствора характерно содержание двух и более компонентов.
- жидкие;
- твердые;
- газообразные.
Определение
Растворитель представляет собой вещество, сохраняющее стабильность агрегатного состояния в процессе растворения.
Когда смешивают вещества с идентичными агрегатными состояниями, к примеру, жидкость с жидкостью, газ с газом, твердый материал с твердым, роль растворителя играет компонент с большим содержанием. Процесс, при котором образуется раствор, определяется особенностью взаимодействия частиц растворителя с частицами растворенного вещества и их природой.
Растворение является физико-химическим процессом, в котором можно наблюдать взаимодействие частиц между собой, что приводит к образованию раствора.
Растворение представляет собой результат взаимодействия молекул вещества, играющего роль растворителя, с частицами растворенного вещества. При растворении твердых веществ наблюдают увеличение энтропии. В процессе растворения газообразных веществ энтропия уменьшается. Растворение сопровождается исчезновением межфазной границы, изменением физических свойств раствора, в том числе плотности, вязкости, в некоторых случаях, окраски.
Когда растворитель и растворенное вещество участвуют в химическом взаимодействии, можно наблюдать изменение химических свойств раствора. В качестве примера можно привести растворение газа хлороводорода в воде, результатом которого является образование жидкой соляной кислоты.
Теплота растворения зависит от природы компонентов раствора.
Например: если растворяются кристаллические вещества с растворимостью, увеличивающейся при повышении температуры, то раствор охлаждается. Это объясняется тем, что раствор обладает большей внутренней энергией по сравнению с аналогичными характеристиками кристаллического вещества и растворителя, взятых по отдельности. Как пример, можно рассмотреть кипяток, в котором происходит растворение сахара. В результате раствор значительно охлаждается.
Видео:Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Основные этапы: физическая и химическая стадия
Этапы растворения кристаллических веществ в водной среде:
- Кристаллическая решетка разрушается, что является физической стороной процесса. В результате поглощается теплота, то есть ∆ Н 1 > 0 .
- Частицы вещества взаимодействуют с молекулами растворителя, что соответствует химической стороне процесса. В итоге выделяется теплота, то есть ∆ Н 2 0 .
- Суммарный тепловой эффект: ∆ Н = ∆ Н 1 + ∆ Н 2
Классификация растворов в зависимости от механизма растворения:
- физические;
- химические.
Определение
Физическим растворением называют процесс разрыва и образования лишь межмолекулярных связей, в том числе, водородных.
Физическое растворение можно наблюдать только в случае определенных веществ, выполняющих роль растворителя и растворенного вещества, не вступающих в химические реакции между собой. К примеру, нафталин растворяется в спирте.
Химическое растворение является видом растворения, которое предполагает разрушение исходных химических связей в процессе химического превращения.
Например: химическое растворение протекает при электрической диссоциации растворяемого вещества.
При растворении имеет место следующая закономерность: подобное хорошо растворяется в подобном. Так, в неполярных растворителях хорошо растворяются неполярные вещества. Полярными растворителями целесообразно растворять полярные вещества. Благодаря исследованиям механизмов растворения, природы растворяемых веществ и растворителей, определяют степень растворимости одного вещества в другом.
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Признаки химического взаимодействия при растворении
Физические признаки растворения выражаются в виде диффузии. Процесс заключается в распределении частиц растворенного вещества между молекулами вещества, которое является растворителем. В результате «качества» растворенного вещества проявляются в растворе.
- Сахар растворяется в воде. Раствор приобретает сладкий вкус.
- Краситель растворяется в воде. В результате раствор приобретает определенную окраску.
Признаками химических явлений являются:
- теплота выделяется, либо поглощается;
- окраска некоторых соединений меняется в процессе образования растворов.
Когда концентрированная серная кислота растворяется в водной среде, температура раствора значительно повышается. Данное явление нашло практическое применение в «химических грелках».
Процесс растворения нитрата аммония в воде сопровождается сильным поглощением теплоты, что объясняет охлаждение раствора. На данном эффекте основан принцип действия гипотермического пакета, который входит в состав автомобильной аптечки для оказания первой медицинской помощи.
Безводный сульфат меди (II) обладает белой окраской. Когда вещество растворяют в воде, раствор окрашивается в голубой цвет.
В современной науке имеет место теория, объединяющая две точки зрения. Ее называют физико-химической теорией растворов. Предпосылки к данной теории были сформулированы еще в 1906 году Д.И. Менделеевым в учебнике «Основы химии».
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Факторы растворимости веществ
Растворимость представляет собой свойство вещества растворяться в каком-либо растворителе.
Мера растворимости при заданных условиях определена содержанием данного вещества в насыщенном растворе. Существует условная классификация веществ в зависимости от их способности растворяться:
- малорастворимые (от 0,001 до 1 грамма растворенного вещества на 100 грамм растворителя);
- растворимые (больше 1 г растворенного вещества на 100 г растворителя);
- нерастворимые (менее 0,001 г растворенного вещества на 100 г растворителя).
Когда вещество контактирует с водной средой, можно получить следующий результат:
- Вещество растворяется в воде, то есть происходит перемешивание на атомно-молекулярном уровне.
- Химическая реакция.
- Отсутствие растворения, химическая реакция не наблюдается.
Определение
Коэффициент растворимости определяется, как отношение массы растворенного вещества к массе растворителя (к примеру, 10 г соли на 100 г воды).
В зависимости от того, какой концентрацией обладает растворенное вещество, растворы условно разделяют на:
- ненасыщенные;
- насыщенные;
- перенасыщенные.
Определение
Ненасыщенные растворы — это те, в которых концентрация растворенного вещества меньше по сравнению с концентрацией в соответствующем насыщенном растворе. Особенность ненасыщенного раствора заключается в возможности при заданных условиях растворить в нем еще определенное количество растворенного вещества.
Насыщенные растворы представляют собой растворы с максимальной концентрацией растворенного вещества при заданных условиях.
В некоторых случаях нет необходимости создавать специальные условия для приготовления насыщенного раствора. Эксперимент можно поставить в домашних условиях.
При смешивании поваренной соли с водой образуется раствор. Когда смесь становится насыщенной, поваренная соль перестает растворяться в воде, так как достигнута ее максимальная концентрация.
Перенасыщенным раствором называют такой раствор, в котором растворенное вещество находится в концентрации, превышающей его концентрацию в насыщенном растворе.
Излишки растворенного вещества достаточно просто выпадают в виде осадка. Для получения перенасыщенного раствора можно, к примеру, охладить насыщенный раствор, компонентами которого являются поваренная соль и вода. В том случае, когда температура снижается, уменьшается растворимость поваренной соли. В результате получают перенасыщенный раствор.
В зависимости от концентрации растворенного вещества растворы бывают:
- концентрированные;
- разбавленные.
Определение
Концентрированные растворы являются растворами, для которых характерно относительно высокое содержание растворенного вещества.
Разбавленные растворы представляют собой растворы, в которых растворенное вещество характеризуется относительно низким содержанием.
Подобная классификация является условной и не зависит от деления раствора по насыщенности. Разбавленный раствор может являться насыщенным. Концентрированный раствор не во всех случаях можно отнести к насыщенным растворам.
Растворимость ( Р , χ и л и k s ) характеризует насыщенный раствор и определяет максимальную массу растворенного вещества, которое растворяется в 100 г растворителя. Размерность растворимости составляет г/ 100 г воды.
χ = m р . в . m р — л я * 100
где m р.в. определяет массу растворенного вещества, г;
m р-ля является массой растворителя, г.
В некоторых случаях допустимо обозначать коэффициент растворимости k s . Показатели растворимости вещества, которое взаимодействует с разными растворителями, могут изменяться в широком диапазоне значений.
Растворимость некоторых веществ в воде при температуре 20 °C:
Растворимость веществ зависит от нескольких факторов:
- природа растворенного вещества и растворителя;
- температура;
- давление;
- посторонние вещества.
Абсолютно нерастворимых веществ не существует. Все вещества лишь условно классифицируют на растворимые, малорастворимые и нерастворимые. Даже такие материалы, как серебро и золото, частично растворяются в воде. С другой стороны, растворимость этих металлов столь мала, что ей допустимо пренебречь.
Растворимость, которой характеризуются твердые вещества, определяется структурой этих веществ, то есть типом кристаллической решетки. К примеру, вещества с металлическими кристаллическими решетками, в том числе железо и медь, отличаются малой растворимостью в воде. Вещества, для которых характерна ионная кристаллическая решетка, обычно хорошо растворяются в воде.
Подобное хорошо растворяется в подобном.
Согласно озвученному правилу, вещества, обладающие связями ионного или ковалентного полярного типа, хорошо растворяются в полярных растворителях. В качестве примера можно привести соли, которые характеризуются хорошей растворимостью в воде. С другой стороны, неполярные вещества в распространенных случаях способны хорошо растворяться в неполярных растворителях.
В большинстве своем соли щелочных металлов и аммония хорошо растворяются в водной среде. Высокой степенью растворимости характеризуются практически все нитраты, нитриты, многие галогениды, за исключением галогенидов серебра, ртути, свинца, таллия, и сульфаты, кроме сульфатов щелочноземельных металлов, серебра и свинца. Сульфиды, фосфаты, карбонаты, некоторые другие соли переходных металлов обладают небольшими показателями растворимости.
Растворимость газообразных веществ в жидких средах определяется их природой. К примеру, в 100 объемах воды при температуре 20 °C можно растворить 2 объема водорода, 3 объема кислорода. При аналогичных условиях в 1 доле воды можно растворить 700 объемов аммиака.
Процесс растворения газообразных веществ в воде, как результат гидратации молекул растворяемого газа, протекает с выделением теплоты. В связи с этим, когда температура повышается, растворимость газообразных веществ снижается.
Температурный режим неодинаково влияет на способность твердых веществ растворяться в воде. В распространенных случаях можно наблюдать повышение растворимости при нагреве твердых веществ.
В качестве примера можно рассмотреть увеличение растворимости таких веществ, как нитрат натрия N a N O 3 и нитрат калия К N O 3 , при повышении температуры. При этом растворение сопровождается поглощением теплоты. Растворимость N a C l в процессе нагрева повышается несущественно, что объясняется практически нулевым тепловым эффектом растворения поваренной соли.
Растворимость твердых и жидких веществ в жидких средах почти не меняется при перепадах давления. Это связано с незначительным изменением объема в процессе растворения. Когда в жидкости растворяют газы, объем системы уменьшается. В связи с этим, при повышении давления увеличивается растворимость газообразных веществ. Общий вид зависимости растворимости газов от давления описан законом У. Генри (Англия, 1803 г.).
Закон У. Генри: растворимость газа при стабильной температуре прямо пропорциональна его давлению над жидкостью.
Рассмотренная закономерность справедлива для небольших давлений в случае газообразных веществ со сравнительно небольшой растворимостью и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителя.
В том случае, когда вода содержит примеси других веществ, например, соли, кислоты и щелочи, газы хуже растворяются в такой среде. Газообразный хлор характеризуется растворимостью в насыщенном водном растворе поваренной соли, которая в 10 раз меньше по сравнению с аналогичным показателем в чистой воде.
Эффект, предполагающий снижение растворимости в присутствии солей, называют высаливанием. Ухудшение свойств растворимости связано с гидратацией солей, которая является причиной уменьшения количества свободных молекул воды. Молекулы воды, образовавшие связи с ионами электролита, не являются растворителем для каких-либо веществ.
Примеры растворения твердых веществ в воде
Данные о растворимости веществ необходимы для решения многих задач по химии, связанных с записью уравнений реакций. Таблица растворимости содержит информацию о зарядах веществ, которую используют для корректной записи реагентов и схем химического взаимодействия. По растворимости в воде определяют способность соли или основания диссоциировать.
Водные соединения, проводящие ток, являются сильными электролитами. Существует и другой тип веществ, которые отличаются тем, что плохо проводят ток. Такие соединения являются слабыми электролитами. Сильные электролиты представляет собой вещества, практически полностью ионизирующиеся в воде. В отличие от них, слабые электролиты проявляют это свойство лишь в малой степени.
Существует несколько видов уравнений:
- молекулярные;
- полные ионные;
- краткие ионные.
Краткие ионные уравнения являются сокращенным вариантом полных ионных уравнений. В полном уравнении принято записывать все ионы из которых состоят реагенты и продукты реакции.
В виде отдельных ионов можно записывать только сильные электролиты.
Затем, сократив одинаковые ионы, присутствующие в обоих частях химического уравнения, получают уравнение в кратком виде.
В молекулярных уравнениях все, без исключения, вещества записаны в молекулярном виде.

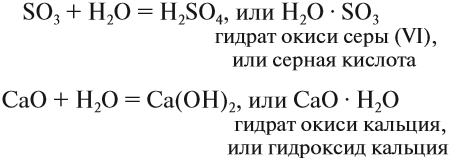
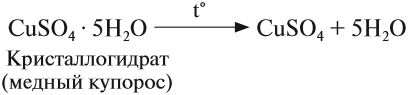
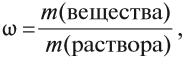

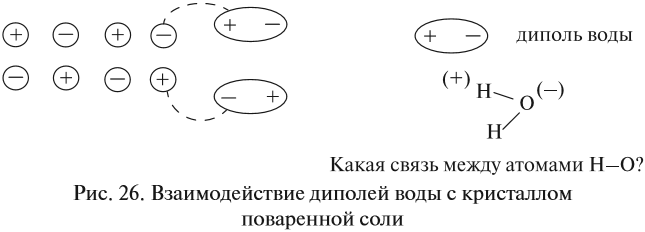
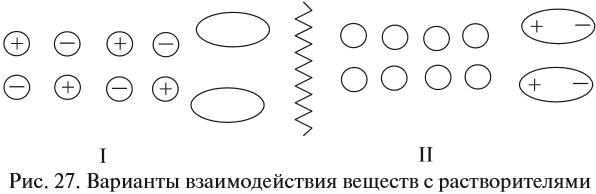
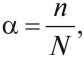
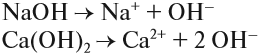
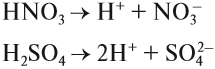
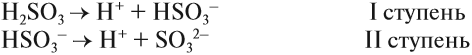
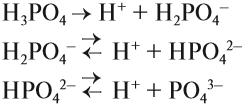

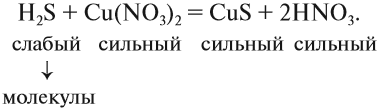
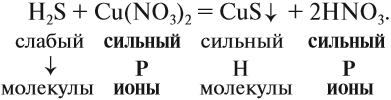
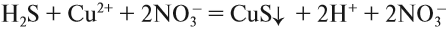
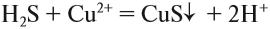
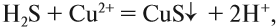
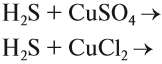
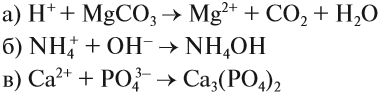

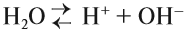
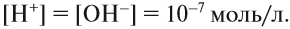
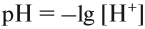
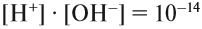
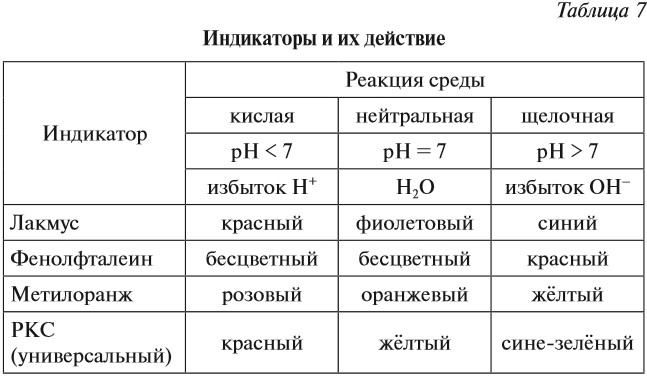
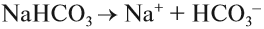
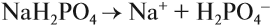
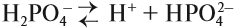

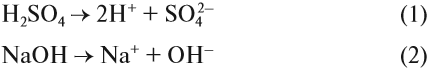
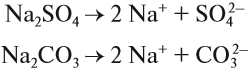
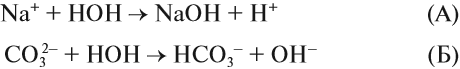

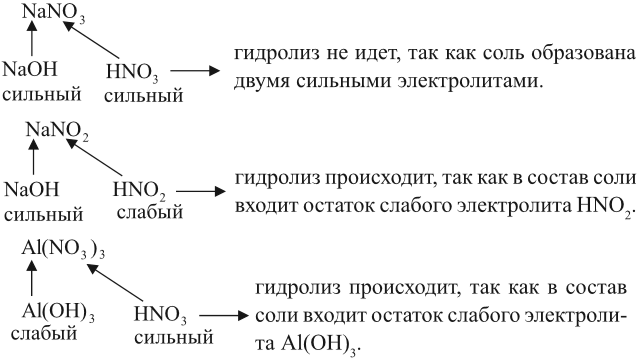
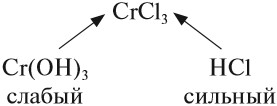
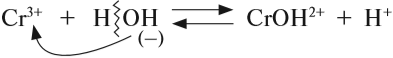
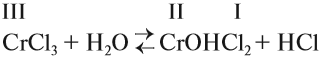
























































 для приготовления насыщенного раствора по известной массе растворителя
для приготовления насыщенного раствора по известной массе растворителя


































































