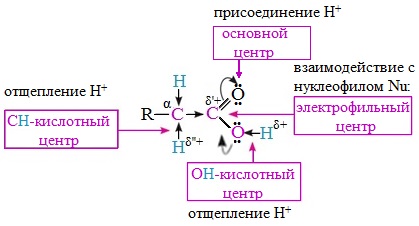
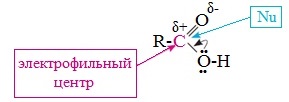
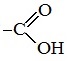
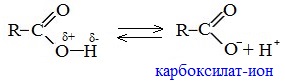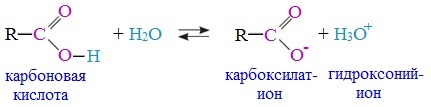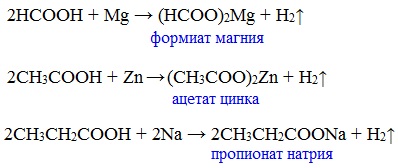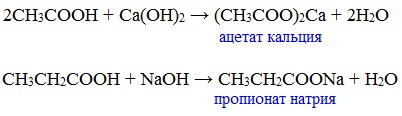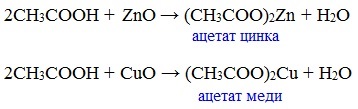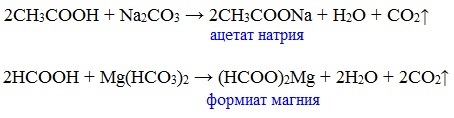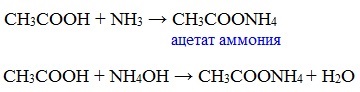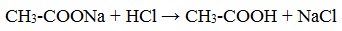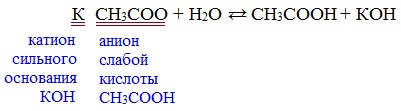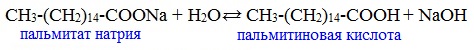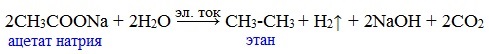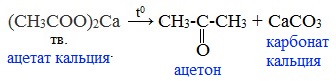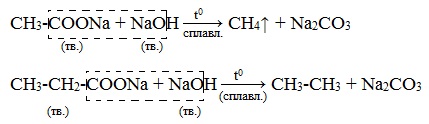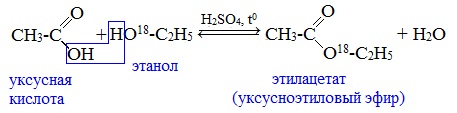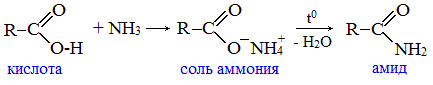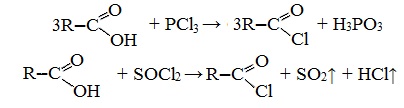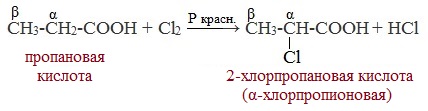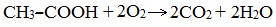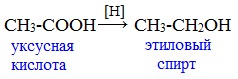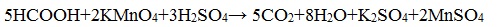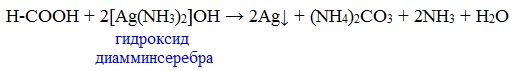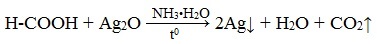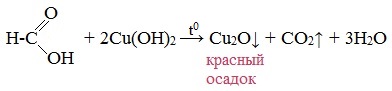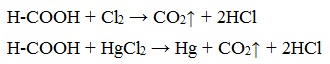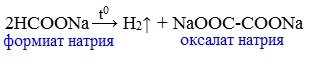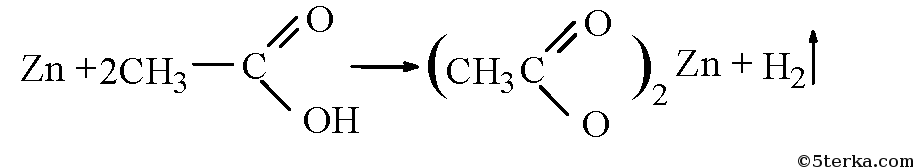Для насыщенных монокарбоновых кислот характерна высокая реакционная способность. Она определяется в основном наличием в их структуре карбоксильной группы.
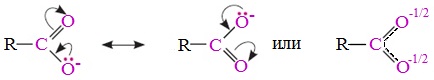
Карбоксильная группа представляет собой сопряженную систему, в которой неподеленная пара электронов атома кислорода гидроксильной группы вступает в сопряжение с π-электронами карбонильной группы (р,π-сопряжение). Вследствие +М-эффекта со стороны группы –ОН электронная плотность в сопряженной системе смещена в сторону атома кислорода карбонильной группы 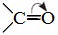
Но в то же время за счет +М-эффекта со стороны группы –ОН в молекулах карбоновых кислот в некоторой степени уменьшается частичный положительный заряд (δ+) на атоме углерода карбонильной группы по сравнению с альдегидами и кетонами.
Кроме того, вследствие –I-эффекта карбоксильной группы в молекуле карбоновой кислоты происходит смещение электронной плотности с углеводородного остатка, что приводит к появлению СН-кислотного центра у α-углеродного атома.
Исходя из строения, в молекулах карбоновых кислот можно выделить реакционные центры, определяющие возможные реакции с их участием.
1. Кислотные свойства кабоновых кислот проявляются в реакциях с основаниями за счет ОН-кислотного центра.
2. С участием электрофильного центра (атома углерода карбоксильной группы) происходят реакции нуклеофильного замещения в карбоновых кислотах и их функциональных производных.
3. Основный центр – карбонильная группа (оксогруппа) со своей электронной парой – протонируется на стадии катализа в реакциях нуклеофильного замещения.
4. СН-кислотный центр определяет возможность замещения атома водорода в алкильном радикале и реакции конденсации.
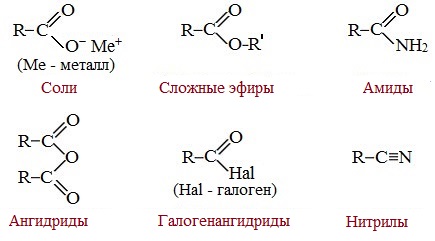
Карбоновые кислоты вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
- I. Реакции с разрывом связи О-Н
- Свойства солей карбоновых кислот
- II. Реакции с разрывом связи C-О
- III. Реакции с разрывом связи C-Н у ɑ-углеродного атома
- V.Реакции каталитического восстановления
- Особенности строения и свойства муравьиной кислоты
- Практическая работа по теме «Карбоновые кислоты»
- Опыт 2 . Растворимость карбоновых кислот в воде
- Опыт 3 . Взаимодействие уксусной кислоты с металлами
- Опыт 4 . Получение сложного эфира
- Практическая работа № 5. Карбоновые кислоты
- Опыт 1. Растворимость карбоновых кислот в воде
- Опыт 2. Взаимодействие уксусной кислоты с металлами
- Опыт 3. Получение сложного эфира
- 🌟 Видео
I. Реакции с разрывом связи О-Н
(кислотные свойства карбоновых кислот обусловлены подвижностью атома водорода карбоксильной группы и их способностью отщеплять его в виде протона)
Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот.
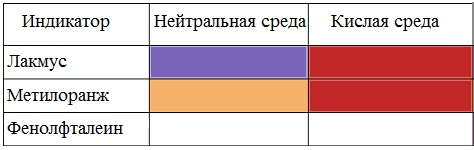
Карбоновые кислоты изменяют окраску индикаторов.
1. Диссоциация
В водных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: они диссоциируют с образованием протона (Н + ) и кислотного остатка (карбоксилат-иона):
Уравнение реакции, учитывающее участие молекулы воды:
Растворы карбоновых кислот изменяют окраску индикаторов, имеют кислый вкус, проводят электрический ток.
В карбоксилат-ионе оба атома кислорода равноценны, а отрицательный заряд равномерно делокализован (рассредоточен) между ними.
В результате делокализации отрицательного заряда карбоксилат-ион обладает высокой устойчивостью. Сила кислоты определяется устойчивостью образующегося аниона, поэтому карбоновые кислоты превосходят по кислотным свойствам спирты и фенолы, где возможность делокализации заряда в анионе меньшая.
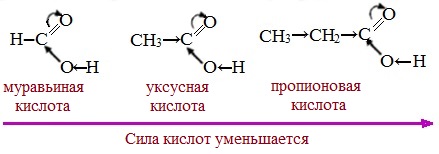
Тем не менее, монокарбоновые кислоты являются слабыми кислотами. Наиболее сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа –СООН связана с атомом водорода.
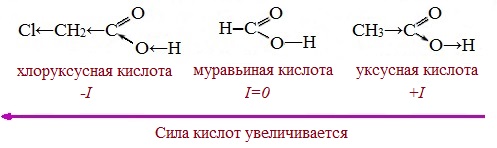
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индукционного эффекта.
Алкильные радикалы, связанные с карбоксильной группой, обладают положительным индукционным эффектом (+І). Они отталкивают от себя электронную плотность, тем самым уменьшая частичный положительный заряд (δ+) на атоме углерода карбоксильной группы. Положительный индукционный эффект возрастает по мере увеличения длины углеводородного радикала, что в свою очередь ослабляет полярность связи О-Н. Алкильные группы понижают кислотность.
В гомологическом ряду предельных монокарбоновых кислот кислотные свойства уменьшаются от муравьиной кислоты к высшим карбоновым кислотам.
Такие заместители, как хлор или фенильный радикал, оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индукционный эффект (— I). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты.
Карбоновые кислоты – слабые электролиты. Равновесие процесса диссоциации сильно смещено влево, об этом свидетельствует тот факт, что даже сильноразбавленные водные растворы кислот имеют резкий запах.
Видеоопыт «Растворимость в воде различных карбоновых кислот»
Видеоопыт «Карбоновые кислоты — слабые электролиты»
2. Образование солей
Карбоновые кислоты проявляют все свойства минеральных кислот. Карбоновые кислоты при взаимодействии с активными металлами, основными оксидами, основаниями и солями слабых кислот образую соли.
а) взаимодействие с активными металлами
Цинк и уксусная кислота
Карбоновые кислоты реагируют с металлами, стоящими в ряду напряжений до водорода.
Видеоопыт «Взаимодействие уксусной кислоты с металлами»
б) взаимодействие c основаниями (реакция нейтрализации)
Видеоопыт «Взаимодействие уксусной кислоты с раствором щелочи»
в) взаимодействие с основными и амофтерными оксидами
Оксид меди(II) и уксусная кислота
Видеоопыт «Взаимодействие уксусной кислоты с оксидом меди (II)»
г) взаимодействие с солями более слабых кислот
Видеоопыт «Взаимодействие уксусной кислоты с карбонатом натрия»
д) взаимодействие с аммиаком или гидроксидом аммония
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
Видеоопыт «Свойства карбоновых кислот»
Свойства солей карбоновых кислот
1) Взаимодействие с сильными кислотами
Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.
Из неорганических кислот лишь угольная кислота слабее рассматриваемых кислот и может вытесняться ими из её солей — карбонатов и гидрокарбонатов.
Качественная реакция на ацетат-ион СН3СОО — ! Запах уксусной кислоты.
2) Гидролиз по аниону
Натриевыс и калиевые соли карбоновых кислот в водных растворах находятся частично в гидролизованном состояния.
Этим объясняется щелочная реакция мыльного раствора.
Видеоопыт «Гидролиз ацетата натрия»
3) Электролиз солей активных металлов (реакция Кольбе)
Одним из применений солей карбоновых кислот является электролиз их водных растворов, в результате которого образуются насыщенные углеводороды:
Электролизом раствора соли карбоновой кислоты можно получить алкан с удлиненной цепью.
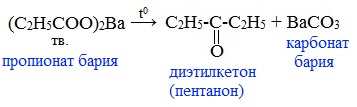
4) Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны:
4) Декарбоксилирование солей щелочных металлов (реакция Дюма)
В процессе сплавления солей карбоновых кислот с твердой щелочью происходит расщепление углеродной связи и образуются алканы с числом атомов углерода на один меньше, чем у исходной кислоты:
II. Реакции с разрывом связи C-О
Пониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы –ОН с образованием функциональных производных карбоновых кислот (сложных эфиров, амидов, ангидридов и галогенангидридов).
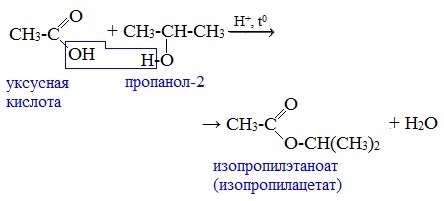
1. Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации)
Карбоновые кислоты при нагревании в присутствии кислотного катализатора реагируют со спиртами, образуя сложные эфиры:
Механизм этой реакции был установлен методом меченых атомов. С этой целью использовали спирт, меченный изотопом кислорода 18 О. После реакции изотоп кислорода был обнаружен в молекуле сложного эфира.
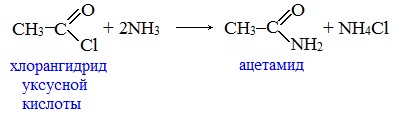
2. Взаимодействие с аммиаком с образованием амидов
Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли, которую затем нагревают:
Вместо карбоновых кислот чаще используют их галогенангидриды:
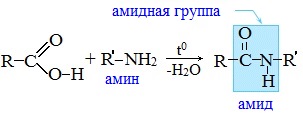
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из α-аминокислот с участием амидных групп — пептидных связей.
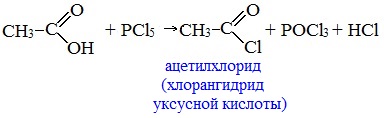
3. Взаимодействие с галогенидами фосфора или тионилхлоридом с образованием галогенангидридов карбоновых кислот
Наибольшее значение имеют хлорангидриды. Хлорирующие реагенты –галогениды фосфора PCl3, PCl5, тионилхлорид SOCl2.
Для получения хлорангидридов чаще используют тионилхлорид, так как в этом случае образуются газообразные побочные продукты.
Галогенангидриды карбоновых кислот — весьма реакционноспособные вещества, широко применяемые в органическом синтезе.
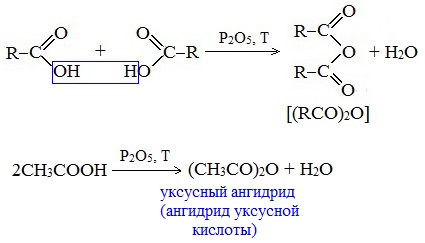
4. Образование ангидридов кислот (межмолекулярная дегидратация)
Ангидриды кислот образуются в результате межмолекулярной дегидратации кислот при их нагревании в присутствии оксида фосфора (V) в качестве водоотнимающего средства.
Вещества, которые образуются при отщеплении воды от органических кислот, называются ангидридами.
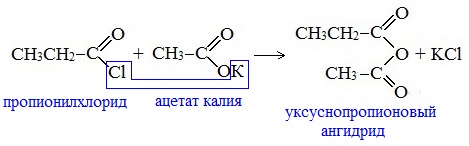
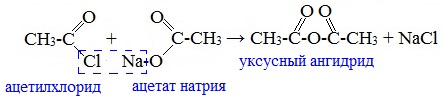
Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты с безводной солью другой карбоновой кислоты:
Муравьиная кислота не образует ангидрида. Дегидратация ее приводит к образованию оксида углерода (II).
Наиболее широкое применение находит уксусный ангидрид. Большое количество его расходуется для синтеза ацетилцеллюлозы, которая идет на изготовление искусственного шелка. Уксусный ангидрид используется также для получения аспирина.
III. Реакции с разрывом связи C-Н у ɑ-углеродного атома
(реакции с участием радикала)
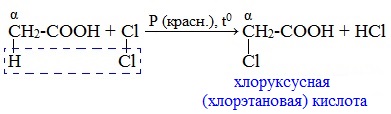
1. Реакции замещения (с галогенами)
Атомы водорода у ɑ-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты и могут замещаться на атомы галогена с образование ɑ-галогенкарбоновых кислот.
Карбоновые кислоты взаимодействуют с галогенами в присутствии красного фосфора (реакция Геля-Фольгарда-Зелинского):
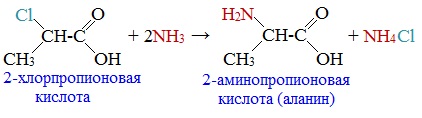
2-Хлорпропионовая кислота – промежуточный продукт для получения аминокислот. Действием на 2-хлорпропионовую кислоту аммиака получают 2-аминопропионовую кислоту (аланин):
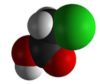
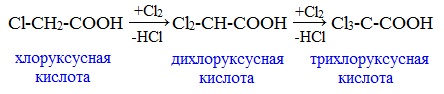
Дальнейшее хлорирование приводит к образованию дихлоруксусной и трихлоруксусной кислот:
IV. Реакции окисления (горение)
В атмосфере кислорода карбоновые кислоты сгорают с образованием оксида углерода (IV) СО2 и Н2О:
Видеоопыт «Горение уксусной кислоты на воздухе»
В отличие от альдегидов, карбоновые кислоты достаточно устойчивы к действию даже такого сильного окислителя, как перманганат калия. Исключение составляет муравьиная кислота, которая проявляет восстановительные свойства благодаря наличию альдегидной группы.
V. Реакции каталитического восстановления
Карбоновые кислоты с трудом восстанавливаются каталитическим гид-рированием, однако при взаимодействии с алюмогидридом лития (LiAlH4) или дибораном (В2Н6) восстановление осуществляется достаточно энергично:
Особенности строения и свойства муравьиной кислоты
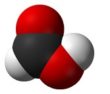
В отличие от других карбоновых кислот в молекуле муравьиной кислоты функциональная карбоксильная группа
связана не с углеводородным радикалом, а с атомом водорода. Поэтому муравьиная кислота является более сильной кислотой по сравнению с другими членами своего гомологического ряда.
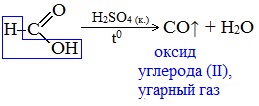
Все предельные карбоновые кислоты устойчивы к действия концентрированной серной и азотной кислот. Но муравьиная кислота при нагревании с концентрированной серной кислотой разлагается на воду и монооксид углерода (угарный газ).
1. Разложение при нагревании
При нагревании с концентрированной H2SO4 муравьиная кислота разлагается на оксид углерода (II) и воду:
Данную реакцию используют в лаборатории для получения чистого оксида углерода (II).
Видеоопыт «Разложение муравьиной кислоты»
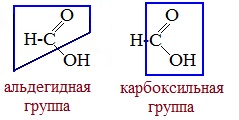
Молекула муравьиной кислоты, в отличие от других карбоновых кислот, наряду с карбоксильной группой содержит в своей структуре и альдегидную группу.
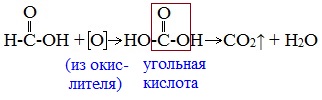
Поэтому муравьиная кислота вступает в реакции, характерные как для кислот, так и для альдегидов. Как и альдегиды, НСООН проявляет восстановительные свойства. Проявляя свойства альдегида, муравьиная кислота легко окисляется до угольной кислоты:
2. Окисление перманганатом калия
Видеоопыт «Окисление муравьиной кислоты раствором перманганата калия»
Муравьиная кислота окисляется аммиачным раствором Ag2О и гидроксидом меди (II) Cu (OH)2, т.е. дает качественные реакции на альдегидную группу!
3. Реакция «серебряного зеркала»
или в упрощенном виде
4. Окисление гидроксидом меди (II)
5. Окисление хлором, хлоридом ртути
Муравьиная кислота окисляется и другими окислителями (Сl2, HgCl2).
Формиаты щелочных металлов при сплавлении образуют соли щавелевой кислоты — оксалаты:
Видеоопыт «Взаимодействие бромной воды с олеиновой кислотой»
Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Практическая работа по теме «Карбоновые кислоты»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Практическая работа № 3. Получение и свойства карбоновых кислот
Цель работы: Получить уксусную кислоту и изучить её свойства.
Реактивы и оборудование: ацетат натрия, серная кислота (конц.) , уксусная кислота, магний (порошок), цинк, гидроксид натрия, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.
Ход работы: Внимание. Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной кислоты. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку вход в пробирку прикрыть ваткой, смотрите рисунок:
Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике – пробирке не собёрётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Опыт 3. Взаимодействие уксусной кислоты с основаниями.
В пробирку налейте 1 мл гидроксида натрия и добавьте 1 каплю фенолфталеина. Что наблюдаете? Почему?
Затем добавьте к содержимому пробирки уксусную кислоту. Почему происходит обесцвечивание? Запишите УХР, назовите продукты.
Опыт 4. Взаимодействие уксусной кислоты с солями слабых неорганических кислот.
В пробирку налейте 1 мл карбоната натрия и по каплям добавьте уксусную кислоту. Что наблюдаете? Почему?
Запишите УХР, назовите продукты.
Опыт 5 Моющая способность мыла
5.1) Налейте в пробирку 2—3 мл раствора мыла и прибавьте к нему соляной кислоты до образования хлопьев. Что собой представляет этот осадок? Составьте уравнение реакции. Проверьте, растворяется ли осадок в растворе щелочи. Объясните это явление.
5.2) К 2—3 мл раствора мыла в пробирке прилейте раствор хлорида кальция. Что наблюдаете? Напишите уравнение реакции. Какое свойство мыла иллюстрируется данным опытом?
Оформите работу в виде таблицы
Сделайте общий вывод о проделанной работе.
Опыт 1 . Получение уксусной кислоты.
В пробирку поместили немного ацетата натрия и добавили раствор H 2 SO 4 (1:1). Пробирку закрыли пробкой с газоотводной трубкой, конец которой поместили в другую, чистую пробирку.
Исходную пробирку нагрели. Наблюдаем конденсацию уксусной кислоты в приемнике, чувствуется резкий характерный запах уксусной кислоты.
Опыт 2 . Растворимость карбоновых кислот в воде
В одну пробирку налили 2 мл воды и добавили 3 капли уксусной кислоты, полученный раствор перемешали. В другую пробирку налили 2 мл воды и добавили чуть-чуть бензойной кислоты, содержимое перемешали, бензойная кислота в воде не растворилась. Тогда эту пробирку нагрели. Наблюдаем растворение бензойной кислоты. После охлаждения пробирки осадок вновь выпадает. Прибавили к осадку немного раствора гидроксида натрия. Наблюдаем вновь растворение осадка.
Различие растворимостей кислот объясняется природой вещества.
Опыт 3 . Взаимодействие уксусной кислоты с металлами
В пробирку налили немного уксусной кислоты и добавили 1 гранулу цинка. Пробирку нагрели. Наблюдаем выделение пузырьков газа водорода и растворение гранулы цинка.
Полученную кислоту разделили на 2 части. В первую пробирку поместили лакмусовую бумажку, наблюдаем ее покраснение. Затем прильем немного раствора гидроксида натрия. Помещенная в полученный раствор лакмусовая бумажка синеет. Во вторую пробирку добавили немного порошка магния, наблюдаем выделение газа.
Все кислоты, как органические, так и неорганические реагируют с металлами, стоящими в ряду напряжений до водорода. С металлами, стоящими после водорода, кислоты не будут реагировать, в том числе и уксусная кислота.
Опыт 4 . Получение сложного эфира
В пробирку налили 2 мл изоамилового спирта, 2 мл уксусной кислоты и чуть-чуть концентрированной серной кислоты. Пробирку закрыли пробкой с газоотводной трубкой и нагрели на водяной бане. После охлаждения в пробирку добавили немного воды. При этом выделяется слой изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции, произошла реакция этерификации.
В реакционную смесь добавляют концентрированную серную кислоту, как водоотнимающее средство, чтобы сместить равновесие вправо.
Опыт 5. Взаимодействие уксусной кислоты с оксидами металлов.
В пробирку с уксусной кислотой добавили немного оксида кальция, наблюдаем его растворение.
Опыт 6. Взаимодействие муравьиной кислоты с с аммиачным раствором оксида серебра.
4. При прилипании в пробирку с аммиачным раствором муравьиной кислоты, смесь нагрели.
Опыт 7. Моющая способность мыла
В пробирку с водой добавили стружек хозяйственного мыла и нагрели. К полученному мыльному раствору добавили раствор НСl. Наблюдаем образование хлопьев:
7. При добавлении к мыльному раствору раствора СаСl наблюдаем образование хлопьев:
Эта реакция иллюстрирует, что моющая способность мыла уменьшается в жесткой воде.
8. При приливании в пробирку с олеиновой кислотой (растительным маслом) бромной воды наблюдаем ее обесцвечивание – признак не предельности.
Видео:ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать

Практическая работа № 5. Карбоновые кислоты
Опыт 1. Растворимость карбоновых кислот в воде
В одну пробирку налили 2 мл воды и добавили 3 капли уксусной кислоты, полученный раствор перемешали. В другую пробирку налили 2 мл воды и добавили чуть-чуть бензойной кислоты, содержимое перемешали, бензойная кислота в воде не растворилась. Тогда эту пробирку нагрели. Наблюдаем растворение бензойной кислоты. После охлаждения пробирки осадок вновь выпадает. Прибавили к осадку немного раствора гидроксида натрия. Наблюдаем вновь растворение осадка.
Различие растворимостей кислот объясняется природой вещества.
Опыт 2. Взаимодействие уксусной кислоты с металлами
В пробирку налили немного уксусной кислоты и добавили 1 гранулу цинка. Пробирку нагрели. Наблюдаем выделение пузырьков газа водорода и растворение гранулы цинка.
Все кислоты, как органические, так и неорганические реагируют с металлами, стоящими в ряду напряжений до водорода. С металлами, стоящими после водорода, кислоты не будут реагировать, в том числе и уксусная кислота.
Опыт 3. Получение сложного эфира
В пробирку налили 2 мл изоамилового спирта, 2 мл уксусной кислоты и чуть-чуть концентрированной серной кислоты. Пробирку закрыли пробкой с газоотводной трубкой и нагрели на водяной бане. После охлаждения в пробирку добавили немного воды. При этом выделяется слой изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции, произошла реакция этерификации.
В реакционную смесь добавляют концентрированную серную кислоту, как водоотнимающее средство, чтобы сместить равновесие вправо.

задача №5
к главе «Химический практикум».
🌟 Видео
Растворимость в воде различных карбоновых кислотСкачать

Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Растворимость в воде различных карбоновых кислотСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Свойства карбоновых кислот. 1 часть. 11 класс.Скачать
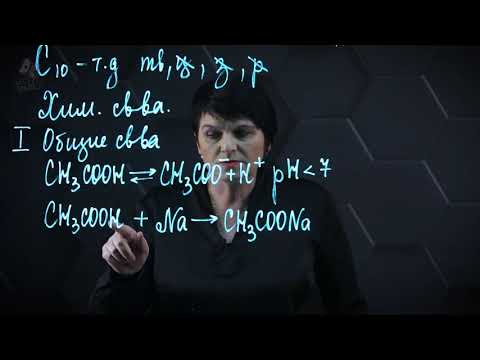
Свойства карбоновых кислот | Химия ЕГЭ 10 класс | УмскулСкачать

11.1. Карбоновые кислоты: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химические свойства карбоновых кислот | Химия ЕГЭ для 10 класса | УмскулСкачать

049 Растворимость в воде кразличных карбоновых кислотСкачать

46. Соли карбоновых кислотСкачать

Растворимость в воде различных карбоновых кислотСкачать

ЛЕКЦИЯ 2. КИСЛОТЫСкачать

11.2. Карбоновые кислоты: Способы получения. ЕГЭ по химииСкачать

🍇 Когда МОЖНО НАЧИНАТЬ УКОРЕНЯТЬ черенки винограда? Без ЭТОГО не получится вырастить хорошие саженцыСкачать

Все о получении карбоновых кислот за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать

Химические свойства карбоновых кислотСкачать

Растворимость в воде различных карбоновых кислотСкачать