Видео:Закон ГенриСкачать

15. Растворимость газов в жидкостях. Законы Генри—Дальтона и Сеченова.
Растворение газов в жидкостях почти всегда сопро–вождается выделением теплоты. Поэтому раствори–мость газов с повышением температуры согласно принципу Ле Шателье понижается. Эту закономер–ность часто используют для удаления растворенных га–зов из воды (например СО2 ) кипячением. Иногда рас–творение газа сопровождается поглощением теплоты (например, растворение благородных газов в некото–рых органических растворителях). В этом случае повы–шение температуры увеличивает растворимость газа.
Газ не растворяется в жидкости беспредельно. При не–которой концентрации газа Х устанавливается равно–весие:
При растворении газа в жидкости происходит значи–тельное уменьшение объема системы. Поэтому повы–шение давления согласно принципу Ле Шателье долж–но приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа. Если газ малораст–ворим в данной жидкости и давление невелико, то растворимость газа пропорциональна его давлению. Эта зависимость выражается законом Генри (1803г.): количество газа, растворенного при данной тем–пературе в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа.
Закон Генри может быть записан в следующей форме:
Где – концентрация газа в насыщенном раство–ре, моль/л;
Р(Х) – давление газа Х над раствором, Па;
Кr(Х) – постоянная Генри для газа Х, моль×л-1 × Па -1 .
Константа Генри зависит от природы газа, рас–творителя и температуры.
Закон Генри справедлив лишь для сравнительно раз–бавленных растворов, при невысоких давлениях и отсут–ствии химического взаимодействия между молекулами растворяемого газа и растворителем.
Закон Генри является частным случаем общего закона Дальтона. Если речь идет о растворении не одного газооб–разного вещества, а смеси газов, то растворимость каж–дого компонента подчиняется закону Дальтона: раство–римость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциаль–ному давлению компонента над жидкостью и не зави–сит от общего давления смеси и индивидуальности других компонентов.
Иначе говоря, в случае растворения смеси газов в жидкости в математическое выражение закона Генри вместо подставляют парциальное давление р! дан–ного компонента.
Под парциальным давлением компонента понимают долю давления компонента от общего давления газовой смеси:
Парциальное давление компонента рассчитывают по формуле.
Изучая растворимость газов в жидкостях в присутст–вии электролитов, русский врач-физиолог И. М. Сече–нов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
Где рi – парциальное давление компонента Хi;
Робщ – общее давление газовой смеси;
Х(Хi) – молярная доля i-ого компонента.
Изучая растворимость газов в жидкостях в присутствии электролитов, русский враччфизиолог И. М. Сеченов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
Видео:Физика. МКТ: Смеси газов. Закон Дальтона. Центр онлайн-обучения «Фоксфорд»Скачать

химия-экзамен. 1. растворимость газов. Закон Генри, Дальтона,Сеченова
| Название | 1. растворимость газов. Закон Генри, Дальтона,Сеченова |
| Анкор | химия-экзамен.doc |
| Дата | 27.05.2017 |
| Размер | 254.5 Kb. |
| Формат файла |  |
| Имя файла | химия-экзамен.doc |
| Тип | Закон #8171 |
| страница | 1 из 5 |
| Подборка по базе: Понятие и признаки уголовного наказания по современному уголовно, Реферат на тему Основные законы древней греции.docx, Основы законодательства Пр №1.docx, Федеральный закон о физической культуре и спорте в Российской Фе, Важнейшие экологические законы.docx, Т-1 Основные требования законодательства Российской Федерации об, ВПП Российское законодательство.doc, Обр сила закона.doc, Лекция Законы распределения.doc, Основной закон ФРГ.docx 1.растворимость газов.Закон Генри, Дальтона ,Сеченова. Растворение газа в жидкости почти всегда сопровож-ся выдел-м теплоты, поэтому растворим-сть газа с повыш-м темепер-ры понижается. Однако иногда растворе- газа сопровож-ся поглощением теплоты(например, растворение благород. газов в орган. растворах); в этом случае повышение температуры увеличивает растворимость газа. Газ в жидкости не растворяется беспредельно. При растворении происходит уменьшение обьема системы, поэтому повышение давления должно приводить к увеличению растворимости газа. Если газ малорастворим и давление мало, то раствор-сть газа пропорциональна его давлению. Эта зависимость выражена в законе Генри :кол-во газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа.с(Х)=Кг(Х)р(Х) , где с(Х)-концентрация газа в насыщ. растворе,моль/л, p(Х)-давление газа Х над раствором, ПА, Кг(Х)- постоянная Генри для газа Х, моль*л в минус первой*па в минус первой. Константа генри зависти от природы газа, растворителя и температуры. Закон Генри является частным случаем общего закона Дальтона (если речь идет о растворении смеси газов, то растворимость подчиняется этому закону) : растворимость каждого компонента газовой смеси при постоянной темпер-ре пропорциональна парциальному давлению компонента над жидкостью и не зависти от общего давления смеси и индивидуальности других компонентов. Под парциальным давлением понимается доля давления компонента от общего давления газовой смеси, рассчитывается по формуле рi = pобщx(Xi), где pi— парциальное давление компонента Xi, робщ- общее давление газовой смеси, х(Хi)-молярная доля i-го компонента. Закон Сеченова : растворимость газоа в жидкостях в присутствии электролитов понижается; происходит высаливание газа! Одной из причин уменьшения растворимости газа в присутствии электролита явл. гидратация ионов электролитов молекулами растворителя, в результе умень-тся число свобод молекул расторителя, т.е. его растворяющая способность. Формула:с(Х)+Со(Х)е в степени –КсСэ, где С(Х)-растворимость газа Х в чистом растворителе, Сэ-концентрация электролита, Кс-константа Сеченова, кот зависти от природы газа, электорлита и температуры.Законы Г, Д, С имеют большое практическое значение в химии, медицине., т.к используются при лечении ряда заболеваний, при кот накапливаются микробы в омертвевших тканях (напр, газовая гангрена). 2. Строение коллоидной мицеллы. Коллоидные частицы представляют собой образования со сложной структурой – мицеллы. М состоит из электорнейтрального агрегата и ионогенной части. Масса М сосредоточена в агрегате, кот состоит из множества атомов и молекул. Агрегат может иметь как аморфное так и кристалл-ое строение. Ионогенная часть М делиться на адсорбционный и диффузные слои. В рез-те избирательной адсорбции ионов или ионизации поверхностных молукул, агрегат приобретает заряд. Ионы, определяющие заряд агрегата, наз-ся потенциалопределяющими, и агрегат с этими потенциалопределяющими ионами образуют ядро! С заряженной поверхностью ядра связано некоторое кол-во ионов противоположного знака – противоионы. Потенциалопределяющие ионы и противоионы образуют адсорбционный слой. А агрегат с адсорбциооным слоем называют гранулой. Заряд гранулы равен сумме зарядов противо- и потенциалопределяющих ионов. Напр: золь AgCl, стабилизатор AgNO3: x(+)*xNO3(-) частица +,золь AgCl,стабилиз NaCl(избыток)(x+)*xNO3(-)слюна- кол. сист. сост. из мицелл фосфата кальция xCa(2+)Конц. Фосфата в слюне в 2 раза выше.,чем концентр кальция 1.Катализ.Основные понятия, свойства катализаторов, механизм гомогенного катализа. Особенности ферментов. Катализом называют селективное изменение скорости хим реакции веществом , которое участвует в реакции, но кол-во и состав которого не меняется к моменту образования конечных продуктов. Есть 2 типа катализа: положительный(когда скорость возрастает), и отрицательный (когда скорость реакции уменьшается), но обычно термин катализ относиться к положит К.Все каталитические реакции подразделяются на гомогенные и гетерогенные. Если реагирующие вещ-ва и катализатор наход-ся в разнх фазах, катализ наз-ся ГЕТЕРОГЕННЫМ1 (пример: синтез аммиака из азота и водорода в присутствии метелического железа). Если реагир-ее вещ-во и катализатор нах-ся в одной фазе, катализ наз-ся ГОМОГЕННЫМ! (пример: разложение водородопероксида в присутствии солей Fe(II) в водных растворах.РЕАКЦИЯ:2H2O2-2H2O + O2над стрелочкой Fe2+ (1) Каталитический распад происходит по следующему мех-му: 0, то катализатор не может заставить реакцию идти. Существуют вещества, снижающие активность катализатора — этоКАТАЛИТИЧЕСКИЙ ЯД. Вещ-во, усиливающее активность К, наз-ся АКТИВАТОРОМ! Все реакции каталитического разложения представляют собой сложные многостадийные процессы. Роль каталитических реакций велика при жизнедеятельности организмов; большинство реакций в организмах протекает при участии биологических катализаторов-ФЕРМЕНТАХ.. Характерной особенностью Ф явл. их специфичность: свойство изменять скорость реакции одного типа и не влиять на многие др реакции, протекающие в клетке! В состав большинства ферментов входит ион металла, поэтому эти биологические катализаторы наз-ся металлоферментами! Типичным ферментом явл-ся КАТАЛАЗА! Особенностями ферментов явл: 1) высокая активность 2) высокая специфичность 3) тонкий механизм регулировки активности деят-ти ферменотов с пом ЭФФЕКТОРОВ (активаторы, ингибиторы) 4) высокая чувств-ть к внешним условиям! 2. Адсорбция электролитов. Правило фаянса. Лиотропные ряды. Ионообменная адсорбция. Химическая адсорбция. Адсорбция(Г) – самопроизв изменение концентрации раствор-ого вещ-ва на границе раздела фаз, измеряется в моль/см(2) или мольм(2). В рас-рах сильн электролитов растворенное вещ-во нах в полностью ионизированном состоянии, поэтому их А имеет ряд особенностей!основными факторами, влияющими на специфичность А сильных электролитов явл. знак заряда поверхности адсорбента, величина и знак заряда иона, его радиус и степень сольватации! На положительно заряж поверхности адсорбента адсорбируются АНИОНЫ, на отрицательно заряженных – КАТИОНЫ! Адсорбционная способность ионов возрастает с увеличением их заряда. Кроме того, адсорбционная способность больше у тех ионов, радиус которых в сольватированном состоянии меньше. С соответствии с этим правилом, ионы по их адсорбционной способности располагаются в опред последовательности, кот наз-ся ЛИОТРОПНЫЕ РЯДЫ!Cs(+)>Rb(+)>NH4(+)>K(+)>Na(+)>LI(+) (уменьшение адсорбции, уменьшение радиуса иона, пм)NO3(-)>I(-)>Br(-)>CL(-)>F(-)-(257, 216, 195, 181, 136) Есть 3 вида адсорбции: эквивалентная, избирательная и обменная! ЭА встречается редко, характеризуется тем, что катионы и анионы адсорбируются на поверхности адсорбента в эквивалентных кол-вах. ИА -подчиняется правилу амер. физико-химика К.Фаянса:на поверхности адсорбента преимущественно адсорбируются те ионы, кот. могут достраивать кристалическую решетку этого адсорбента!пример-зарядка поверхности кристалического осадка серебра иодида. Ионнообменная А –процесс,в котором адсорбент и раствор обмениваются одноименно заряженными ионами в эквивалентных кол-вах. Например: RM1+M2(+)(еще обратная стрелка) RM2+M1(+), где RM1-адсорбенты, содержащие катион M1и способные к обмену с катионом М2 в растворе.получили название ионитов-твердые природные или синт вещ-ва, практически нерастворимые в воде!ИОННЫЙ ОБМЕН-процесс обратимый, что дает возможность регенирировать иониты(промыв кислотой и щелочью). Х.А – между адсорбантом и адсорбентом протекает реакция, образ. хим связи и образ новое соединение. Хемосорбция необратима, а физич. обратима. Теплота хим адсорбции >> физч ад.Е активации физич адсор =0. С повышением температуры физич адсор уменьшается, а хим-увеличивается!Хромотография — динамич метод анализа, основан на многократно повторяющ-ся прцесах сорбции и десорбции! Выделяют 2 фазы: неподвижная-адсорбент, подвижная – которая фильтруется чз неподвижную фазу вместе с разделяемыми вещ-вами! Её используют в анализе крови на алког, и наркотики! 1.Диссоциация воды. Водородный показатель(рН)среды. Ионное произведение воды. Согласно теории Бренстеда процесс Д воды протекает по уравнению H2O+ H2O(обр стрл) H3O(+) +OH(-); dH(0)==56, 5 кДж/моль!т.е одна молекула воды отдает, а др присоединяет протон, происходит автоионизация воды. Константа воды при 298К равна 1, 8*10(-16) мольлитр.(Кд(Н2О)= а(Н+)*а(ОН-)/а(Н2О)=1, 8*10(-16) моль литр!), где а(Н+), а(ОН-), а(Н2О)-активности ионов и воды.Вода слабый амфотерный электрлит,степень Д воды мала, поэтому активности водород- и гидроксид-ионов в чистой воде почти равна их концентрациям. Константа диссоциации воды К(Н2О) наз-ся ионным произведением или константой автоионизации воды. В чистой воде или любом водном растворе при постоянной температуре произведение концентраций (активностей) водород- и гидроксид ионов есть величина постоянная, называется ионным произведением воды! Ионное произведение позволяет вычислить концентрацию гидроксид- ионов , если известна концентрация ионов водорода и наоборот., т.к. они взаимозависимы.Константа зависти от Темпер: при повышении темперутуры константа увеличивается, т.к. процесс Д воды –эндотермический!(напр, при темп 310 К константа =3,13*10(-14), а при т 373=5, 9 8*10 (-13). В водных растворах разных веществ константа имеет тоже значение, что и для чистой воды.В водных растворах различают 3 вида сред: нейтр, щелоч и кислую. Для харак-ки сред растворовиспользуют концентрации водород-ионов, но более удобно использовать так наз водородный показатель рН –называется отрицательный десятичный логарифм концентрации ионов водорода:рН=-lg[H+]! В нейтр. Среде Н(+)= 10(-7) мольлитр рН=7, 0; в кислой> 10(-7) мольлитр, рН 7,0. Таким образом чем рН меньше 7, тем больше кислотность раствора, чем рН больше 7, тем больше щелочность раствора!Сущ-ет разл методы измерения рН, напр., с пом индикаторов (лакмус, фенолфталеин и метилоранж) вещ-ва кот, обратимо изменяют свой цвет в зависимости от рН раствора. *Одно из свойств живых организмов- постоянство рН биологических жидкостей, тканей и органов!причем рН различных жидкостей изменяется в завис-ти от их местонах-я! Так, рН крови-7, 4, рН жел сока 1! Смещение рН крови в кислую область наз-ся АЦИДОЗОМ, а в щелочную-АЛКАЛОЗОМ!! 2.СвойстваВМС.Набухание.ВязкостьрастворовВМС(ур.Штаудингера).Осмотическое давление(уравнение Галлера) ВМС-вещ-ва, молекулы кот состоят из очень большого числа (>10(3)) химически связанных атомов. Повтряющаяся структурная единица ВМС-мономерное звено, кот повторяется n –раз.ВМС могут нах-ся в крист,аморфн.,жидк виде. Есть 2 класса ВМС по типу мономерных звеньев: полимеры(получаются по реакции полимеризации; пример:полиэтилен, каучук) и прочие ВМС(получаются по реакции поликонденсации; пример: белки, полиамиды, полисахариды. Растворы ВМС быв по структуре: линейные(желатин,каучук(,разветвл(крахмал),лестничные(целлюлоза),сетчатые(трехмерные полимеры)Свой-ва полимеров имен-ся при добаве низкомолек соединений;1) Пластификация- повышение пластичности П при небольшом кол-ве НМС.!R=k*корень из M 2)Набухание—процес проникновения растворителя в полимерное вещество,сопровождаемый увеличением объема и массы образца. (молекулы НМС обладают большей подвижностю и при набухании проник внутрь, раздвигая цепи, увеличивая объем) Количественно Н измер-ся степенью набухания &м=м-м0:м0 или &v=V-Vo:Vo,где м0-нач масса,V-объем набух образца. При Н изменяются ЭНТАЛЬПИЯ(незначительно) и ЭНТРОПИЯ(dGнабух.=dG1,2=dG2,3) dG набухания отрицательна(dG2,3=-TdS2,3 dHкр, т.е. dH раств 1 2 3 4 5 Видео:ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать  Растворимость газов в жидкости уравнение сеченоваКафедра физической и коллоидной химии ЮФУ Материалы к лекциям для студентов химфака Существование абсолютно чистых веществ невозможно – всякое вещество обязательно содержит примеси, или, иными словами, всякая гомогенная система многокомпонентна. Если имеющиеся в веществе примеси в пределах точности описания системы не оказывают влияния на изучаемые свойства, можно считать систему однокомпонентной; в противном случае гомогенную систему считают раствором. Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств. Раствор может иметь любое агрегатное состояние; соответственно их разделяют на твердые, жидкие и газообразные (последние обычно называют газовыми смесями). Обычно компоненты раствора разделяют на растворитель и растворенное вещество. Как правило, растворителем считают компонент, присутствующий в растворе в преобладающем количестве либо компонент, кристаллизующийся первым при охлаждении раствора; если одним из компонентов раствора является жидкое в чистом виде вещество, а остальными – твердые вещества либо газы, то растворителем считают жидкость. С термодинамической точки зрения это деление компонентов раствора не имеет смысла и носит поэтому условный характер. Одной из важнейших характеристик раствора является его состав, описываемый с помощью понятия концентрация раствора. Ниже дается определение наиболее распространенных способов выражения концентрации и формулы для пересчета одних концентраций в другие, где индексы А и В относятся соответственно к растворителю и растворенному веществу. Молярная концентрация С – число молей ν В растворенного вещества в одном литре раствора. Нормальная концентрация N – число молей эквивалентов растворенного вещества (равное числу молей ν В, умноженному на фактор эквивалентности f) в одном литре раствора. Моляльная концентрация m – число молей растворенного вещества в одном килограмме растворителя. Процентная концентрация ω – число граммов растворенного вещества в 100 граммах раствора. Еще одним способом выражения концентрации является мольная доля X – отношение числа молей данного компонента к общему числу молей всех компонентов в системе. ОБРАЗОВАНИЕ РАСТВОРОВ. РАСТВОРИМОСТЬ Концентрация компонента в растворе может изменяться от нуля до некоторого максимального значения, называемого растворимостью компонента. Растворимость S – концентрация компонента в насыщенном растворе. Насыщенный раствор – раствор, находящийся в равновесии с растворенным веществом. Величина растворимости характеризует равновесие между двумя фазами, поэтому на неё влияют все факторы, смещающие это равновесие (в соответствии с принципом Ле Шателье – Брауна). Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо поглощение теплоты. Теория растворов должна объяснять все эти явления. Исторически сложились два подхода к образованию растворов – физическая теория, основы которой были заложены в XIX веке, и химическая, основоположником которой был Д.И. Менделеев. Физическая теория растворов рассматривает процесс растворения как распределение частиц растворенного вещества между частицами растворителя, предполагая отсутствие какого-либо взаимодействия между ними. Единственной движущей силой такого процесса является увеличение энтропии системы ΔS; какие-либо тепловые или объемные эффекты при растворении отсутствуют (ΔН = 0, ΔV = 0; такие растворы принято называть идеальными). Химическая теория рассматривает процесс растворения как образование смеси неустойчивых химических соединений переменного состава, сопровождающееся тепловым эффектом и изменением объема системы (контракцией), что часто приводит к резкому изменению свойств растворенного вещества (так, растворение бесцветного сульфата меди СuSО4 в воде приводит к образованию окрашенного раствора, из которого выделяется не СuSО4, а голубой кристаллогидрат СuSО4·5Н2О). Современная термодинамика растворов основана на синтезе этих двух подходов. В общем случае при растворении происходит изменение свойств и растворителя, и растворенного вещества, что обусловлено взаимодействием частиц между собой по различным типам взаимодействия: Ван-дер-Ваальсового (во всех случаях), ион-дипольного (в растворах электролитов в полярных растворителях), специфических взаимодействий (образование водородных или донорно-акцепторных связей). Учет всех этих взаимодействий представляет собой очень сложную задачу. Очевидно, что чем больше концентрация раствора, тем интенсивнее взаимодействие частиц, тем сложнее структура раствора. Поэтому количественная теория разработана только для идеальных растворов, к которым можно отнести газовые растворы и растворы неполярных жидкостей, в которых энергия взаимодействия разнородных частиц EA-B близка к энергиям взаимодействия одинаковых частиц EA-A и EB-B. Идеальными можно считать также бесконечно разбавленные растворы, в которых можно пренебречь взаимодействием частиц растворителя и растворенного вещества между собой. Свойства таких растворов зависят только от концентрации растворенного вещества, но не зависят от его природы. Растворимость газов в газах Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых соотношениях (при очень высоких давлениях, когда плотность газов приближается к плотности жидкостей, может наблюдаться ограниченная растворимость). Газовые смеси описываются законом Дальтона : Общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё газов. Растворимость газов в жидкостях Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов). Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0.017 л. азота, 748.8 л. аммиака или 427.8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот. Зависимость растворимости газов от давления выражается законом Генри – Дальтона : Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью. Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются. Растворимость газов в жидкостях существенно зависит от температуры; количественно данная зависимость определяется уравнением Клапейрона – Клаузиуса (здесь X – мольная доля газа в растворе, λ – тепловой эффект растворения 1 моля газа в его насыщенном растворе): Как правило, при растворении газа в жидкости выделяется теплота ( λ формулой Сеченова (X и Xo – растворимость газа в чистом растворителе и растворе электролита с концентрацией C): Взаимная растворимость жидкостей В зависимости от природы жидкости могут смешиваться в любых соотношениях (в этом случае говорят о неограниченной взаимной растворимости), быть практически нерастворимыми друг в друге либо обладать ограниченной растворимостью. Рассмотрим последний случай на примере системы анилин – вода. Если смешать примерно равные количества воды и анилина, система будет состоять из двух слоев жидкости; верхний слой – раствор анилина в воде, нижний – раствор воды в анилине. Для каждой температуры оба раствора имеют строго определенный равновесный состав, не зависящий от количества каждого из компонентов. Рис. 1. Диаграмма растворимости системы анилин – вода. Зависимость концентрации растворов от температуры принято изображать графически с помощью диаграммы взаимной растворимости. Эта диаграмма для системы анилин-вода приведена на рис. 1. Область под кривой – это область расслаивания жидкостей. Повышение температуры приводит к увеличению концентрации каждого из растворов (увеличению взаимной растворимости), и при некоторой температуре, называемой критической температурой расслоения (Ткр на рис. 1) взаимная растворимость воды и анилина становится неограниченной. Система анилин – вода относится к т.н. системам с верхней критической температурой расслоения ; существуют также и системы, для которых повышение температуры приводит к уменьшению взаимной растворимости компонентов. Растворимость твердых веществ в жидкостях Растворимость твердых веществ в жидкостях определяется природой веществ и, как правило, существенно зависит от температуры; сведения о растворимости твердых тел целиком основаны на опытных данных. Качественным обобщением экспериментальных данных по растворимости является принцип «подобное в подобном»: полярные растворители хорошо растворяют полярные вещества и плохо – неполярные, и наоборот. Зависимость растворимости S от температуры обычно изображают графически в виде кривых растворимости (рис. 2). Поскольку теплота растворения твердых веществ в жидкостях может быть как положительной, так и отрицательной, растворимость при увеличении температуры может увеличиваться либо уменьшаться (согласно принципу Ле Шателье – Брауна). 📸 ВидеоФизическая Химия, растворимость газов в жидкости, закон Генри #physicalchemistryСкачать  Введение в парциальное давление | Газы.Молекулярно-кинетическая теория | ХимияСкачать  Различия в молекулярном строении газов, жидкостей и твердых тел | Физика 7 класс #8 | ИнфоурокСкачать  Химия 66. Растворимость газов в воде — Академия занимательных наукСкачать  Давление в жидкостях и газах. Закон Паскаля. 7 класс.Скачать  Опыты по физике. Сжимаемость газов и жидкостейСкачать  Давление в жидкости и газе | Физика 7 класс #29 | ИнфоурокСкачать  Растворимость кислорода и двуокиси углеродаСкачать  Лекция №3. СМЕСЬ ИДЕАЛЬНЫХ ГАЗОВСкачать  РастворимостьСкачать 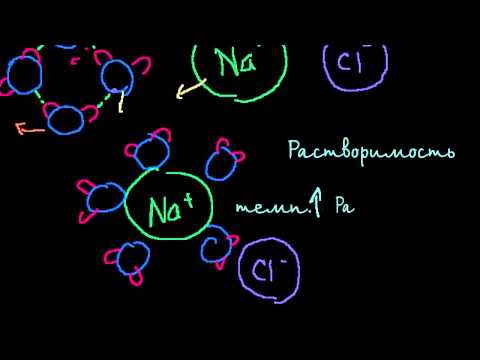 Физика. Механика жидкостей и газов: Сила Архимеда. Центр онлайн-обучения «Фоксфорд»Скачать  Парциальное давление, пример | Газы.Молекулярно-кинетическая теория | ХимияСкачать  Как понять что вещество выпадает в осадок или образуется газСкачать  Физика 10 класс (Урок№21 - Взаимные превращения жидкостей и газов.)Скачать  Физика 7 класс. Давление в жидкости и газеСкачать  Дополнение. Закон Генри. Парциальное давлениеСкачать  Лекция №7. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ ИДЕАЛЬНЫХ ГАЗОВСкачать  |
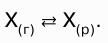
 (1)
(1) (2)
(2) (3)
(3) (4)
(4) (5)
(5) (6)
(6) (7)
(7) (8)
(8) (9)
(9)
