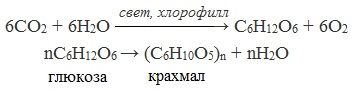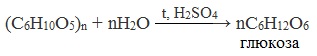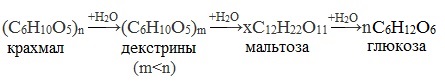Крахмал – ценный питательный продукт. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.
Химическая формула крахмала (С6(Н2О)5) n .
- Строение крахмала
- Амилоза
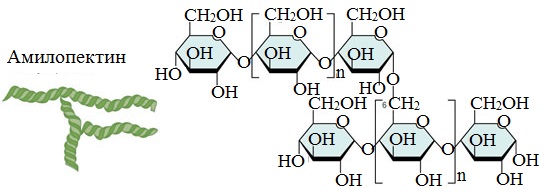
- Амилопектин
- Биологическая роль крахмала. Гликоген
- Превращение крахмала в организме человека и животных
- Нахождение в природе
- Физические свойства
- Химические свойства крахмала
- Получение крахмала
- Применение крахмала
- Растворение крахмала в холодной воде уравнение реакции
- Физико-химические изменения крахмала: растворимость, набухание и
- 🎦 Видео
Строение крахмала
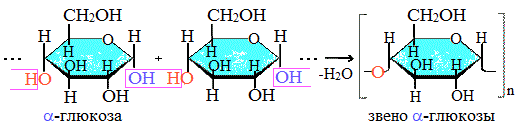
Крахмал состоит из 2 полисахаридов, построенных из остатков циклической a-глюкозы.
Как видно, соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют. Поэтому крахмал не дает реакцию «серебряного зеркала».
Крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) — 10-20%;
- амилопектин (оболочка крахмального зерна) — 80-90%.
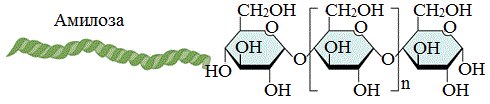
Амилоза
Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α–глюкозы связаны друг с другом через первый и четвертый атомы углерода (α-1,4-гликозидными связями).
Цепь амилозы включает 200 — 1000 остатков a-глюкозы (средняя мол. масса 160 000) .
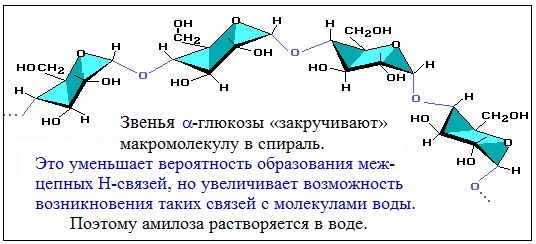
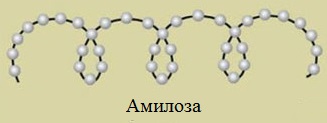
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев a-глюкозы.
Амилопектин
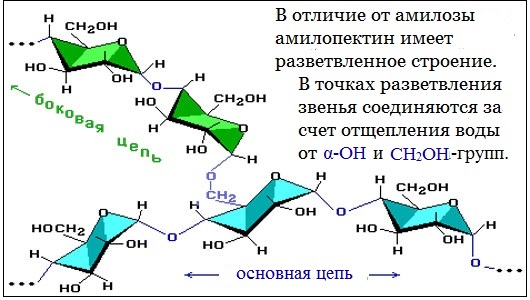
В отличие от амилозы, амилопектин не растворим в воде, и имеет разветвленное строение.
Подавляющее большинство глюкозных остатков в амилопектине связаны, как и в амилозе α-1,4-гликозидными связями. Однако в точках разветвлений цепи имеются α-1,6-гликозидные связи.
Молекулярная масса амилопектина достигает 1-6 млн.
Молекулы амилопектина также довольно компактны, так как имеют сферическую форму.
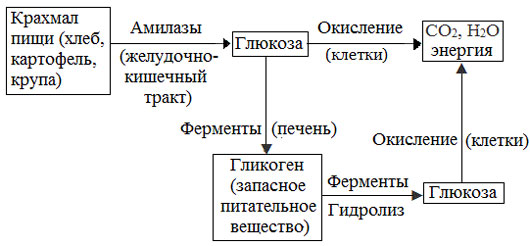
Биологическая роль крахмала. Гликоген
Крахмал – главное запасное питательное вещество растений, основной источник резервной энергии в растительных клетках.
Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в то же время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах.
Гликоген (животный крахмал) – полисахарид, молекулы которого построены из большого числа остатков α–глюкозы. Он имеет сходное строение с амилопектином, но отличается от него большей разветвленностью цепей, а также большей молекулярной массой.
Содержится гликоген главным образом в печени и в мышцах.
Гликоген – белый аморфный порошок, хорошо растворяется даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Превращение крахмала в организме человека и животных
Нахождение в природе
Крахмал широко распространен в природе. Он образуется в растениях в процессе фотосинтезе и накапливается в клубнях, корнях, семенах, а также в листьях и стеблях.
Крахмал содержится в растениях в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 80%), пшеницы (до 70%), кукурузы (до 72%), а также клубни картофеля (до 25%). В клубнях картофеля крахмальные зерна плавают в клеточном соке, в злаках они плотно склеены белковым веществом клейковиной.
Физические свойства
Крахмал – белое аморфное вещество, без вкуса и запаха, нерастворимое в холодной воде, в горячей воде набухает и частично растворяется, образуя вязкий коллоидный раствор (крахмальный клейстер).
Крахмал существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Химические свойства крахмала
Химические свойства крахмала объясняются его строением.
Крахмал не дает реакцию «серебряного зеркала», однако ее дают продукты его гидролиза.
1. Гидролиз крахмала
При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α-глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
Процесс гидролиза протекает ступенчато, схематически его можно изобразить так:
Видеоопыт «Кислотный гидролиз крахмала»
Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К.Кирхгоф (реакция Кирхгофа).
2. Качественная реакция на крахмал
Так как молекула амилозы представляет собой спираль, то при взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения.
Раствор иода окрашивает крахмал в синий цвет. При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь.
Крахмал + J2 – синее окрашивание
Видеоопыт «Реакция крахмала с йодом»
Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
3. Большинство глюкозных остатков в молекулах крахмала имеют по 3 свободных гидроксила (у 2,3,6-го атомов углерода), в точках разветвления – у 2-го и 3-го атомов углерода.
Следовательно, для крахмала возможны реакции, характерные для многоатомных спиртов, в частности образование простых и сложных эфиров. Однако эфиры крахмала большого практического значения не имеют.
Качественную реакцию на многоатомные спирты крахмал не дает, так как плохо растворяется в воде.
Получение крахмала
Из растений извлекают крахмал, разрушая клетки и отмывая его водой. В промышленном масштабе его получают главным образом из клубней картофеля (в виде картофельной муки), а также кукурузы, в меньшей степени – из риса, пшеницы и других растений.
Получение крахмала из картофеля
Картофель моют, измельчают и промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Вода извлекает из измельченного сырья крахмальные зерна, образуя так называемое «крахмальное молоко».
Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Получение крахмала из кукурузы
Зерна кукурузы замачивают в теплой воде разбавленной сернистой кислоты с целью размягчения зерна и удаления из него основной части растворимых веществ.
Набухшее зерно дробят для удаления ростков.
Ростки, после всплывания на поверхность воды, отделяют и используют в дальнейшем для получения кукурузного масла.
Кукурузную массу повторно измельчают, обрабатывают водой для вымывания крахмала, затем отделяют отстаиванием или с помощью центрифуги.
Применение крахмала
Крахмал широко применяется в различных отраслях промышленности (пищевой, фармацевтической, текстильной, бумажной и т.п.).
Он является основным углеводом пищи человека – хлеба, круп, картофеля.
В значительных количествах перерабатывается на декстрины, патоку и глюкозу, используемые в кондитерском производстве.
Из крахмала, содержащегося в картофеле и зерне злаков, получают этиловый, н-бутиловый спирты, ацетон, лимонную кислоту, глицерин.
Крахмал используется как клеящее средство, применяется для отделки тканей, крахмаления белья.
В медицине на основе крахмала готовятся мази, присыпки и т.д.
Видео:реакция крахмала с йодомСкачать

Растворение крахмала в холодной воде уравнение реакции
I. Фильм: “Полисахариды”
II. Физические свойства
Крахмал белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор (крахмальный клейстер) в горячей воде. Существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
III. Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
IV. Строение
Состоит из остатков α — глюкозы.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 – 1000 остатков α-глюкозы и имеет неразветвленное строение.
Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 — 6 млн.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания.
Подобно амилопектину построен гликоген (животный крахмал), макромолекулы которого отличаются большей разветвлённостью:
V. Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
- Ценный питательный продукт.
- Для накрахмаливания белья.
- В качестве декстринового клея.
VI. Химические свойства полисахаридов
1. Гидролиз
Гидролиз протекает ступенчато:
Охлаждённый крахмальный клейстер + I2 (раствор) = синее окрашивание, которое исчезает при нагревании.
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев α-глюкозы.
При взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения. Это соединение имеет характерный синий цвет. Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
Видео:Растворяется ли в воде крахмал?Скачать

Физико-химические изменения крахмала: растворимость, набухание и
Клейстеризация
Растворимость. Нативный крахмал практически нерастворим в холодной воде, однако вследствие гидрофильности способен адсорбировать влагу до 30% собственной массы. процесс растворения крахмальных полисахаридов протекает медленно вследствие относительно большого размера молекул. Растворению крахмала предшествует набухание.
Набухание крахмала – процесс поглощения воды, который влияет на консистенцию, форму, объем и выход готовых изделий. Степень набухания зависит от температуры среды и соотношения воды и крахмала. При нагревании крахмала с водой до температуры 55ºС они медленно поглощают воду (до 50% своей массы), частично набухают, но изменения вязкости не происходит, такое набухание обратимо и при охлаждении и сушки крахмал практически не изменяется. При дальнейшем нагревании суспензии (в интервале температур от 60 до 100ºС набухание ускоряется, объем увеличивается в несколько раз, происходит клейстеризация.
Клейстеризация – поглощение крахмалом большого количества воды при температуре 55-80ºС, сопровождающееся набуханием, увеличением в объеме в несколько раз, разрушением нативной структуры крахмального зерна. В центре крахмального зерна образуется полость, а на его поверхности появляются складки, бороздки, углубления. В процессе набухания и клейстеризации часть полисахаридов растворяется и остается в полости крахмального зерна, а часть диффундирует в окружающую среду. Температура клейстеризации картофельного крахмала –55-65ºС, пшеничного – 60-80ºС, кукурузного – 60-71ºС, рисового – 70-80ºС.
Одним из признаков клейстеризации является значительное повышение вязкости крахмальной суспензии, при этом вязкость обусловлена не столько присутствием набухших крахмальных зерен, сколько способностью растворенных в воде полисахаридов образовывать трехмерную сетку, удерживающую большее количество воды, чем крахмальные зерна. Этой способностью в наибольшей степени обладает амилоза, которая и обусловливает способность зерен к набуханию.
Из различных крахмалов образуется два типа клейстеров: из клубневых – прозрачный, бесцветный, желеобразной консистенции; из зерновых – непрозрачный, молочно-белый, пастообразной консистенции. Консистенция клейстера зависит от количества крахмала: 2-5% – клейстер жидкий, 6-8% – клейстер густой.
На вязкость клейстеров влияют также другие факторы:
1. Сахароза в концентрациях до 20% увеличивает вязкость клейстеров
2. рН: при снижении рН вязкость клейстеров уменьшается; в интервале рН от 4 до7, характерном для многих кулинарных изделий, вязкость клейстеров снижается незначительно; при рН около 2,5 вязкость клейстера резко падает. Поскольку при низких значениях рН имеет место интенсивный гидролиз с образованием незагустевающих декстринов, необходимо, чтобы избежать кислотного разжижения, использовать в качестве загустителя в кислых продуктах модифицированные поперечно-сшитые крахмалы;
3. Липиды, в частности, триглицериды (жиры, масла), моно- и диацилглицериды. Жиры, которые могут давать комплексы с амилозой, тормозят набухание крахмальных зерен, вследствие этого в белом хлебе, в котором мало жира, 96% крахмала обычно полностью клейстеризовано. Моноацилглицериды жирных кислот приводят к увеличению температуры клейстеризации, уменьшению силы геля, что связано со способностью компонентов жирных кислот в моноацилглицеридах образовывать соединения с амилозой, а, возможно, и с длинными внешними цепями амилопектина. Образование этих комплексов препятствует доступу воды в гранулу.
4. Белки оказывают стабилизирующее действие на крахмальные клейстеры. Данный процесс очень важен при формировании структуры теста – образовании клейковины. Однако точная природа взаимодействия между крахмалом и белком в пищевых системах остается неясной, что связано с трудностями в изучении взаимодействия двух неподобных макромолекул.
🎦 Видео
Химия 10 класс (Урок№11 - Полисахариды. Крахмал. Целлюлоза.)Скачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Физические и химические свойства водыСкачать

ТИК ТОК ЗАСТАВИЛ МЕНЯ ПОВТОРИТЬ ЭТО … НЕНЬЮТОНОВСКАЯ ЖИДКОСТЬ #shortsСкачать

Опыты по химии. Получение коллоидного раствора крахмалаСкачать

Опыты по химии. Гидролиз крахмалаСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Органика. Крахмал. 10 классСкачать

изменение крахмала под действием слюныСкачать

Свойства крахмала. Химический опытСкачать

Крахмал. Целлюлоза. 11 класс.Скачать

Кислотный гидролиз крахмалаСкачать

ШОК! КРАХМАЛ И ВОДАСкачать

Действие амилазы слюны на крахмалСкачать

Избегать ли КРАХМАЛА в пище? Структура крахмалаСкачать

Топ-5 правил при работе с крахмалом! Разворачивайте описание и читайте #ппторт #вегандесерт #крахмалСкачать
Полисахариды | Химия 10 класс #41 | ИнфоурокСкачать

Как сделать неньютоновскую жидкость в домашних условиях | Опыт с водой и крахмалом для детейСкачать