Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Способ получения
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция , образуется карбонат кальция и хлорид натрия:
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Видео:Получение ОКСИДА КАЛЬЦИЯ. Разложение КАРБОНАТА КАЛЬЦИЯ ( МЕЛА). Реакция с водой. Опыты по химииСкачать

Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Видео:Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Видео:Взаимодействие карбоната кальция с соляной кислотой I ЕГЭ по химииСкачать

Универсальный индекс насыщения воды карбонатом кальция
В статье представлена методика расчёта значения рН воды, соответствующего состоянию насыщения воды по карбонату кальция. Методика основана на использовании значения произведения растворимости карбоната кальция и константы диссоциации угольной кислоты по второй ступени.
Диоксид углерода содержится в воде в следующих состояниях: адсорбированного диоксида углерода, углекислоты, бикарбоната и карбоната. Все формы диоксида углерода при неизменном состоянии окружающей среды находятся в так называемом «углекислотном равновесии». Изменение углекислотного равновесия воды приводит к тому, что вода становится склонной либо к выпадению карбонатов, либо к углекислотной коррозии.
Если деионизированную воду, содержащую твёрдый карбонат кальция, начать насыщать диоксидом углерода, то будет происходить химическая реакция:
То есть диоксид углерода сначала будет адсорбироваться водой. Затем диоксид углерода диссоциируется в воде с образованием катиона водорода и аниона бикарбоната. Вода приобретает кислую реакцию. В результате начинается растворение твёрдого карбоната кальция с образованием растворённого бикарбоната кальция. Если из воды начать отгон диоксида углерода, то ион водорода при бикарбонате свяжется в воду, и начнёт образовываться обратно твёрдый карбонат кальция. Если вода находится в состоянии углекислотного равновесия, тогда говорят о том, что при определённой концентрации адсорбированного диоксида углерода в воде существует определённая концентрация бикарбоната кальция. При этом состоянии вода не склонна к выделению твёрдой фазы карбоната кальция, и все катионы водорода, образованные в результате диссоциации углекислого газа, участвуют в уравнении реакции (1).
То есть, если возникают условия для протекания коррозии с водородным деполяризатором, это сразу приводит к нарушению углекислотного равновесия. В результате начинает выделяться твёрдая фаза карбоната кальция, что значительно ингибирует скорость протекания коррозии.
справа налево, то должен образовываться твёрдый карбонат кальция. Тем не менее, в воде наблюдаются довольно малые концентрации растворённого карбоната кальция. Концентрации кальция и карбоната в данном случае определяются при помощи произведения растворимости карбоната кальция ПРCaCO3.
Внимание : корректное написание уравнений и формул приводится только в печатной версии журнала СОК и его PDF-версии. Подписаться или скачать журнал можно здесь.
С учётом того, что образуется один катион кальция и один анион карбоната, можно записать:
ПРCaCO3 = CCa fCaCCO3 fCO3,
где ССа и СCO3 — мольные концентрации кальция и карбоната, моль/л; fСа и fCO3 — коэффициенты активности кальция и карбоната.
Так как кальций и карбонат — двухвалентные ионы, с определённым допущением можно записать, что fСа = fCO3.
ПРCaCO3 = CCaCCO3 f 2 CO3. (2)
Значения произведения растворимости представлены в литературе для температур воды 25, 50, 100 и 150°C.
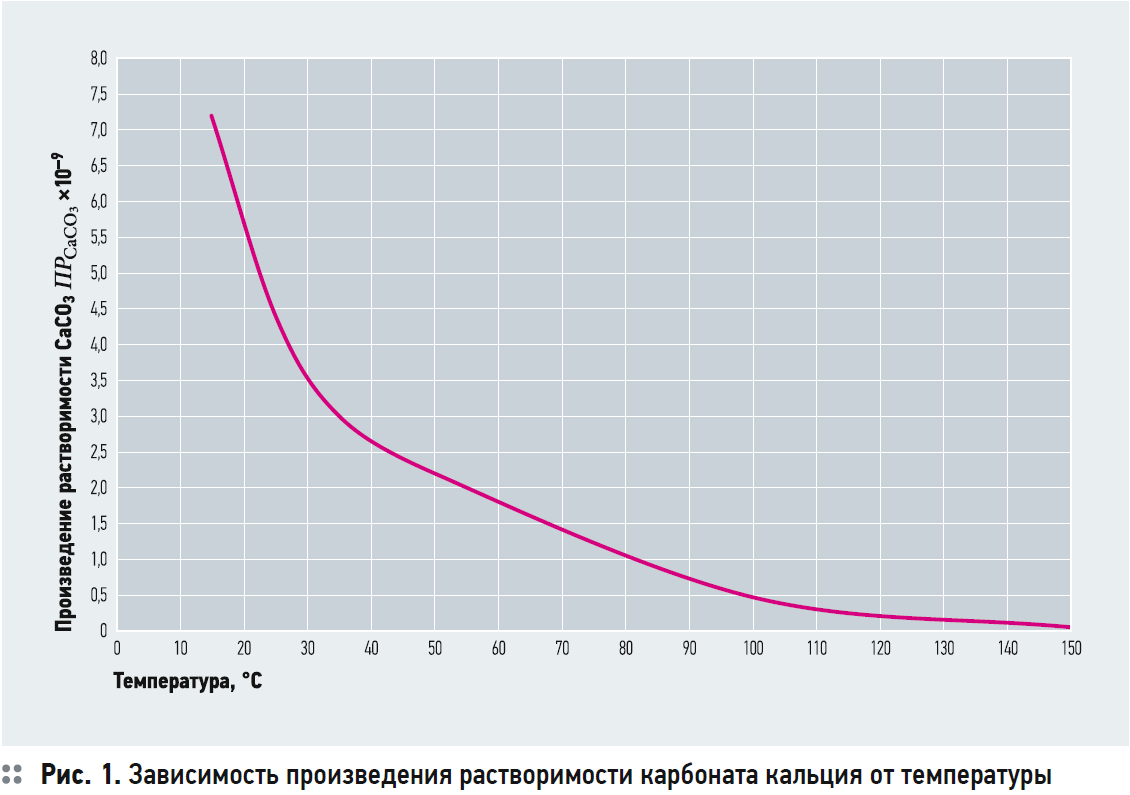
На рис. 1 представлена зависимость значения ПР от температуры. Для температур 25, 50, 100 и 150°C данные взяты из [1]. Остальные значения получены автором самостоятельно с использованием индекса Ланжелье.
Об этом будет сказано ниже.
Таким образом, для того, чтобы определить склонность воды к выделению осадка или к коррозии, достаточно знать значения концентраций кальция и карбоната. Но, так как определить карбонатион в воде при рН менее 8,37 невозможно, в соответствии с существующей методикой (ГОСТ 31957–2012. «Вода. Методы определения щёлочности и массовой концентрации карбонатов и гидрокарбонатов») для определения склонности воды к отложению карбоната кальция используют индекс насыщения Ланжелье.
Индекс насыщения Ланжелье — это разность между текущим значением рН воды и значением рНS, соответствующим состоянию насыщения этой воды по карбонату кальция (начало выделения твёрдой фазы карбоната кальция). В этом случае, определив по номограмме значение рНS и измерив текущее значение рН воды, можно определить склонность воды к отложению карбоната кальция или к углекислотной коррозии.
Соответственно, возникает вопрос: «Как определить рНS без использования эмпирического подхода»?
Для расчёта значения рНS воды, соответствующего состоянию насыщения по карбонату кальция, рассмотрим процесс диссоциации углекислоты в воде по второй стадии (диссоциация бикарбоната).
Уравнение диссоциации бикарбоната в воде можно записать в общем виде: HСО3 ?? H+ + СО3 -. (3)
Константу равновесия (диссоциации) данной химической реакции можно записать в виде:
Данное уравнение можно записать следующим образом, вынося ион водорода в левую часть:
Затем записать в виде десятичного логарифма, взятого с обеих сторон:
Очевидно, что При этом Константа диссоциации или константа равновесия реакции растворения углекислоты в воде по второй стадии К2 = 4,69?10–11.
Уравнение (4) есть уравнение Хендерсона-Хассельбальха для диссоциации углекислоты по второй стадии.
Более подробная информация о существовании и взаимодействии различных форм диоксида углерода в воде представлена в статье [2].
При помощи уравнения (4) можно рассчитать значение рНS воды в состоянии насыщения по карбонату кальция. Для этого необходимо определить значение карбонат-иона (СО3), при котором в воде достигается значение произведения растворимости карбоната кальция ПРCaCO3 с учётом существующего ионного состава воды.
Значение карбонат-иона можно определить исходя из произведения растворимости карбоната кальция. То есть мы определим концентрацию карбонат-иона, при котором вода данного химического состава находится в состоянии насыщения. Исходя из (2) получаем:
Таким образом, зная значения концентраций кальция и бикарбоната данной воды из химических анализов и рассчитав по (5) значение концентрации карбоната, мы можем определить при помощи (4) значение рНS.
Для учёта влияния концентрации всех ионов, растворённых в воде, необходимо в уравнении (4) вместо концентраций использовать активности карбоната и бикарбоната. Таким образом, уравнение (4) запишется следующим образом:
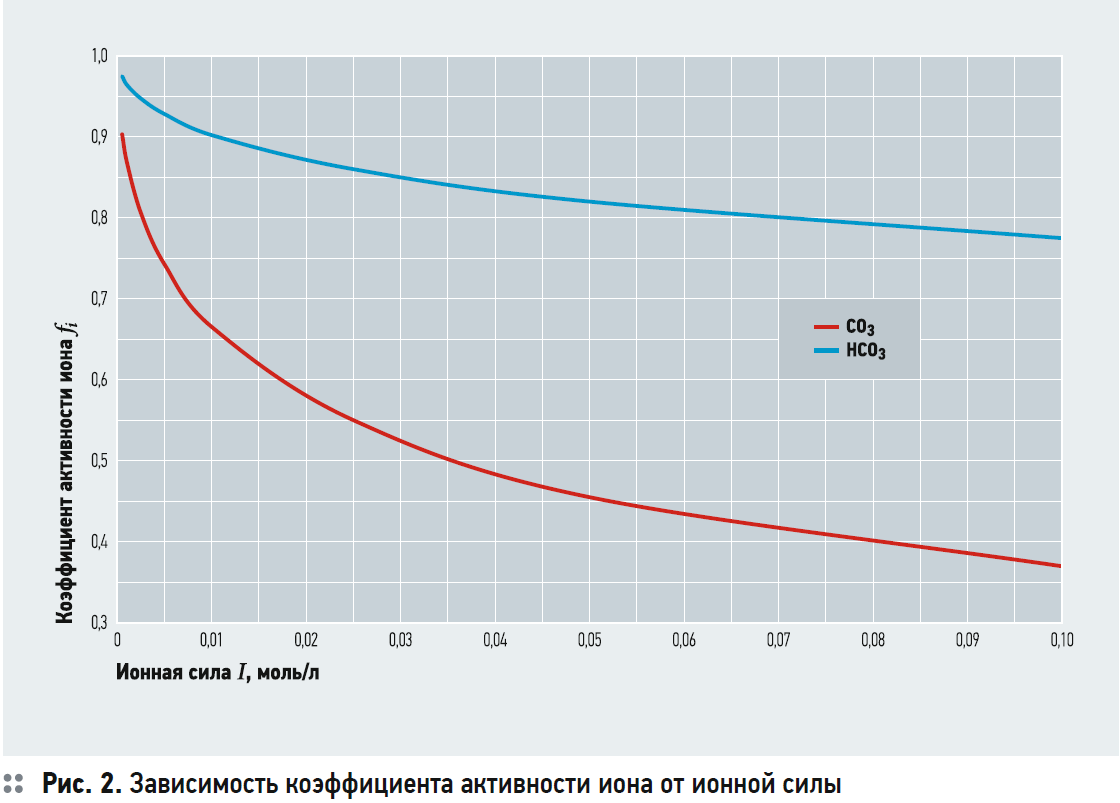
Коэффициенты активности зависят от ионной силы раствора и определяются по уравнению:
где fi — коэффициент активности иона; zi — заряд иона; I — ионная сила раствора, моль/л.
Ионная сила раствора учитывает влияние интенсивности электромагнитного поля, образованного ионами, на физико-химическое взаимодействие ионов, и равна полусумме значений произведения концентрации ионов на квадрат их зарядов:
На рис. 2 представлен график зависимости коэффициента активности иона от ионной силы раствора, построенный с использованием уравнения (7).
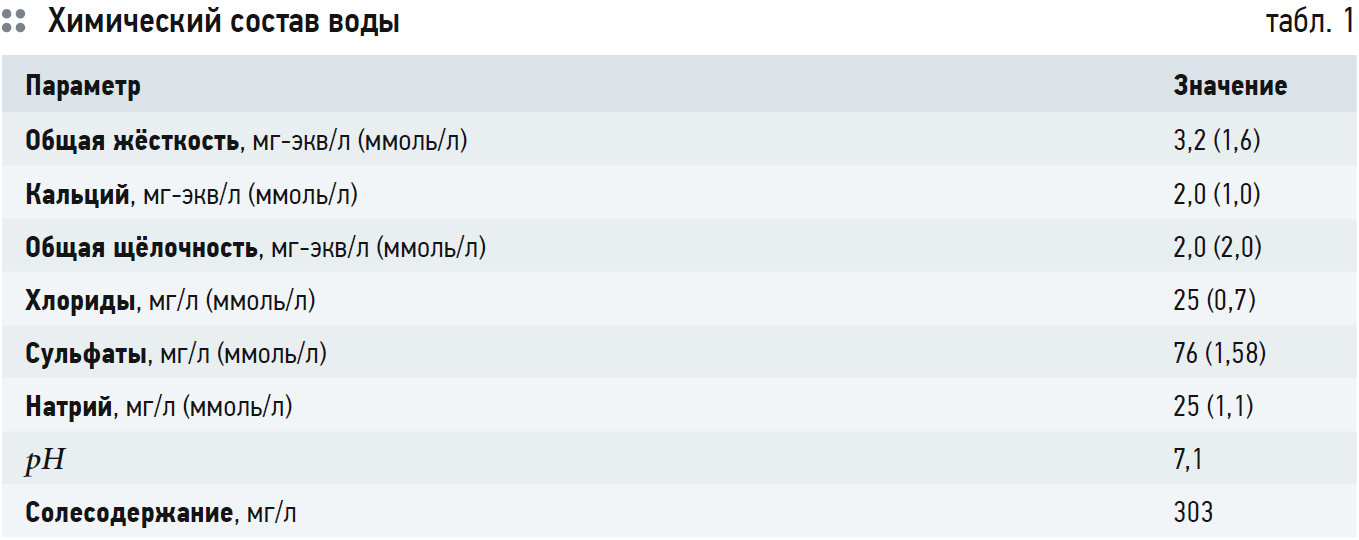
Для примера рассчитаем рНS с использованием ПРCaCO3 для водопроводной воды города Саратова для температуры 25°C. Источником водоснабжения является подготовленная вода из реки Волга.
Состав воды представлен в табл. 1. Ионная сила воды равна: I = 0,5?(Ca · 22 + Mg · 22 + Na · 1 + Cl · 1 + + SO4 · 22) = 1?4 + 0,6?4 + 1,1?1 + + 0,7?1 + 1,58?4 = 0,00726 моль/л. В соответствии с рис. 2: fCa = fCO3 = 0,7; fHCO3 = 0,915; ПРCaCO3 = 4,4?10–9 при t = 25°C. Тогда или СО3 = 0,00898 ммоль/л. В соответствии с уравнением (6) получаем выражение:
Значение рНS получилось на 0,76 больше, чем реально измеренный рН воды. Это значит, что вода склонна к протеканию коррозии с водородным деполяризатором (углекислотная коррозия в данном случае). Что и постоянно наблюдается.
Значение рНS, рассчитанное в процессе определения индекса Ланжелье по программе ROSA 9.0 для данных табл. 1, равно 7,86, то есть полностью совпадает со значением рНS, рассчитанным по предлагаемой методике.
Значение рНS, рассчитанное по номограмме, представленной в [3], равно 7,8.
Можно сказать, что в данном случае значение рНS, рассчитанное по предлагаемой методике, полностью соответствует значению рНS, полученному в результате расчёта индекса Ланжелье.
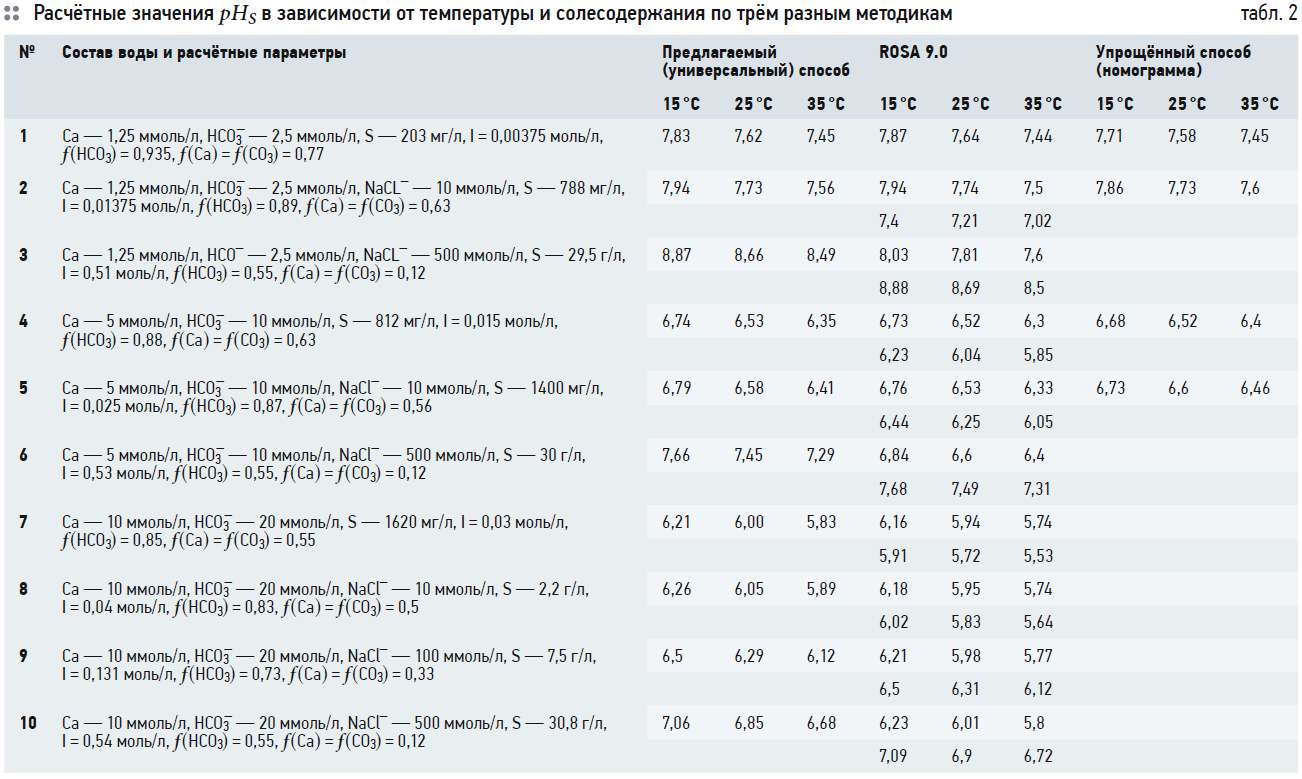
Для проверки автором был произведён расчёт рНS по данной методике и по расчёту индекса Ланжелье с использованием программы ROSA 9.0, а также с использованием номограммы, представленной в [3].
Результаты расчётов представлены в табл. 2, содержащей следующие данные.
В первой строке представлен расчёт значения рНS по трём методикам для следующего состава воды: Са — 1,25 ммоль/л; НСО3 — — 2,5 ммоль/л. На основании этих значений рассчитаны солесодержание S и ионная сила I и определены коэффициенты активности для ионов по рис. 1. В строке 2 в воду добавляется хлорид натрия (NaCl) — 10 ммоль/л. Соответственно, увеличиваются солесодержание, ионная сила и уменьшаются коэффициенты активности. В строке 3 в воду добавляют 500 ммоль/л (NaCl), и солесодержание воды становится 29,5 г/л. В этом случае значение рНS, рассчитанное по индексу Ланжелье, даёт неверные значения, и ROSA предлагает использовать индекс Стиффа и Девиса. Значение рНS, рассчитанное в соответствии с индексом Стиффа и Девиса, представлено в знаменателе в столбце ROSA 9.0, соответственно, в числителе того же столбца представлены значения рНS, рассчитанные по индексу Ланжелье.
В строках 4, 5 и 6 рассчитывается индекс насыщения для Са — 5 ммоль/л, НСО3 — — 10 ммоль/л, с добавление хлорида натрия в тех же количествах, как в строках 2 и 3.
В строках 7, 8, 9 и 10 рассчитывается индекс насыщения для Са — 10 ммоль/л, НСО3 — — 20 ммоль/л с добавление хлорида натрия. Только в строке 9 производится расчёт с добавлением 100 ммоль/л NaCl.
Для каждой методики произведён расчёт значения рНS для трёх температур воды: 15, 25 и 35°C.
Результаты расчёта, представленные в табл. 1, охватывают довольно большой диапазон концентраций бикарбоната кальция и общего солесодержания.
В расчёте значения рНS по уравнению (6) использовались допущения:
1. Коэффициенты активности для кальция и карбоната принимаются одинаковыми. Также не учитывается влияние температуры на коэффициент активность ионов в связи с её незначительным влиянием.
2. Данные для ПРCaCO3 взяты из [1] для температур 25, 50, 150 и 200°C. Значения ПР для 15°C и 35°C получены автором из расчёта того, что для широкого диапазона температур значения рНS, рассчитанные по предлагаемой методике и по ROSA 9.0, имели хорошую сходимость. В этом случае были определены следующие значения: ПРCaCO3 = 7,2?10–9 при t = 15°C; ПРCaCO3 = 4,4?10–9 при t = 25°C; ПРCaCO3 = 3,0?10–9 при t = 35°C.
3. Расчёт значения рНS при использовании номограммы [3] (третий столбец) ограничен солесодержанием воды в 15 г/л и НСО3 — не более 10 ммоль/л.
При использовании значений произведений растворимости по рис. 1 значения рНS практически совпадают для всех трёх рассматриваемых методик во всём рассматриваемом диапазоне температур и солесодержания. Расхождение составляет менее 0,1 ед. рН.
Также необходимо отметить, что при ионной силе I > 0,04 (солесодержание около 2,2 г/л) значения рНS, посчитанные по предлагаемой методике и в ROSA для индекса Ланжелье и индекса Стиффа и Девиса, имеют небольшое различие (строка 8).
При ионной силе более 0,1 (солесодержание около 7 г/л) значения рНS по индексу Ланжелье, посчитанные в ROSA, начинают давать очевидно неверные значения, но при этом значения рНS по индексу Стиффа и Девиса, посчитанные также в ROSA, практически полностью соответствуют значениям рНS, подсчитанным по предлагаемой методике (строка 9).
Можно сказать, что индекс Ланжелье можно использовать в расчётах при солесодержании воды до 4,0–5,0 г/л. Данное значение солесодержания — это своего рода граница перехода от индекса Ланжелье к индексу Стиффа и Девиса.
Для воды с солесодержанием около 30 г/л (I > 0,5) (строки 3, 6 и 10) значения рНS по предлагаемой методике соотносятся со значением рНS для индекса Стиффа и Девиса с расхождением менее 0,04 ед. рН. Так же, как с индексом Ланжелье при малом солесодержании.
Подводя итог, следует отметить, что использование предлагаемой методики для расчёта значения рНS, которое соответствует состоянию насыщения воды по карбонату кальция, имеет относительно простой и понятный смысл. Расчёт довольно прост и понятен. Для расчёта только необходимо определить значение ПРCaCO3 в зависимости от температуры воды по рис. 1, а также значения коэффициентов активности ионов кальция, карбоната и бикарбоната в зависимости от ионной силы раствора по рис. 1.
Данную методику расчёта значения рН воды, насыщенной по карбонату кальция, можно назвать универсальной, так как полученные результаты представляются достаточно достоверными во всём диапазоне солесодержания (пресных, солоноватых и солёных вод). При этом другие индексы работают только в определённом диапазоне солесодержания воды.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Опыт 27 ИЗУЧЕНИЕ РАСТВОРИМОСТИ КАРБОНАТА И ГИДРОКАРБОНАТА КАЛЬЦИЯ В ВОДЕ. 10 класс Химия Гузей Л.С., Суровцева Р.П. ГДЗ.
Опыт 27
ИЗУЧЕНИЕ РАСТВОРИМОСТИ
КАРБОНАТА И ГИДРОКАРБОНАТА КАЛЬЦИЯ
В ВОДЕ
Задания. 1. Проведя необходимые реакции, получите
а) карбонат и б) гидрокарбонат кальция и сравните их рас-
творимость в воде.
2. Напишите ионные уравнения проведенных реакций.
3. Сделайте вывод о растворимости карбоната и гидро-
карбоната кальция.
Опыт 27
Изучение растворимости карбоната
и гидрокарбоната кальция в воде
Результат: 1) уравнения проведенных опытов:
Са(ОН)2 + СO2 = CaCO3↓ + Н2O; СаСO3 + Н2O + СO2 = Са(НСO3)2.
2) Карбонат кальция малорастворим в воде, однако при продолжитель-
ном пропускании С02 через его водный раствор, он растворяется, пре-
вращаясь в гидрокарбонат, который растворим в воде.
🌟 Видео
Гидролиз солей. 9 класс.Скачать

Получение ГИДРОКСИДА КАЛЬЦИЯ Ca(OH)2. Растворение КАЛЬЦИЯ в ВОДЕ. Опыты по химии дома. ЭкспериментыСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Опыты по химии. Превращение гидрокарбоната кальция в карбонат кипячениемСкачать

Получение АЦЕТИЛЕНА. Получение КАРБИДА КАЛЬЦИЯ. Реакция КАРБИДА КАЛЬЦИЯ и ВОДЫ. Опыты по химии дома.Скачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Опыты по химии. Взаимодействие кальция с водойСкачать

Получение Карбоната Кальция - чистого мела. CaCO3.Скачать

Реакция карбоната кальция и соляной кислотыСкачать

Произведение растворимости (ПР или Ksp)Скачать

Произведение растворимости (ПР). Растворимость солей в растворах.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать