Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
Видео:Взаимодействие калия и натрия с водойСкачать

Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пер окси д натрия образует хлорид натрия и пероксид водорода:
5. Разбавленная хлороводородная кислота реагирует с гидроксидом натрия . Взаимодействие хлороводородной кислоты с гидроксидом натрия приводит к образованию хлорида натрия и воды:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Видео:Реакция большого количества натрия с водой.Скачать

Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид натрия образует нитрат натрия и осадок хлорид серебра:
NaCl + AgNO3 = NaNO3 + AgCl↓
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами :
2.1. Хлорид натрия взаимодействует с кислотами :
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями :
2.2.1. Твердый хлорид натрия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия . Взаимодействие хлорида натрия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, натрия, калия, газа хлора и воды:
2.2.2. Хлорид натрия взаимодействует с гидросульфатом натрия при температуре 450–800º C . При этом образуются сульфат натрия и хлороводородная кислота:
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Видео:Взаимодействие HCl с раствором хлорида натрияСкачать

Натрия хлорид (ФС.2.2.0014.15). Natrii chloridum
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Натрия хлорид (ФС.2.2.0014.15)
ФАРМАКОПЕЙНАЯ СТАТЬЯ
ФС.2.2.0014.15 Натрия хлорид – Natrii chloridum
Взамен ГФ Х, ст. 426; взамен ФС 42-2572-95
Содержит не менее 99,0 % натрия хлорида NaCl в пересчете на сухое вещество для субстанции, предназначенной для производства нестерильных лекарственных препаратов.
Содержит не менее 99,5 % натрия хлорида NaCl в пересчете на сухое вещество для субстанции, предназначенной для производства лекарственных препаратов для парентерального применения и глазных капель.
Описание. Белый кристаллический порошок или крупинки, или бесцветные кристаллы.
Растворимость. Легко растворим в воде, мало растворим в спирте 96 %.
Подлинность. Раствор 0,1 г субстанции в 2 мл воды должен давать характерную реакцию А на натрий и характерную реакцию на хлориды (ОФС «Общие реакции на подлинность»).
*Прозрачность раствора. 20,0 г субстанции растворяют в свежепрокипяченной и охлажденной воде и разбавляют водой до 100 мл; полученный раствор должен быть прозрачным (ОФС «Прозрачность и степень мутности жидкостей»).
*Цветность раствора. Раствор, полученный в испытании «Прозрачность раствора», должен быть бесцветным (ОФС «Степень окраски жидкостей»).
Кислотность или щелочность. К 20 мл раствора, приготовленного в испытании на «Прозрачность раствора», прибавляют 0,1 мл 0,05 % раствора бромтимолового синего. Окраска раствора должна измениться от прибавления не более 0,5 мл 0,01 М раствора натрия гидроксида или не более 0,5 мл 0,01 М раствора хлористоводородной кислоты.
Щелочноземельные металлы и магний. Не более 0,01 % в пересчете на кальций. К 200 мл воды прибавляют 0,1 г гидроксиламина гидрохлорида, 10 мл буферного раствора аммония хлорида, рН 10,0, 1 мл 0,1 М раствора цинка сульфата и 150 мг индикаторной смеси эриохрома черного Т. Нагревают до температуры 40 С. Титруют 0,01 М раствором натрия эдетата до перехода окраски из фиолетовой в синюю. К полученному раствору прибавляют 100 мл раствора, содержащего 10,0 г субстанции, и перемешивают. Если цвет раствора изменился на фиолетовый, то его титруют 0,01 М раствором натрия эдетата до появления синего окрашивания. На второе титрование должно пойти не более 2,5 мл 0,01 М раствора натрия эдетата.
Барий. К 5 мл раствора, приготовленного в испытании на «Прозрачность раствора», прибавляют 5 мл воды, 2 мл раствора серной кислоты разведенной 9,8 % и перемешивают. Через 2 ч мутность полученного раствора не должна превышать мутность эталонного раствора, содержащего 5 мл раствора, приготовленного в испытании «Прозрачность раствора», и 7 мл воды.
Железо. Не более 0,0002 %. Определение проводят в соответствии с требованиями ОФС «Железо», метод 2, с использованием эталонного раствора, содержащего 4 мл стандартного раствора железо(III)-иона (1 мкг/мл) и 6 мл воды. Для анализа используют раствор, приготовленный в испытании «Прозрачность раствора».
Мышьяк. Не более 0,0001 % (ОФС «Мышьяк»). Определение проводят с использованием эталонного раствора, содержащего 1 мл стандартного раствора мышьяк-иона (1 мкг/мл). Для анализа отбирают 1,0 г субстанции.
Сульфаты. Не более 0,02 % (ОФС «Сульфаты», метод 2). 7,5 мл раствора, приготовленного в испытании «Прозрачность раствора», разводят водой до 30 мл.
Фосфаты. Не более 0,0025 % (ОФС «Фосфаты»). К 2 мл раствора, приготовленного для испытания «прозрачность раствора», прибавляют 98 мл воды и перемешивают.
Ферроцианиды. К 2,0 г субстанции, растворенной в 6 мл воды, прибавляют 0,5 мл раствора, состоящего из 5 мл 1 % раствора железа(III) аммония сульфата в 2,5 % растворе серной кислоты, 95 мл 1 % раствора железа(II) сульфата, и перемешивают; в течение 10 мин не должно появляться синее окрашивание.
Нитриты. К 10 мл раствора, приготовленного в испытании «Прозрачность раствора», прибавляют 10 мл воды и перемешивают. Оптическая плотность полученного раствора, измеренная в кювете с толщиной слоя
10 мм при длине волны 354 нм относительно воды, должна быть не более 0,01.
Бромиды. Не более 0,01 %.
Испытуемый раствор. К 0,5 мл раствора, приготовленного в испытании «Прозрачность раствора», прибавляют 4 мл воды.
Эталонный раствор. 5 мл раствора калия бромида (3 мкг/мл).
К испытуемому и эталонному растворам прибавляют по 2,0 мл 1,65 % раствора фенолового красного, 1 мл 0,01 % раствора хлорамина Т и тотчас перемешивают. Точно через 2 мин прибавляют по 0,15 мл 0,1 М раствора натрия тиосульфата, перемешивают, доводят объемы растворов водой до 10 мл, перемешивают и измеряют оптическую плотность при 590 нм относительно воды.
Оптическая плотность испытуемого раствора не должна превышать оптическую плотность эталонного раствора.
Йодиды. 5 г субстанции увлажняют по каплям свежеприготовленной смесью, состоящей из 0,15 мл 10 % раствора натрия нитрита, 2 мл 0,5 М раствора серной кислоты, 25 мл 1 % раствора крахмала и 25 мл воды. Через
5 мин увлажненную субстанцию просматривают при дневном освещении – голубое окрашивание должно отсутствовать.
*Алюминий. Не более 0,00002 % (ОФС «Алюминий», метод 1 или 2).
Испытуемый раствор. 20,0 г субстанции растворяют в
100 мл воды, прибавляют 10 мл ацетатного буферного раствора, рН 6,0 и перемешивают.
Эталонный раствор. К 2 мл стандартного раствора алюминий-иона
(2 мкг/мл) прибавляют 10 мл ацетатного буферного раствора, рН 6,0, 98 мл воды и перемешивают.
Контрольный раствор. К 10 мл ацетатного буферного раствора, рН 6,0 прибавляют 100 мл воды и перемешивают.
Метод 2. Определение проводят из навески субстанции 10,0 г.
*Калий. Не более 0,05 %. Испытание проводят одним из методов.
Стандартный раствор 20 мкг/мл калий-иона. 0,446 г калия сульфата, высушенного при температуре от 100 до 105 С до постоянной массы, помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. 1 мл полученного раствора помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают.
Испытуемый раствор. 0,2 г субстанции растворяют в 10 мл воды.
Эталонный раствор. К 5 мл стандартного раствора калий-иона
(20 мкг/мл) прибавляют 5 мл воды и перемешивают.
К испытуемому и эталонному растворам прибавляют по 2 мл 1 % раствора натрия тетрафенилбората и перемешивают. Через 5 мин опалесценция испытуемого раствора не должна превышать опалесценцию эталонного раствора.
Метод 2. АЭС или ААС
Стандартный раствор калий-иона (600 мкг/мл). 1,14 г калия хлорида, высушенного до постоянной массы при температуре 100 – 105 о С, помещают в мерную колбу вместимостью 1000 мл, растворяют в воде, доводят объем раствора водой до метки и перемешивают.
Испытуемый раствор. 1,00 г субстанции помещают в мерную колбу вместимостью 100 мл, растворяют в воде, доводят объем раствора водой до метки и перемешивают.
Разбавление стандартного и испытуемого раствора производят в соответствии с инструкцией к прибору и проводят определение содержания ионов калия методом атомной эмиссии (метод прямой калибровки) или атомной абсорбции при длине волны 766,5 нм.
*Аммоний. Не более 0,004 % (ОФС «Аммоний»). Определение проводят с использованием раствора 0,5 г субстанции в 10 мл воды.
Тяжелые металлы. Не более 0,0005 % (ОФС «Тяжёлые металлы»). Для определения используют раствор, приготовленный в испытании «Прозрачность раствора».
Потеря в массе при высушивании. Не более 0,5 % (ОФС «Потеря в массе при высушивании», способ 1). Для определения используют около 1,0 г (точная навеска) субстанции.
Микробиологическая чистота. В соответствии с требованиями ОФС «Микробиологическая чистота».
*Бактериальные эндотоксины. Не более 5 ЕЭ на 1 г субстанции (ОФС «Бактериальные эндотоксины»).
Количественное определение. Около 0,1 г (точная навеска) субстанции растворяют в 50 мл (при определении конечной точки титрования потенциометрически) или 20 мл воды (при определении конечной точки титрования с помощью индикатора) и титруют 0,1 M раствором серебра нитрата с потенциометрическим определением точки эквивалентности или до оранжево-желтого окрашивания (индикатор – 5 % раствор калия хромата).
Параллельно проводят контрольный опыт.
1 мл 0,1 М раствора серебра нитрата соответствует 5,844 мг натрия хлорида NaCl.
Хранение. В хорошо укупоренной упаковке.
* Контроль по показателям качества «Прозрачность раствора», «Цветность раствора», «Алюминий», «Калий», «Аммоний» и «Бактериальные эндотоксины» проводят для субстанции, предназначенной для приготовления лекарственных форм для парентерального применения.
Видео:Реакция Хлорида Натрия, Оксида Марганца и Серной Кислоты. Реакция NaCl,MnO2 и H2SO4. Выделение ХлораСкачать

Теория
электролитической
диссоциации
Цели. Сформировать у учащихся понятие «электролитическая диссоциация» на основе атомно-молекулярного учения, теории электролитической диссоциации С.Аррениуса и гидратной теории растворов Д.И.Менделеева. Вскрыть причину электропроводности растворов, обсудить значение и применение теории.
Оборудование и реактивы. Пробирки, два мерных цилиндра, пипетки, прибор для проверки электрической проводимости растворов, стаканы, стеклянные палочки;
вода, концентрированные серная и уксусная кислоты, твердые гидроксид натрия, хлорид натрия, сульфат меди(II), 100 мл раствора метилоранжа в ацетоне, растворы сульфата меди(II), хлорида натрия, гидроксида кальция, нитрата бария, хлорида бария, нитрата серебра, соляной кислоты, карбоната натрия, хлорида магния, хлорида алюминия, цинк гранулированный, железо – порошок, алюминий гранулированный.
План изложения темы
- Свойства водных и неводных растворов различных классов неорганических соединений.
- Растворение в воде с точки зрения электронной теории.
- Диссоциация электролитов в растворе.
- Степень электролитической диссоциации. Слабые и сильные электролиты.
ХОД УРОКА
Учитель. Известно ли вам, что вещества растворяются не только в воде, но и в других растворителях? Если да, то приведите примеры. (Учащиеся приводят примеры растворения веществ.)
Выясним, нужен ли растворитель для протекания реакции и важна ли в этом случае природа растворителя. Возьмем концентрированную серную кислоту и опустим в нее цинк. Произойдет ли реакция? (Проводит лабораторный опыт.)
Ученик. Цинк реагирует с концентрированной серной кислотой при нагревании. При этом выделяется газ SO2 (пишут на доске уравнение реакции):
Учитель. Выделяется ли водород? А теперь перельем содержимое пробирки (из опыта) в пробирку с водой, очень осторожно. Реакция пошла, выделяется много тепла. Обратите внимание, без воды реакция почти не шла, хотя вода при обычных условиях не взаимодействует с цинком.
Проделаем еще один опыт. Смешаем сначала твердые вещества: гидроксид натрия и сульфат меди(II), а затем их растворы. Реакция между твердыми реагентами не происходит, а в растворе образуется голубой осадок. Запишите в тетрадях уравнение химической реакции:
2NaOH + CuSO4 = Cu(OH)2 
Из результатов опытов сделаем вывод, что вода в химических реакциях вовсе не пассивная среда. Под ее влиянием вещества испытывают изменения. Вода заставляет электролиты распадаться на ионы.
Рассмотрим процесс растворения электролитов в воде. Для этого придется вспомнить, что такое валентность и какие виды химической связи вам известны.
Ученики отвечают на поставленные вопросы. При рассмотрении ионной связи акцентируем внимание на модели кристаллической решетки хлорида натрия. Ковалентную полярную связь повторяем на примере строения молекул воды.
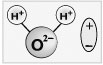
Учитель. В целом молекула воды не заряжена. Но внутри молекулы Н2О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 1). Поэтому молекула воды представляет собой диполь.
Рис. 1.
Молекула воды полярна и
представляет собой диполь
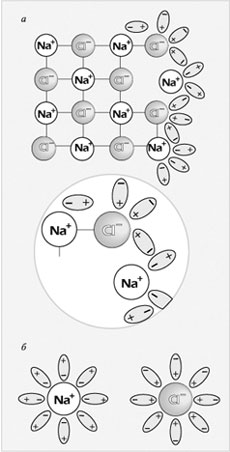
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na + и Сl – из кристалла в раствор происходит образование гидратов этих ионов. (Далее веду объяснение по рисунку (рис. 2, см. с. 36) учебника: Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.: Просвещение, 1999, с. 4.) А как реагируют с молекулами воды полярные молекулы электролита? Рассмотрим это на примере соляной кислоты (рис. 3,
см. с. 36).
Рис. 2.
Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na + ;
б – гидратация (окружение молекулами воды) ионов Na + и Сl –
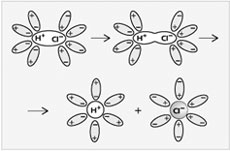
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными.
Рис. 3.
Диссоциация молекул HCl
на ионы в водном растворе
Наличие ионов в растворах кислот, щелочей и солей можно доказать реакциями обмена. Проведем следующие опыты:
взаимодействие сульфата меди(II) c:
а) нитратом бария;
б) хлоридом бария;
в) гидроксидом натрия;
г) гидроксидом кальция;
взаимодействие нитрата серебра с:
д) соляной кислотой;
е) хлоридом натрия.
Запишем уравнения химических реакций:
а) СuSO4 + Ba(NO3)2 = Cu(NO3)2 + BaSO4
б) СuSO4 + BaСl2 = CuCl2 + BaSO4
в) СuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
г) СuSO4 + Сa(OH)2 = CaSO4 + Cu(OH)2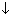
д) AgNO3 + HCl = HNO3 + AgCl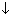
е) AgNO3 + NaCl = NaNO3 + AgCl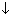
На основании этих реакций можно сделать следующие выводы:
1) ионы металлов, гидроксильные группы и кислотные остатки реагируют в водных растворах как самостоятельно существующие частицы;
2) гидроксильные группы, кислотные остатки, атомы водорода кислот и атомы металлов солей являются теми электрически заряженными частицами, которые находятся в растворах кислот, щелочей и солей.
Запишем определение понятия: «Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении».
Поскольку число молекул воды, которое присоединяют ионы, неизвестно, то процесс диссоциации кислоты, щелочей и солей упрощенно изображают так:
Многоосновные кислоты и кислые соли диссоциируют ступенчато. Чтобы показать неполную диссоциацию молекул и ионов, не относящихся к сильным электролитам, используют знак обратимости «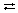
H2SO4 = H + + 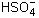
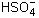
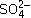
NaHSO4 = Na + + 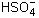
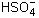
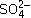
Cледует не допускать ошибок при написании уравнений диссоциации нерастворимых и малорастворимых веществ, которые практически не диссоциируют на ионы или диссоциируют в малой степени:
CaCO3 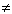
СaSO4 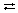
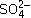
Основные термины, рассматриваемые в теории электролитической диссоциации, – это «электролиты» и «ионы».
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы – это атомы или группы атомов, обладающие положительным (катионы) или отрицательным (анионы) зарядом. Ионы отличаются от атомов как по строению, так и по свойствам. Для примера сравним свойства атомарного и молекулярного хлора со свойствами иона. Рассмотрим их отношение к металлам, водороду, ионам серебра. Свойства металлического натрия сравним со свойствами ионов натрия. (Ученики приводят примеры и рассказывают о свойствах атомов Cl, молекулы Cl2 и ионов Сl – , а также о свойствах металлического Na и ионов Na + в составе солей.)
Рис. 4.
Прибор для проверки
электропроводности растворов
Общий и характерный признак ионов – наличие электрических зарядов. Ток проводят только те растворы, в которых содержатся ионы. Сравним электропроводность растворов кислот, щелочей, солей, сахара, спирта при помощи прибора для изучения электропроводности растворов (рис. 4). Мы видим, что диссоциация происходит не во всяком растворе. На основании ионной теории сформулируем новые определения кислот, оснований и солей как сложных веществ, образующих при диссоциации в воде особые ионы. При диссоциации кислот в качестве катионов отщепляются только ионы H + . При диссоциации оснований в качестве анионов отщепляется только ионы ОН – . Средние соли диссоциируют на катионы металлов и анионы кислотных остатков.
Попробуем ответить на такой вопрос: все ли электролиты в одинаковой степени распадаются на ионы? Сравним электропроводность концентрированных растворов хлорида натрия и уксусной кислоты. В растворе соли лампочка загорается ярко, а в уксусной кислоте – очень слабо. Разбавим растворы, добавив к ним воды. Электропроводность раствора хлорида натрия не изменяется, а в растворе уксусной кислоты лампочка горит ярче. Хлорид натрия даже в концентрированных растворах диссоциируют полностью. Молекулы же уксусной кислоты в концентрированных растворах почти не диссоциируют. При разбавлении уксусной кислоты число диссоциированных молекул увеличивается, равновесие диссоциации смещается вправо:
СН3СООН 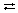
Вещества с ионной кристаллической решеткой полностью диссоциируют на ионы в водных растворах. Отношение числа диссоциированных молекул (n) к общему числу молекул (N), находящихся в растворе, называют степенью диссоциации (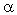
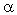
Общие свойства кислот обусловливаются наличием ионов Н + в растворе. Активность кислоты (сильный или слабый электролит) зависит от концентрации ионов Н + в растворе.
Демонстрационный опыт. В два стакана нальем по 50 мл раствора метилоранжа в ацетоне. В первый стакан добавим 1–2 капли концентрированной серной кислоты, появляется малиновое окрашивание. Чтобы во втором стакане появилась такая же окраска, придется добавить в 10 раз больше (10–20 капель) уксусной кислоты, т.к. степень диссоциации кислоты CH3COOH незначительная и концентрация ионов водорода в ней невелика.
Вывод. Сила кислот и оснований определяется их степенью диссоциации.
📺 Видео
Реакции металлов с кислородом и водой. 8 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Механизм диссоциации хлорида натрияСкачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Реакция СУЛЬФИТА МЕДИ и ХЛОРИДА НАТРИЯ. Химические опыты.Эксперимент.Preparation of copper chloride.Скачать

Натрий - металл, который взрывается в воде!Скачать

Обнаружение ионов в растворе. Качественные реакцииСкачать

Как получить НАТРИЙ из ВОДЫ?Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Натрия хлорид раствор инструкция по применению препарата: Показания, как применять, обзор препаратаСкачать

Что будет, если натрий бросить кусок натрия в воду?Скачать

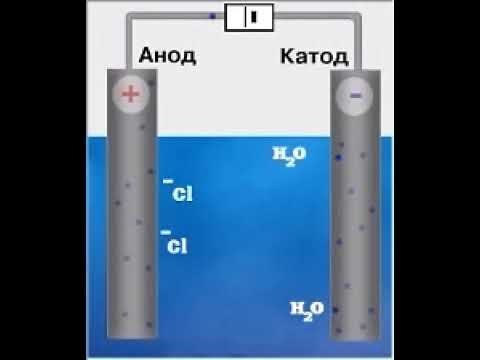
электролиз хлорида натрияСкачать
Гидролиз солей. 9 класс.Скачать