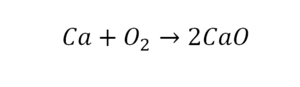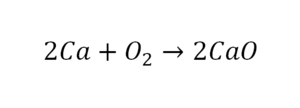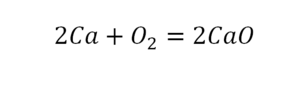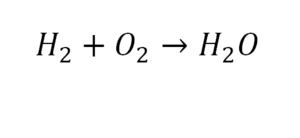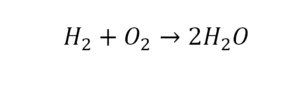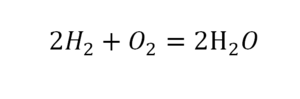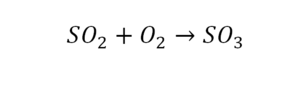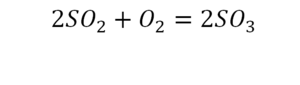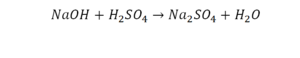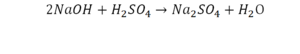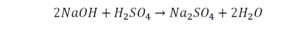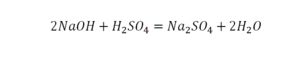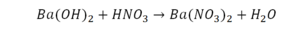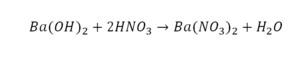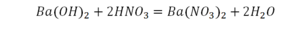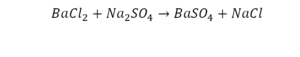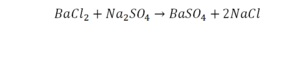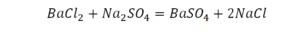Необходимо расставить коэффициенты в химических реакциях и написать их тип. Всего будет 114 реакций. Вторая пачка реакций приведены ниже.
28. Fe(OH)3 = Fe2O3 + H2O
29. NH3 = N2 + H2
30. KNO3 + C = KNO2 + CO2
31. CaO + C = CaC2 + CO
32. Al + H2SO4 = Al2(SO4)3 + H2
33. SO2 + O2 = SO3
34. Ba + H2O = Ba(OH)2 + H2
35. KNO3 = KNO2 + O2
36. Ca + O2 = CaO
37. FeCl2 + Cl2 = FeCl3
38. Fe + HCl = FeCl2 + H2
39. MgCO3 = MgO + CO2
40. KOH + H2SO4 = K2SO4 + H2O
41. Fe(OH)3 + HCl = FeCl3 + H2O
42. AgNO3 + Cu = Cu(NO3)2 + Ag
43. NO + O2 = NO2
44. N2O5 = NO2 + O2
45. MnO2 + C = Mn + CO
46. Fe2O3 + H2 = Fe + H2O
47. N2O5 + H2O = HNO3
48. Al + HCl = AlCl3 + H2
49. Mg + SiO2 = MgO + Si
50. H2O2 = H2O + O2
51. Cr + O2 = Cr2O3
52. CrO3 = Cr2O3 + O2
53. KBrO3 = KBr + O2
54. CuCl2 + Al = AlCl3 + Cu
28. 2Fe(OH)3 = Fe2O3 + 3H2O разложение
29. 2NH3 = N2 + 3H2 разложение
30. 2KNO3 + C = 2KNO2 + CO2 обмен
31. CaO + 3C = CaC2 + CO обмен
32. 2Al + 3H2SO4 = Al2(SO4)3 +3H2 замещение
33. 2SO2 + O2 = 2SO3 соединение
34. Ba + 2H2O = Ba(OH)2 + H2 замещение
35. 2KNO3 = 2KNO2 + O2 разложение
36. 2Ca + O2 = 2CaO соединение
37. 2FeCl2 + Cl2 = 2FeCl3 соединение
38. Fe + 2HCl = FeCl2 + H2 замещение
39. MgCO3 = MgO + CO2 разложение
40. 2KOH + H2SO4 = K2SO4 + 2H2O обмен
41. Fe(OH)3 + 3HCl = FeCl3 + 3H2O обмен
42. 2AgNo# + Cu = Cu(NO3)2 + 2Ag замещение
43. 2NO + O2 = 2NO2 соединение
44. 2N2O5 = 4NO2 + O2 разложение
45. MnO2 + 2C = Mn + 2CO замещение
46. Fe2O3 + 3H2 = 2Fe + 3H2O замещение
47. N2O5 + H2O = 2HNO3 соединение
48. 2Al + 6HCl = 2AlCl3 + 3H2 замещение
49. 2Mg + SiO2 = 2MgO + Si замещение
50. 2H2O2 = 2H2O + O2 разложение
51. 4Cr + 3O2 = 2Cr2O3 соединение
52. 4CrO3 = 2Cr2O3 + 3O2 разложение
53. 2KBrO3 = 2KBr + 3O2 разложение
54. 3CuCl2 + 2Al = 2AlCl3 + 3Cu замещение
- Коэффициенты в химических уравнениях часть 1
- Как расставлять коэффициенты в химических уравнениях
- Пример разбора простых реакций
- Видео: Коэффициенты в уравнениях химических реакций.
- Видео: Расстановка коэффициентов в химическом уравнении
- Сложные реакции
- Видео: Составление уравнений химических реакций
- Видео: Химические уравнения. Как составлять химические уравнения.
- Видео: Балансирование химических уравнений.
- 🎦 Видео
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Коэффициенты в химических уравнениях часть 1
Необходимо расставить коэффициенты в химических реакциях и написать их тип. Всего будет 114 реакций. Первые 27 реакций приведены ниже.
Задание:
1. Fe + Br2 = FeBr2
2. Mg + HI = MgI2 + H2
3. BaCO3 = BaO + CO2
4. Al(OH)3 + H2SO4 = Al2(SO4)3 + H2O
5. Cr2(SO4)3 + LiOH = Cr(OH)3 + Li2SO4
6. Mn(OH)4 = MnO2 + H2O
7. Fe + CuCl2 = C4 + FeCl2
8. Na + P = Na3P
9. KNO3 = KNO2 + O2
10. Al + O2 = Al2O3
11. Al + H2SO4 = Al2(SO4)3 + H2
12. Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
13. P + Br2 = PBr5
14. Ag2O = Ag + O2
15. Fe(OH)3 = Fe2O3 + H2O
16. NH3 = N2 + H2
17. SO2 + O2 = SO5
18. Na + H2O = NaOH + H2
19. LiNO3 = Li2O + NO2 + O2
20. Cu + O2 = CuO
21. CuSO4 + NaOH = Cu(OH)2 + Na2SO4
22. Fe(OH)3 = Fe2O3 + H2O
23. Fe + CuCl2 = Cu + FeCl3
24. Na + S = Na2S
25. CuO + HBr = CuBr2 + H2O
26. CO + O2 = CO2
27. Hg2O = Hg + O2
Решение:
1. Fe + Br2 = FeBr2 соединение
2. Mg + 2HI = MgI2 + H2 замещение
3. BaCO3 = BaO + CO2 разложение
4. 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O обмен
5. Cr2(SO4)3 + 6LiOH = 2Cr(OH)3 + 3Li2SO4 обмен
6. Mn(OH)4 = MnO2 + 2H2O разложение
7. Fe + CuCl2 = C4 + FeCl2 замещение
8. 3Na + P = Na3P соединение
9. 2KNO3 = 2KNO2 + O2 разложение
10. 4Al + 3O2 = 2Al2O3 соединение
11. 2Al + 3H2SO4 = Al2(SO4)3 + 3H2 замещение
12. Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O обмен
13. 2P + 5Br2 = 2PBr5 соединение
14. 2Ag2O = 4Ag + O2 разложение
15. 2Fe(OH)3 = Fe2O3 + 3H2O разложение
16. 2NH3 = N2 + 3H2 разложение
17. 2SO2 + 3O2 = 2SO5 соединение
18. 2Na + 2H2O = 2NaOH + H2 замещение
19. LiNO3 = Li2O + NO2 + O2 разложение
20. 2Cu + O2 = 2CuO соединение
21. CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 обмен
22. 2Fe(OH)3 = Fe2O3 + 3H2O разложение
23. 2Fe + 3CuCl2 = 3Cu + 2FeCl3 замещение
24. 2Na + S = Na2S соединение
25. CuO + 2HBr = CuBr2 + H2O обмен
26. 2CO + O2 = 2CO2 соединение
27. 2Hg2O = 4Hg + O2 разложение
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Как расставлять коэффициенты в химических уравнениях
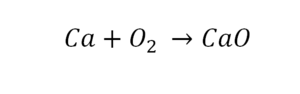
Такая запись является схемой химической реакции. Когда возникает знак «=», то это называется «уравнение». Попробуем его решить.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Пример разбора простых реакций
В кальции один атом, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. С правой стороны уравнения Са тоже один. По кальцию нам не надо работать.
Видео: Коэффициенты в уравнениях химических реакций.
Смотрим следующий элемент — кислород. Индекс 2 говорит о том, что здесь 2 иона кислорода. С правой стороны нет индексов, то есть одна частица кислорода, а с левой — 2 частицы. Что мы делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты — это то, что написано перед наименьшей частью. Они имеют право меняться. Для удобства саму формулу не переписываем. С правой части один умножаем на 2, чтобы получить и там 2 иона кислорода.
После того как мы поставили коэффициент, получилось 2 атома кальция. С левой стороны только один. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество атомов элементов равно с обеих сторон, то можем поставить знак «равно».
Другой наглядный пример: два водорода слева, и после стрелочки у нас тоже два водорода.
Смотрим дальше:
- Два кислорода до стрелочки, а после стрелочки индексов нет, значит, один.
- Слева больше, а справа меньше.
- Ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось два атома водорода. И чтобы получить 4, мы должны водород умножить на два.
Видео: Расстановка коэффициентов в химическом уравнении
Вот тот случай, когда элемент в одной и в другой формуле с одной стороны, до стрелочки.
Один ион серы слева, и один ион — справа. Две частицы кислорода, плюс еще две частицы кислорода. Значит, что с левой стороны 4 кислорода. Справа же находится 3 кислорода. То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. Для этого умножаем на два всю формулу после стрелочки. После умножения получаем шесть ионов кислорода, да еще и 2 атома серы. Слева же имеем одну микрочастицу серы. Теперь уравняем ее. Ставим слева уравнения перед серой 2.
Уравняли.
Видео:Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Сложные реакции
Этот пример более сложный, так как здесь больше элементов вещества.
Это называется реакцией нейтрализации. Что здесь нужно уравнивать в первую очередь:
- С левой стороны один атом натрия.
- С правой стороны индекс говорит о том, что здесь 2 натрия.
Напрашивается вывод, что надо умножить всю формулу на два.
Видео: Составление уравнений химических реакций
Теперь смотрим, сколько серы. С левой и правой стороны по одной. Обращаем внимание на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем 2.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны также 6 атомов. Проверяем водород. Два атома водорода и еще 2 атома водорода. То есть будет четыре атома водорода с левой стороны. И с другой стороны также четыре атома водорода. Все элементы уравнены. Ставим знак «равно».
Видео: Химические уравнения. Как составлять химические уравнения.
Здесь пример интересен тем, что появились скобки. Они говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на него. Начать необходимо с азота, так как его меньше, чем кислорода и водорода. Слева азот один, а справа, с учетом скобок, его два.
Справа два атома водорода, а нужно четыре. Мы выходим из положения, просто умножая воду на два, в результате чего получили четыре водорода. Отлично, водород уравняли. Остался кислород. До реакции присутствует 8 атомов, после — тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Последний пример.
На очереди у нас барий. Он уравнен, его трогать не нужно. До реакции присутствует два хлора, после нее — всего один. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Видео: Балансирование химических уравнений.
Теперь за счет коэффициента, который только что поставлен, после реакции получилось два натрия, и до реакции тоже два. Отлично, все остальное уравнено.
Также уравнивать реакции можно методом электронного баланса. Этот метод имеет ряд правил, по которым его можно осуществлять. Следующим действием мы должны расставить степени окисления всех элементов в каждом веществе для того, чтобы понять где произошло окисление, а где восстановление.
🎦 Видео
Химические уравнения 8 класс - как расставить коэффициенты ?Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

8 класс. Составление уравнений химических реакций.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как уравнивать коэффициенты (химия)Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как уравнивать коэффициенты.(Химия)Скачать

Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

8 класс - Химия - Химические уравнения. Правила подбора коэффициентовСкачать

Как расставлять коэффициенты в химических уравненияхСкачать

Расстановка коэффициентов в уравнениях химических реакций. (Химия 8 класс) Учитель:К.А. ВысоцкаяСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать