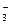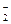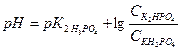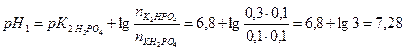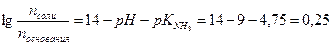Если к 1 л смеси CH3COOH и CH3COONa с концентрациями 0,1 М, прибавить 0,01 моль HCl, протекает реакция:
CH3COONa + HCl → CH3COOH + NaCl.
В результате качественный состав буферной смеси практически не изменяется. Концентрация ионов H + в растворе сильно не увеличится, так как они будут связываться ионами CH3COO — соли в недиссоциированные молекулы слабой кислоты CH3COOH, при этом рН раствора понизится с 4,73 до 4,64, то есть разница составит 0,09 единиц: рН=4,76−lg(0,11/0,09)= 4,64. Если 0,01 моль HCl прибавить к 1 л чистой воды, произойдет понижение рН от 7 до 2, то есть разница составит 5 единиц.
Если к 1 л ацетатной буферной смеси прибавить 0,01 моль NaOH, то протекает реакция: CH3COOH + NaOH → CH3COONa + Н2О.
Ионы OH — щелочи будут связываться ионами H + уксусной кислоты. И в этом случае рН раствора изменится мало – повысится с 4,73 до 4,82 единиц: рН=4,76−lg(0,09/0,11)= 4,84. Прибавление 0,01 моль NaOH к 1 л чистой воды повышает рН от 7 до 12, то есть разница составляет 5 единиц.
Если к 1 л 0,1 М раствора HCl прибавить 0,01 моль NaOH, то концентрация ионов H + понизится до величины 0,1-0,01=0,09 моль/л, а рН раствора повысится с 1 до 1,05, то есть разница составит 0,05 единиц.
Не происходит заметного изменения рН и при разбавлении буферных растворов водой.
Пример. Рассчитать, как изменится рН смеси, состоящей из CH3COOH и CH3COONa и содержащей по 0,1 моль каждого из веществ: а) при разбавлении смеси водой в 100 раз; б) при увеличении концентрации CH3COOH в 10 раз; в) при увеличении концентрации CH3COONa в 10 раз.
Решение. рН ацетатного буфера рассчитывается по формуле
а) при разбавлении раствора в 100 раз: рН=4,76−lg(0,001/0,001)= 4,76;
б) концентрация кислоты стала 1 моль/л: рН=4,76−lg(1/0,1)= 3,76;
в) концентрация соли стала 1 моль/л: рН=4,76−lg(0,1/ 1)= 5,76.
В химическом анализе используется большой набор буферных смесей, позволяющих поддерживать рН в необходимых пределах. Состав и характеристики наиболее часто встречающихся буферных растворов приведены в таблице:
| Название смеси | Состав буферной смеси | Рабочая область рН | |
| Названия веществ | Формулы | ||
| Формиатная | Муравьиная кислота и формиат натрия | HCOOH HCOONa | 2,7-4,7 |
| Бензоатная | Бензойная кислота и бензоат натрия | C6H5COOH C6H5COONa | 3,2-5,2 |
| Ацетатная | Уксусная кислота и ацетат натрия | CH3COOH CH3COONa | 3,7-5,7 |
| Фосфатная | Дигидрофосфат натрия и гидрофосфат натрия | NaH2PO4 NaHPO4 | 5,8-7,8 |
| Аммиачная | Гидроксид аммония и хлорид аммония | NH4OH NH4Cl | 8,2-10,2 |
Методики приготовления буферных растворов с различными значениями рН приведены в справочнике по аналитической химии.
Контрольные вопросы
1. Какие растворы называются буферными?
2. Рабочая область рН буферного раствора.
3. Буферная емкость.
4. Типы буферных растворов.
5. Формулы для расчета рН кислотной и щелочной буферных смесей.
6. Какое значение имеют буферные растворы в химическом анализе?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. — М.: Дрофа, 2005. — С. 112 – 117.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.106 — 108.
3. Лурье Ю.Ю. Справочник по аналитической химии. — М.: Химия, 1989. – С. 267 — 275.
Видео:pH и буферные растворы | Медицинская химия | МедвузаСкачать

Значение рН различных систем
| Среды организма | рН |
| Сыворотка крови | 7,36-7,44 |
| Чистый желудочный сок | 0,9 |
| Сок поджелудочной железы | 7,5-7,8 |
| Желчь в протоках | 7,4-8,5 |
| Желчь в пузыре | 5,4-6,9 |
| Моча | 4,8-7,5 |
| Молоко | 6,6-6,9 |
| Дистиллированная вода, находящаяся в равновесии с воздухом | 5,5 |
| Морская вода | 8,0 |
| Свежий яичный белок | 8,0 |
Значение рН, благоприятные для развития патогенных бактерий
| Вид бактерий | рН |
| Стафилококки | 7,4 |
| Стрептококки | 7,4-76 |
| Пневмококки | 7,6-7,8 |
| Менингококки | 7,4-7,6 |
| Гонококки | 7,0-7,4 |
В организме человека присутствуют различные буферные системы. Из них наиболее важными являются: гидрокарбонатная, гемоглобиновая, фосфатная и белковая.
Гидрокарбонатная система образована оксидом углерода (IV) (как кислота) и гидрокарбонат-ионом (как сопряженное основание). Для гидрокарбонатного буфера рН рассчитывают по формуле:
Это уравнение носит название уравнения Гендерсона-Гассельбаха. Значение рК 
С учетом коэффициента растворимости СО2 получим другую форму уравнения Гендерсона-Гассельбаха:


В организме протекает обратимая реакция:
СО2 + Н2О « Н2СО3 « Н + + НСО
Она ускоряется ферментом карбоангидразой. Изменение концентрации любой составной части этого буфера приводит к смещению равновесия и соотношение концентраций остается постоянным. Буферная емкость гидрокарбонатного буфера по кислоте значительно выше, чем буферная емкость по основанию. Поэтому главное назначение этого буфера в нейтрализации кислот.
Гидрокарбонатный буфер является основной буферной системой плазмы крови и является системой быстрого реагирования, т.к. продукт его взаимодействия с кислотами – СО2 быстро выводится через легкие. Гидрокарбонатный буфер также содержится в эритроцитах, почечной ткани и интерстициальной жидкости.
Гемоглобиновая буферная система представлена двумя слабыми кислотами – гемоглобином и оксигемоглобином – и сопряженными им основаниями, соответственно гемоглобинат- и оксигемоглобинат-ионами:
HHbO2 « H + + HbO
Гемоглобиновый буфер является буферной системой эритроцитов. Оксигемоглобин – более сильная кислота (рКа=6,95), чем гемоглобин (рКа=8,20). Поэтому присоединение кислорода к гемоглобину понижает рН крови. С другой стороны, при отдаче кислорода в тканях рН крови вновь возрастает.
Фосфатная буферная система функционирует в основном в плазме. Она представлена ионами Н2РО 

В организме также функционируют:
· белковая или протеиновая;
· аммиачная (в почках) буферные системы.
Разбор типовых задач
1. Вычислите рН фосфатного буфера, составленного 100 мл 0,1 М КН2РО4 и 50 мл 0,15 М К2НРО4.
Решение: Расчет рН фосфатного буфера проводим по формуле:
Значение 
Так как концентрация вещества пропорциональна количеству вещества:
то в формулу подставим количества вещества КН2РО4 и К2НРО4.
2. При смешении 10 мл 0,1 М формиата натрия с 5 мл 0,05 М раствора НС1 был получен формиатный буфер. Рассчитайте значение рН этого раствора.
Решение: При смешении этих растворов протекает реакция:
HCOONa + HCl = HCOOH + NaCl
Из расчета количества вещества видно, что HCOONa в избытке.
nHCOONa = 0,01×0,1 = 0,001 моль
nНС1 = 0,005×0,05 = 0,00025 моль
После реакции формиата натрия останется:
nHCOONa = 0,001 — 0,00025 = 0,00075 моль
Вместе с образовавшейся муравьиной кислотой формиат натрия образует формиатный буфер nHCOOН = nНС1 = 0,00025 моль.
Расчет рН ведем по формуле:
Здесь учли, что рКНСООН = 3,75.
3. Как изменится рН фосфатного буфера, содержащего 100 мл дигидрофосфата калия и 300 мл раствора гидрофосфата калия (концентрации исходных растворов равны по 0,1 моль/л), при добавлении к нему 20 мл раствора NaOH с концентрацией 0,1 моль/л?
Решение: Сначала рассчитаем значение рН исходного раствора:
При добавлении NaOH с ним в первую очередь взаимодействует КН2РО4 по схеме:
Часть дигидрофосфата переходит в гидрофосфат.


После реакции дигидрофосфата калия останется:
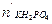
Общее количество гидрофосфата станет:

Рассчитаем рН полученного раствора:
Изменение рН составит:
4. В каком мольном соотношении надо смешать аммиак и хлорид аммония, чтобы получить буферный раствор с рН = 9,0, если рК 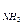
Решение: Расчет рН аммонийного буфера проводят по формуле:
Подставляя значения рН и рК 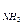
Следовательно, мольное соотношение NH4Cl к NH3 должно быть:
n 
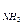
5. К 100 мл крови для изменения рН от 7,36 до 7,00 надо дабавить 3,6 мл соляной кислоты с концентрацией 0,1 моль/л. Какова буферная емкость крови по кислоте?
Решение: Расчет буферной емкости по кислоте проводят по формуле:
Лабораторная работа
Задание 1. Приготовление буферного раствора.
В три пробирки внесите 0,1 М растворы СН3СООН и СН3СООNa в соотношении (по объему): 9:1, 5:5 и 1:9. Каждый приготовленный раствор хорошо перемешать. Во все три пробирки прибавьте по 3 капли индикатора метилового оранжевого или метилового красного. Сравните и запишите окраску растворов. По известной формуле рассчитайте значения рН во всех трех растворах. В каких пределах изменилось значение рН?
Задание 2. Влияние разбавления на рН буферных растворов.
Приготовьте 3 раствора ацетатного буфера в соотношении 9:1, 5:5 и 1:9 как в предыдущем опыте. Затем в 3 чистые пробирки отберите по 2 мл приготовленных буферных растворов и добавьте в каждую из них по 8 мл дистиллированной воды. Растворы хорошо перемешайте. Во вновь приготовленные растворы (с разбавлением) добавьте по 3 капли индикатора метилового красного как и в первом случае. Сравните окраски растворов между собой и с первыми тремя пробирками. Сделайте заключение по окраске содержимого пробирок. С учетом разбавления исходных растворов вновь рассчитайте значения рН полученных растворов. Результаты наблюдений и расчетов внесите в таблицу по форме и сделайте выводы.
| Номера пробирок |
| Соотношение кислота : соль в буферном растворе |
| Окраска растворов после добавления индикатора |
| Расчетное значение рН |
Задание 3. Определение буферной емкости по кислоте и по щелочи.
В конической колбе приготовьте буферный раствор, смешав 10 мл 0,1 М СН3СООН и 10 мл 0,1 М раствора СН3СООNa. В другой колбе приготовьте раствор – свидетель, смешивая 18 мл 0,1 М СН3СООН и 2 мл 0,1 М СН3СООNa.
В обе колбы внесите по 3 капли раствора метилового оранжевого. Сравните окраску растворов. Затем содержимое первой колбы титруйте из бюретки 0,1 М раствором НС1 до получения одинаковой окраски с раствором – свидетелем. Запишите затраченный объем раствора НС1 и рассчитайте по известной формуле буферную емкость ацетатного буфера. Значение рН содержимого 1 и 2 колб берите из расчетных величин 2 и 3 пробирок (см. табл. из пред. задания). Бюретку с 0,1 М раствором НС1 надо приготовить соблюдая правила ацидометрии параллельно с приготовлением содержимого 1 и 2 колб.
Для определения емкости ацетатного буфера по щелочи надо приготовить колбу с содержанием 10 мл 0,1 М СН3СООН и 10 мл 0,1 М СН3СООNa и раствор – свидетель (другая колба), содержащий 18 мл 0,1 М СН3СООNa и 2 мл 0,1 М СН3СООН. После добавления 3 капель раствора метилового оранжевого в каждую колбу, содержимое 1-ой колбы титруйте из бюретки 0,1 М раствором NaOH до одинаковой окраски с раствором – свидетелем. Записав объем затраченного раствора NaOH рассчитайте буферную емкость по щелочи. Значения рН содержимого 1-ой и 2-ой колб берите из расчетных величин 2 и 1 пробирок (см. табл. из пред. задания). Бюретку с 0,1 М раствором NaOH надо приготовить соблюдая правила алкалиметрии параллельно с приготовлением содержимого 1-ой и 2-ой колб.
Сравните буферную емкость ацетатного буфера по кислоте и по щелочи. Сделайте выводы.
Видео:Буферные растворы. 1 часть. 11 класс.Скачать

Вычисление концентраций кислоты и соли для получения буферной смеси
Видео:Буферные системы, ацидоз и алкалоз, ур-ие Гендерсона-Гассельбаха (Атриум и Учим химию)Скачать

Получение буферной системы
Задача 45.
Вычислите, в каком соотношении надо смешать ацетат натрия и уксусную кислоту, чтобы получить буферный раствор с рН = 5,00.
Решение:
KD(CH3COOH) = 1,78 · 10 –5 .
Зная рН раствора можно рассчитать концентрацию ионов водорода Н+, получим:
рН = 5,00, [H + ] = 10 -5 = 10 -5 · 0,00 = 1 · 10 –5 моль/дм 3 .
Для буферных растворов, образованных слабой кислотой и солью этой кислоты, [Н + ] находят по формуле:
Из этого выражения вычислим, в каком соотношении надо смешать ацетат натрия (CH3COONa) и уксусную кислоту (CH3COOН), чтобы получить буферный раствор с рН = 5,00, получим:
Таким образом, для получения буферного раствора с рН = 5 надо смешать CH3COOH и CH3COONa в отношении 1:1,8, т.е. на 1,0 частей CH3COOH надо взять 1,8 частей CH3COONa.
Формиатный буферный раствор
Задача 46.
Формиатный буферный раствор имеет рН = 5,50. Рассчитайте соотношение концентраций муравьиной кислоты и формиата натрия в этом растворе, если КD = 1,77 · 10 –4 .
Решение:
KD(НCOOH) = 1,77 · 10–4
рН = 5,50, [H + ] = 10 –5 ,50 = 10 –6 · 0,50 = 3,16 · 10 –6 моль/дм 3 . Из формулы примера [H + ] = КD . Ск/Сс следует:
Таким образом, для получения буферного раствора с рН = 5,5 надо смешать НCOOH и НCOONa в отношении 0,018:1 = 1:55,5, т.е. на 1 часть НCOOH нужно взять примерно 55,5 частей НCOONa.
Задача 47
Вычислите рН раствора, полученного смешенного 38 см 3 6,2 Н. раствора уксусной кислоты и 2 см 3 2,0 Н. раствора ацетата натрия.
Решение:
Получается буферный раствор — смесь слабой кислоты и ее соли (анионов слабой кислоты):
рН = рКа + lg[соли]/[кислоты])
СM = СН/z, где z — число эквивалентности.
Для кислоты число эквивалентности (z) равно основности, для соли — числу катионов или анионов, умноженному на заряд соответствующего иона.
Уксусная кислота — одноосновная, поэтому z = 1.
В формулеле ацетата натрия имеется по 1 иону с единичным зарядом, поэтому для ацетата натрия z = 1.
Соответственно, для уксусной кислоты и ацетата натрия СН = СМ.
При смешивании растворов получен буферный раствор объемом 40 см 3 (38 + 2 = 40) = 0,04 дм 3 .
CМ(CH3COONa) = [CН(CH3COONa) . V(CH3COONa)]/V(буф.) = (6,2 . 0,038)/0,04 = 5,89 М;
CМ(CH3COOH) = [CН(CH3COOH) . V(CH3COOH)]/V(буф.) = (2 . 0,002)/0,04 = 0,10 М.
СM(CH3COONa, буф.) =CН(CH3COOH) . V(CH3COOH)]/V(буф.) = 6,2 . 0,019 /0,02 = 5,89 М;
СM(CH3COOH, буф.) = CН(CH3COONa) . V(CH3COONa)/V(буф.) = 2 . 0,001 / 0,02 = 0,1 М.
рКа (CH3COOH) = 4,76;
рН = 4,76 + lg(5,89/0,1) = 6,53.
Ответ: рН = 6,53.
📽️ Видео
лекция 4 Протолитическая теория Буферные системы Решение задачСкачать

Нормальная физиология | Регуляция кислотно-основного состояния крови. Буферные системы кровиСкачать

Расчёты pH буферных растворов (видео 5) | Буферные растворы | ХимияСкачать

Буферные системыСкачать

Буферные растворы. 2 часть. 11 класс.Скачать

Буферные растворыСкачать

Буферные растворы и уравнение Хендерсона-Хассельбаха (видео 4) | Буферные растворы | ХимияСкачать

Буферные растворы. Практическая часть. 11 класс.Скачать

Буферная ёмкость (видео 7) | Буферные растворы | ХимияСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Оптические свойства дисперсных системСкачать

Буферные системы. рНСкачать

рН и буферы 22.10.22Скачать

Химия 3.Буферные растворыСкачать

Буферные системыСкачать

Буферные системы крови I Медицинская химияСкачать