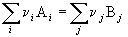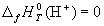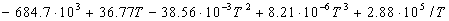- Рассчитайте энергию связи в оксиде фтора
- Вычислите энергию связи H-S в молекуле H2S
- Расчет энергии связи N-H в молекуле аммиака
- Рассчитать энтальпию связи в молекуле no на основании следующих термохимических уравнений
- Энергетика химических процессов. Закон Гесса
- Тепловой эффект процесса
- Термохимические уравнения
- Закон Гесса
- Следствия из закона Гесса
- Стандартные термодинамические величины
- Стандартные энтальпии образования и сгорания
- Примеры решения задач
- Задачи для самостоятельного решения
- Рассчитать энтальпию связи в молекуле no на основании следующих термохимических уравнений
- 📹 Видео
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Рассчитайте энергию связи в оксиде фтора
Задача 136.
Теплота образования F2O из простых веществ при стандартных условиях составляет 22 КДж/моль. Рассчитайте энергию связи O-F в молекуле фторида кислорода,если энергия связей в молекулах O2 и F2 составляет соответственно 498 и 159 КДж/моль.
Решение:
Уравнение реакции образования оксида фтора имеет вид:
Образование двух молекул F2O можно представить как последовательный процесс разрыва связей F-F в молекуле F2 и связей
O-O в молекуле O2:
4F* + 2O* → 2F2O + 4D(O-F), где
D(F-F), D(O-O) и D(O-F) – энергии образования связей F-F, O-O и O-F, соответственно. Суммируя левые и правые части приведенных уравнений, приходим к термохимическому уравнению:
Согласно закону Гесса тепловой эффект этой реакции равен:
2Q = –2D(F-F) – D(O-O) + 4D(F-O),
D(O-F) = [2Q + 2D(F-F) + D(O-O)]/4 = [44 + (2 . 159) + 498]/4 = 215 кДж/моль.
Вычислите энергию связи H-S в молекуле H2S
Задача 137.
Вычислите энергию связи H-S в молекуле H2S по следующим данным: 2H2 (г) + S2(г) = 2H2S (г) – 40,30 кДж; энергии связей D(H-H) и D(S-S) соответственно равны –435,9 кДж/моль и – 417,6 кДж/моль.
Решение.
Образование двух молекул H2S можно представить как последовательный процесс разрыва связей H-H в молекуле H2 и связей S-S в молекуле S2:
где D(H-H), D(S-S) и D(S-H) – энергии образования связей H-H, S-S и S-Н, соответственно. Суммируя левые и правые части приведенных уравнений, приходим к термохимическому уравнению:
Тепловой эффект этой реакции равен:
2Q = –2D(H-H) – D(S-S) + 4D(S-H), откуда
D(S-H) = [2Q + 2D(H-H) + D(S-S)]/4 = [(2 . 40,30) + (2 . –435,9) + 417,6]/4 = 232,43 кДж/моль.
Расчет энергии связи N-H в молекуле аммиака
Задача 138.
Стандартная энтальпия образования NH3 составляет 46 кДж/моль. Рассчитайте энергию связи N-H в молекуле аммиака, если энергии связей в молекулах H2 и N2 составляют соответственно 436 и 945 кДж/моль.
Решение:
Уравнение реакции образования оксида фтора имеет вид:
Образование двух молекул NH3 можно представить как последовательный процесс разрыва связей H-H в молекуле H2 и связей N-N в молекуле N2:
6H* + 2N* → 2NH3 + 6D(H-N), где
D(H-H), D(N-N) и D(H-N) – энергии образования связей F-F, O-O и O-F, соответственно. Суммируя левые и правые части приведенных уравнений, приходим к термохимическому уравнению:
Согласно закону Гесса тепловой эфaект этой реакции равен:
D(H-N) = [2Q + 3D(H-H) + D(N-N)]/6 = [(2 . 46) + (3 . 436) + 945]/6 = 390 кДж/моль.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Рассчитать энтальпию связи в молекуле no на основании следующих термохимических уравнений
Определение энтальпий связей
Для определения энтальпий связей используются спектроскопические методы (см. разд. 17.1), методы электронного удара (см. разд. 1.2) либо термохимические методы. Термохимические методы включают калориметрическое определение энтальпий сгорания, образования и других процессов. Данные затем для вычисления энтальпий связей. Энтальпии связей не поддаются определению прямыми термохимическими измерениями.
Экспериментальным подтверждением согласованности и приблизительного постоянства энтальпий связей в широком ряду соединений могут служить стандартные молярные энтальпии сгорания в гомологическом ряду алканов (см. разд. 17.1). Если построить график зависимости энтальпий сгорания алканои от числа атомов углерода, входящих в состав каждого из них, получится прямая линия (рис. 5.12). Разность между стандартными молярными энтальпиями сгорания каждых двух последовательных членов ряда алканов составляет приблизительно 660 кДж/моль (табл. 5.7). По своему строению каждый следуюишй член ряда алканов отличается от предыдущего члена дополнительной группой —CH2—. Следовательно, величина 660 кДж/моль соответствует диссоциации и образованию связей при сгорании одного моля групп —CH2—. Сгорание каждой группы —CH2—включает: 1) диссоциацию двух связей С—Н; 2) диссоциацию одной связи С—С; 3) образование двух двойных связей C=O при образовании молекулы CO2; 4) образование двух связей H—О при образовании молекулы H2O.
Приблизительное постоянство величины 660 кДж/моль в ряду алканов указывает на то, что энтальпии связей С—С и С—H в этом ряду хорошо согласуются между собой.
Определение средней энтальпии связи С—H
Для того чтобы определить среднюю энтальпию связи С—H из экспериментальных данных, можно воспользоваться стандартной энтальпией атомизации метана
Эта стандартная энтальпия атомизации в четыре раза больше средней энтальпии связи
Стандартную энтальпию атомизации метана можно вычислить с помощью закона Гесса, если известны экспериментальные значения стандартных энтальпий следующих процессов:
1. Стандартная энтальпия атомизации графита
Эта энтальпия установлена путем измерения температурной зависимости давления паров графита.
2. Стандартная энтальпия атомизации водорода
Эту энтальпию можно определить спектроскопическими методами.
3. Стандартная энтальпия образования метана
Эту величину можно вычислить из стандартной энтальпии сгорания метана и стандартных энтальпий образования диоксида углерода и воды. Все эти три энтальпии можно определить экспериментально калориметрическими методами.
Применим теперь закон Гесса в форме, описываемой уравнением (12), к процессу атомизации метана:
Теперь воспользуемся уравнением (13) и получим
Сведения, которыми необходимо располагать для вычисления средней энтальпии связи С—Н, можно представить в графической форме с помощью энтальпийной диаграммы (рис. 5.13).
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Энергетика химических процессов. Закон Гесса
Материалы портала onx.distant.ru
Видео:Закон Гесса. 10 класс.Скачать

Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Видео:Внутренняя энергия и энтальпия. 10 класс.Скачать

Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Видео:Внутренняя энергия и энтальпия. Расчет энтальпии. Практическая часть. 10 класс.Скачать

Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Видео:Как рассчитать стандартную энтальпию образования вещества | Физическая химияСкачать

Следствия из закона Гесса
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Видео:Энтальпия реакции. Решение задачи.Скачать

Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Видео:Энтропия. 10 класс.Скачать

Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например , ΔН o f,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Видео:78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
- умножить на 3/2 второе уравнение и соответствующую ему величину δН o , изменив ее знак на противоположный:
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
ΔН о х = ΔН о 1 – ΔН о 2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Видео:Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать

Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Рассчитать энтальпию связи в молекуле no на основании следующих термохимических уравнений
Термохимия изучает тепловые эффекты химических реакций. Во многих случаях эти реакции протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота является функцией состояния. При постоянном объеме теплота равна изменению внутренней энергии:
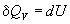
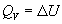
а при постоянном давлении — изменению энтальпии:
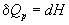
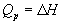
Эти равенства в применении к химическим реакциям составляют суть закона Гесса:
Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции.
Другими словами, тепловой эффект химической реакции равен изменению функции состояния.
В термохимии, в отличие от других приложений термодинамики, теплота считается положительной, если она выделяется в окружающую среду, т.е. если H . RT, (3.4)
где n — изменение числа молей газов в реакции.
Для того, чтобы облегчить сравнение энтальпий различных реакций, используют понятие «стандартного состояния». Стандартное состояние — это состояние чистого вещества при давлении 1 бар (= 10 5 Па) и заданной температуре. Для газов — это гипотетическое состояние при давлении 1 бар, обладающее свойствами бесконечно разреженного газа. Энтальпию реакции между веществами, находящимися в стандартных состояниях при температуре T, обозначают 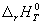
Из закона Гесса вытекают важные следствия, которые позволяют рассчитывать энтальпии химических реакций.
Следствие 1. Стандартная энтальпия химической реакции
равна разности стандартных энтальпий образования продуктов реакции и реагентов (с учетом стехиометрических коэффициентов):
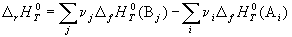
Стандартной энтальпией (теплотой) образования вещества 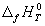
Понятия «энтальпия образования» используют не только для обычных веществ, но и для ионов в растворе. При этом за точку отсчета принят ион H + , для которого стандартная энтальпия образования в водном растворе полагается равной нулю:
Следствие 2. Стандартная энтальпия химической реакции
равна разности энтальпий сгорания реагентов и продуктов реакции (с учетом стехиометрических коэффициентов):
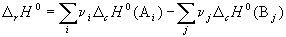
(c означает «combustion»). Стандартной энтальпией (теплотой) сгорания вещества называют энтальпию реакции полного окисления одного моля вещества. Это следствие обычно используют для расчета тепловых эффектов органических реакций.
Следствие 3. Энтальпия химической реакции равна разности энергий разрываемых и образующихся химических связей.
Энергией связи A- B называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечное расстояние:
AB(г) A(г) + B(г).
Энергия связи всегда положительна.
Большинство термохимических данных в справочниках приведено при температуре 298 К. Для расчета тепловых эффектов при других температурах используют уравнение Кирхгофа:
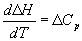
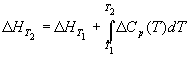
где Cp — разность изобарных теплоемкостей продуктов реакции и исходных веществ. Если разница T2 — T1 невелика, то можно принять Cp = const. При большой разнице температур необходимо использовать температурную зависимость Cp(T) типа:
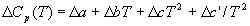
где коэффициенты a, b, c и т.д. для отдельных веществ берут из справочника, а знак обозначает разность между продуктами и реагентами (с учетом коэффициентов).
ПРИМЕРЫ
Пример 3-1. Стандартные энтальпии образования жидкой и газообразной воды при 298 К равны -285.8 и -241.8 кДж/моль, соответственно. Рассчитайте энтальпию испарения воды при этой температуре.
Решение. Энтальпии образования соответствуют следующим реакциям:
H2(г) + ЅO2(г) = H2O(ж), H1 0 = -285.8;
H2(г) + ЅO2(г) = H2O(г), H2 0 = -241.8.
Вторую реакцию можно провести в две стадии: сначала сжечь водород с образованием жидкой воды по первой реакции, а затем испарить воду:
H2O(ж) = H2O(г), H 0 исп = ?
Тогда, согласно закону Гесса,
H1 0 + H 0 исп = H2 0 ,
откуда H 0 исп = -241.8 — (-285.8) = 44.0 кДж/моль.
Ответ. 44.0 кДж/моль.
Пример 3-2. Рассчитайте энтальпию реакции
а) по энтальпиям образования; б) по энергиям связи, в предположении, что двойные связи в молекуле C6H6 фиксированы.
Решение. а) Энтальпии образования (в кДж/моль) находим в справочнике (например, P.W.Atkins, Physical Chemistry, 5th edition, pp. C9-C15): fH 0 (C6H6(г)) = 82.93, fH 0 (C(г)) = 716.68, fH 0 (H(г)) = 217.97. Энтальпия реакции равна:
rH 0 = 82.93 — 6 716.68 — 6 217.97 = -5525 кДж/моль.
б) В данной реакции химические связи не разрываются, а только образуются. В приближении фиксированных двойных связей молекула C6H6 содержит 6 связей C- H, 3 связи C- C и 3 связи C=C. Энергии связей (в кДж/моль) (P.W.Atkins, Physical Chemistry, 5th edition, p. C7): E(C- H) = 412, E(C- C) = 348, E(C=C) = 612. Энтальпия реакции равна:
rH 0 = -(6 412 + 3 348 + 3 612) = -5352 кДж/моль.
Разница с точным результатом -5525 кДж/моль обусловлена тем, что в молекуле бензола нет одинарных связей C- C и двойных связей C=C, а есть 6 ароматических связей C C.
Ответ. а) -5525 кДж/моль; б) -5352 кДж/моль.
Пример 3-3. Пользуясь справочными данными, рассчитайте энтальпию реакции
Решение. Сокращенное ионное уравнение реакции имеет вид:
По закону Гесса, энтальпия реакции равна:
rH 0 = 4 fH 0 (H2O(ж)) + 2 fH 0 (NO(г)) + 3 fH 0 (Cu 2+ (aq)) — 2 fH 0 (NO3 — (aq))
(энтальпии образования меди и иона H + равны, по определению, 0). Подставляя значения энтальпий образования (P.W.Atkins, Physical Chemistry, 5th edition, pp. C9-C15), находим:
rH 0 = 4 (-285.8) + 2 90.25 + 3 64.77 — 2 (-205.0) = -358.4 кДж
(в расчете на три моля меди).
Пример 3-4. Рассчитайте энтальпию сгорания метана при 1000 К, если даны энтальпии образования при 298 К: fH 0 (CH4) = -17.9 ккал/моль, fH 0 (CO2) = -94.1 ккал/моль, fH 0 (H2O(г)) = -57.8 ккал/моль. Теплоемкости газов (в кал/(моль . К)) в интервале от 298 до 1000 К равны:
Решение. Энтальпия реакции сгорания метана
при 298 К равна:
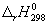
Найдем разность теплоемкостей как функцию температуры:
Cp = Cp(CO2) + 2 Cp(H2O(г)) — Cp(CH4) — 2 Cp(O2) =
= 5.16 — 0.0094T (кал/(моль . К)).
Энтальпию реакции при 1000 К рассчитаем по уравнению Кирхгофа:
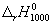
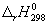
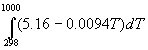
(1000-298) — 0.0094 (1000 2 -298 2 )/2 = -192500 кал/моль.
Ответ. -192.5 ккал/моль.
ЗАДАЧИ
3-1. Сколько тепла потребуется на перевод 500 г Al (т.пл. 658 о С, H 0 пл = 92.4 кал/г), взятого при комнатной температуре, в расплавленное состояние, если Cp(Alтв) = 0.183 + 1.096 10 -4 T кал/(г К)?
3-2. Стандартная энтальпия реакции CaCO3(тв) = CaO(тв) + CO2(г), протекающей в открытом сосуде при температуре 1000 К, равна 169 кДж/моль. Чему равна теплота этой реакции, протекающей при той же температуре, но в закрытом сосуде?
3-3. Рассчитайте стандартную внутреннюю энергию образования жидкого бензола при 298 К, если стандартная энтальпия его образования равна 49.0 кДж/моль.
3-4. Рассчитайте энтальпию образования N2O5(г) при T = 298 К на основании следующих данных:
2NO(г) + O2(г) = 2NO2(г), H1 0 = -114.2 кДж/моль,
4NO2(г) + O2(г) = 2N2O5(г), H2 0 = -110.2 кДж/моль,
N2(г) + O2(г) = 2NO(г), H3 0 = 182.6 кДж/моль.
3-5. Энтальпии сгорания -глюкозы, -фруктозы и сахарозы при 25 о С равны -2802,
-2810 и -5644 кДж/моль, соответственно. Рассчитайте теплоту гидролиза сахарозы.
3-6. Определите энтальпию образования диборана B2H6(г) при T = 298 К из следующих данных:
B2H6(г) + 3O2(г) = B2O3(тв) + 3H2O(г), H1 0 = -2035.6 кДж/моль,
2B(тв) + 3/2 O2(г) = B2O3(тв), H2 0 = -1273.5 кДж/моль,
H2(г) + 1/2 O2(г) = H2O(г), H3 0 = -241.8 кДж/моль.
3-7. Рассчитайте теплоту образования сульфата цинка из простых веществ при T = 298 К на основании следующих данных:
ZnS = Zn + S, H1 0 = 200.5 кДж/моль,
2ZnS + 3O2 = 2ZnO + 2SO2, H2 0 = -893.5 кДж,
2SO2 + O2 = 2SO3, H3 0 = -198.2 кДж/моль,
ZnSO4 = ZnO + SO3, H4 0 = 235.0 кДж/моль.
3-8. Найдите rH 0 298 для реакции
если известны теплоты сгорания метана ( cH 0 (CH4) = -890.6 кДж/моль), хлорметана ( cH 0 (CH3Cl) = -689.8 кДж/моль), водорода ( cH 0 (H2) = -285.8 кДж/моль) и теплота образования HCl ( fH 0 (HCl) = -92.3 кДж/моль)).
3-9. Рассчитайте тепловой эффект реакции
при T = 298 K, если известны следующие данные:
H2O(г) = H2O(ж), H1 0 = -44 кДж/моль,
1/2N2 + 3/2H2 = NH3, H2 0 = -46.2 кДж/моль,
H2 + 1/2O2 = H2O(ж), H3 0 = -285.8 кДж/моль,
NO = 1/2N2 + 1/2O2, H4 0 = -91.3 кДж/моль.
3-10. При взаимодействии 10 г металлического натрия с водой rH298 = -79.91 кДж, а при взаимодействии 20 г оксида натрия с водой rH298 = -76.76 кДж. Вода берется в большом избытке. Рассчитайте теплоту образования оксида натрия fH 0 298(Na2O), если fH 0 298(H2Oж) = -285.8 кДж/моль.
3-11. Энергия связи в молекуле H2 равна 432.1 кДж/моль, а энергия связи в молекуле N2 равна 945.3 кДж/моль. Какова энтальпия атомизации аммиака, если энтальпия образования аммиака равна -46.2 кДж/моль?
3-12. Рассчитайте стандартный тепловой эффект реакции нейтрализации
NaOH + HCl = NaCl + H2O,
протекающей в водном растворе при 298 К.
3-13. Рассчитайте стандартный тепловой эффект реакции
3-14. Напишите уравнение Кирхгофа для реакции, протекающей при постоянном объеме.
3-15. Зависимость теплового эффекта реакции CH3OH(г) + 3/2O2 = CO2 + 2H2O(г) от температуры выражается уравнением:
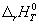
Рассчитайте изменение теплоемкости Cp для этой реакции при 500 К.
3-16. Стандартная энтальпия образования Al2O3(тв) при 298 К равна -1675 кДж/моль. Рассчитайте стандартную энтальпию образования Al2O3(тв) при 800 К, если даны мольные теплоемкости (в Дж/(моль . К)):
3-17. Энтальпия диссоциации карбоната кальция при 900 о С и давлении 1 атм равна 178 кДж/моль. Выведите уравнение зависимости энтальпии реакции от температуры и рассчитайте количество теплоты, поглощенное при разложении 1 кг карбоната кальция при 1000 о С и 1 атм, если даны мольные теплоемкости (в Дж/(моль . К)):


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
📹 Видео
Тепловой эффект реакции. ЗадачиСкачать

Закон Гесса. Практическая часть. 10 класс.Скачать

Химия | Задачи на термохимиюСкачать

Энтальпия (теория)Скачать

79. Тепловой эффект реакции. Термохимические уравнения (часть 2)Скачать

ЭнтальпияСкачать

Свободная энергия Гиббса. 10 класс.Скачать

СИГМА- ПИ- ДЕЛЬТА- СВЯЗЬСкачать