Средняя оценка: 4.2
Всего получено оценок: 554.
Средняя оценка: 4.2
Всего получено оценок: 554.
Этановая или уксусная кислота – это слабая карбоновая кислота, которая широко применяется в промышленности. Химические свойства уксусной кислоты определяет карбоксильная группа COOH.
- Физические свойства
- Получение
- Химические свойства
- Уксусная кислота. Химико-токсикологический анализ
- Уксусная кислота. Химико-токсикологический анализ
- Как распознать при помощи одного реактива глицерин, уксусный альдегид, уксусную кислоту, глюкозу?
- Запишите уравнения реакций, с помощь?
- Как можно распознать уксусную и соляную кислоты?
- Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения : Этан этилен этиловый спирт уксусный альдегид уксусная кислота этиловый эфир уксусной кислоты?
- С помощью каких химических реакций можно различить глицерин , уксусный альдегид и уксусную кислоту?
- ПОМОГИТЕ ПОЖАЛУЙСТА?
- Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения Этан — хлорэтан — этанол — уксусный альдегид — уксусная кислота Плиииз?
- Как распознать глицерин и уксусную кислоту?
- ПОМОГИТЕ ПОЖАЛУЙСТА?
- Как с помощью одного реактива можно распознать каждое вещество глицерин Глюкоза Этанол Напишите уравнения реакций?
- Качественные реакции на спирт этанол, глюкозу, уксусную кислоту, глицерин (уравнения и признаки реакции напишите пожалуйста)?
- 💡 Видео
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Физические свойства
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см 3 ;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Получение
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.

Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Видео:Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать

Химические свойства
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Уксусная кислота. Химико-токсикологический анализ
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Уксусная кислота. Химико-токсикологический анализ
Уксусная кислота (этановая кислота) СН3СООН – бесцветная прозрачная жидкость с резким запахом. Для безводной («ледяной») т.пл. 16,64 °С, т. кип. 117,8 °С. Смешивается со многими растворителями, хорошо растворяет органические соединения.
Уксусная кислота – один из главных промежуточных метаболитов, выполняющих как структурную, так и энергетическую функцию в обмене веществ.
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей, растворы (концентрация выше 30 % по массе) при соприкосновении с кожей вызывают ожоги.
Уксусная кислота используется в пищевой, химической промышленности, в фармации.
Химико-токсикологическое исследование на наличие уксусной кислоты проводят при специальных заданиях или при наличии соответствующих указаний в материалах делах.
Уксусная кислота. Изолирование.
Уксусную кислоту отгоняют из объектов биологического происхождения, подкисленных 10 % кислоты серной или фосфорной. Дистиллят собирают в сосуд, содержащий 0,1 моль/л раствор натрия гидроксида, ввиду летучести уксусной кислоты. Количество уксусной кислоты определяют оттитровывая кислотой избыток натрия гидроксида.
Уксусная кислота. Качественное обнаружение
1. Реакция с хлоридом железа (III)
Появляется красная окраска. При нагревании окрашенного раствора происходит гидролиз, в результате которого выпадает бурый осадок.
Чувствительность реакции 1,25 мг.
2. Реакция этерификации (образования этилацетата) реакция протекает при нагревании с серной кислотой.
Появляется специфический запах этилацетата.
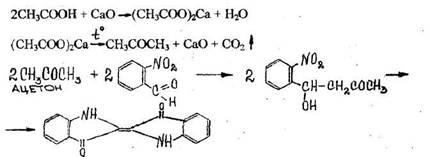
3. Реакция образования индиго
При нагревании уксусной кислоты с солями кальция образуется ацетон, который подвергается конденсации с о-нитробензальдегидом.
Отверстие пробки накрывают фильтровальной бумагой ,смоченной свежеприготовленным раствором о-нитробензальдегида в 5% растворе гидроксида натрия. Затем пробирку нагревают до прокаливания ее содержимого. На бумаге появляется синее пятно (окраска индиго).
Чувствительность реакции 10 мг.
- Реакция образования окиси какодила, обладающего неприятным запахом
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Как распознать при помощи одного реактива глицерин, уксусный альдегид, уксусную кислоту, глюкозу?
Химия | 10 — 11 классы
Как распознать при помощи одного реактива глицерин, уксусный альдегид, уксусную кислоту, глюкозу?
Напишите уравнения реакций и укажите внешние их проявления.
Все указанные вещества можно распознать при помощи свежеосажденного гидроксида меди — Cu(OH)2 ;
CH2(OH) — CH(OH) — CH2(OH) + Cu(OH)2 = > ; ярко — синий раствор, не меняющий цвет при нагревании ;
СН3СОН + 2Сu(OH)2 = CH3COOH + Cu2O + 2H2O (сначала образуется желтый осадок, при нагревании становится оранжевым) ;
2СH3COOH + Cu(OH)2 = (CH3COO)2Cu + 2H2O (осадок Cu(OH)2) — осадок Cu(OH)2 растворяется, образуется прозрачный раствор) ;
Глюкоза + Cu(OH)2 = сначала образуется ярко — синий раствор, при нагревании превращается в оранжевый осадок).
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Запишите уравнения реакций, с помощь?
Запишите уравнения реакций, с помощь.
Которых можно осуществить следующие превращения : метан ⇒ ацетилен ⇒ уксусный альдегид ⇒уксусная кислота ⇒ метилацетат также уксусная кислота ⇒ пропилацетат и уксусная кислота ⇒ ацетат аммония.
Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Как можно распознать уксусную и соляную кислоты?
Как можно распознать уксусную и соляную кислоты?
Напишите уравнения реакций.
Видео:Опыты по химии. Реакция нейтрализацииСкачать

Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения : Этан этилен этиловый спирт уксусный альдегид уксусная кислота этиловый эфир уксусной кислоты?
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения : Этан этилен этиловый спирт уксусный альдегид уксусная кислота этиловый эфир уксусной кислоты.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

С помощью каких химических реакций можно различить глицерин , уксусный альдегид и уксусную кислоту?
С помощью каких химических реакций можно различить глицерин , уксусный альдегид и уксусную кислоту?
Видео:Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать

ПОМОГИТЕ ПОЖАЛУЙСТА?
Как с помощью одного реактива распознать глюкозу и ацетальдегид?
Напишите уравнения реакций.
Видео:Решаем два варианта Добротина за 2 часаСкачать

Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения Этан — хлорэтан — этанол — уксусный альдегид — уксусная кислота Плиииз?
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения Этан — хлорэтан — этанол — уксусный альдегид — уксусная кислота Плиииз.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Как распознать глицерин и уксусную кислоту?
Как распознать глицерин и уксусную кислоту?
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

ПОМОГИТЕ ПОЖАЛУЙСТА?
1)С помощью характерных реакций предложите как распознать, в какой из пробирок находятся водные растворы : а) этанола ; б) уксусной кислоты ; в) глюкозы ; г) глицеринглицерин 2) Опыт.
Получите гидроксид цинка и проведите реакции, характеризующие его химические свойства.
С помощью характерных реакций предложите как распознать, в какой из пробирок находятся водные растворы : а) уксусного альдегида ; б) уксусной кислоты ПРОШУ, СРОЧНО!
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как с помощью одного реактива можно распознать каждое вещество глицерин Глюкоза Этанол Напишите уравнения реакций?
Как с помощью одного реактива можно распознать каждое вещество глицерин Глюкоза Этанол Напишите уравнения реакций.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Качественные реакции на спирт этанол, глюкозу, уксусную кислоту, глицерин (уравнения и признаки реакции напишите пожалуйста)?
Качественные реакции на спирт этанол, глюкозу, уксусную кислоту, глицерин (уравнения и признаки реакции напишите пожалуйста).
Если вам необходимо получить ответ на вопрос Как распознать при помощи одного реактива глицерин, уксусный альдегид, уксусную кислоту, глюкозу?, относящийся к уровню подготовки учащихся 10 — 11 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
При температуре около 483°С.
Zn + 2HCL = ZnCL2 + H2 Найдём массу чистого цинка Масса равна 14, 4 * 0, 9 = 12, 96 Теперь найдем моли 12, 96 / 65, 4 = 0, 198 моль перед водородом и цинком нет коэффициентов моль водорода сколько же сколько и цинка водорода 0, 198 * 22, 4 = 4, 4352.
FeSO4 + 2NaOH — > Fe(OH)2↓ + Na2SO4 Fe( + 2) + SO4( — 2) + 2Na( + ) + 2OH( — ) — > Fe(OH)2↓ + 2Na( + ) + SO4( — 2) Fe( + 2) + 2OH( — ) — > Fe(OH)2↓ NaOH + HCl — > NaCl + H2O Na( + ) + OH( — ) + H( + ) + Cl( — ) — > Na( + ) + Cl( — ) + H2O OH( — ) + H..
Пишем реакцию CuS + Mg — > MgS + Cu(Осадок) находим массу 23% сульфида меди в 100г 100% — 100 23%. — × = 23 грамм(CuS) теперь находим массу меди 23. — x. = 15. 09 грамм (Сu)80% 97. 5 — 64 15. 09 грамм это 80% выхода реакции а нам нужно 100% 100%..
m(CaO) = 20г * 0. 13 = 2, 6г n(CaO) = = 0, 045 моль По уравнению n(CaO) = n(Ca(OH)2) = 0, 045 моль m(Ca(OH)2) = 0, 045 моль * 74г / моль = 3, 33г.
Cu + H2SO4 = не идет т. К медь стоит правее водорода, она не может вытеснить водород.
Sn + 2S (Hg / NH₄Cl / t) = SnS₂↓ сульфид олова (IV) муссивное золото m(Sn) = M(Sn)m(SnS₂) / m(Sn) = 119 * 25 / = 20, 32 г m(S) = 2 * M(S)m(SnS₂) / m(S) = 2 * 32 * 25 / = 10, 92 г SnS₂ + (NH₄)₂S = (NH₄)₂..
Проводят : вода, фольга не проводят : стекло, пластмасса, древесина, резина (наверное).
Номер 3. 2KOH + Cu(NO3)2 = 2KNO3 + Cu(OH)22K( + ) + 2OH( — ) + Cu( + 2) + 2NO3( — ) = 2K( + ) + 2NO3( — ) + Cu(OH)2Cu( + 2) + 2OH( — ) = Cu(OH)2.
Я не уверена на счёт молей , но по логике должно быть так , удачи ✋️.
💡 Видео
Взаимодействие уксусной кислоты с металламиСкачать

Видеоурок «Качественные реакции в химии»Скачать

ЭКЗО- и ЭНДО- термические реакции. Химия – ПростоСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать