Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды.
В реальных условиях коррозии обычно подвергаются технические металлы, содержащие примеси других металлов и неметаллических веществ.
Механизм электрохимической коррозии в таких металлах аналогичен механизму процессов, протекающих в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идет процесс окисления (разрушение металлов), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды).
Наиболее часто встречаются окислители (деполяризаторы):
· ионы водорода (коррозия с водородной деполяризацией)
2Н + + 2 ē = Н 2 (в кислой среде),
2Н2О + 2 ē = Н2 + 2ОН — (в нейтральной и щелочной средах);
O2 + 4 ē + 4Н + = 2Н2О (в кислой среде);
О2 +4 ē + 2Н2О = 4ОН — (в щелочной и нейтральной средах).
Методика рассмотрения работы гальванопары при электрохимической коррозии.
· Составляют схему гальванопары:
· Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (табл.П.7), определяют восстановитель (меньший потенциал), окислитель (больший потенциал).
· Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при гальванокоррозии.
· Указывают направление движения электронов.
Пример 1.Гальванопара алюминий —железо в воде (среда нейтральная). В воде растворен кислород.
· Схема гальванопары Al / H2O, O2 / Fe
· Потенциалы 


Восстановитель – Al, окислитель — О2.


· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н + ), если нарушена сплошность покрытия.
· Потенциалы: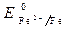


Восстановитель – железо, окислитель – кислород.


2Fe + О2 + 4Н + = 2Fe 2+ + 2Н2О
При нарушении целостности покрытия будет разрушаться Fe.
· Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом:


Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
· Схема гальванопары: Al / КОН/ Fe
· Потенциалы: 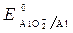


· 
Fe(+): 3 2 H2O + 2 ē = 2 OH — + H2 – процесс восстановления
2 Al + 2 OH — + 2H2O = 2 AlO2 — + 3 H2
· Направление перемещения электронов в системе:


Задание к подразделу 4.4
Рассмотрите коррозию гальванопары, используя потенциалы (табл. П.7), укажите анод и катод соответствующей гальванопары в различной коррозионной среде, рассчитайте ЭДС, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе.
| Номер задания | Коррозионная среда | ||
| а) H2O + O2 | б) NaOH + H2O | в) H2O + Н + | |
| 321. | Fe / Zn | Zn / Al | Pb / Zn |
| 322. | Fe / Ni | Fe / Zn | Al / Cu |
| 323. | Pb / Fe | Cd / Cr | Al / Ni |
| 324. | Cu / Zn | Al / Cu | Sn / Cu |
| 325. | Zn / Fe | Fe / Cr | Co / Al |
| 326. | Zn / Al | Pb / Zn | Cr / Ni |
| 327. | Cr / Cu | Pb / Cr | Bi / Ni |
| 328. | Cu / Al | Cr / Zn | Fe / Mg |
| 329. | Zn / Sn | Mg / Cd | Cr / Bi |
| 330. | Co / Mg | Zn / Fe | Pb / Al |
| 331. | Pb / Zn | Bi / Ni | Cd / Al |
| 332. | Bi / Ni | Cu / Zn | Fe / Ni |
| 333. | Fe / Mg | Fe / Cu | Co / Cd |
| 334. | Sn / Fe | Pb / Zn | Cr / Fe |
| 335. | Cr / Fe | Fe / Mg | Co / Cu |
| 336. | Fe / Cr | Cr / Cu | Cr / Cu |
| 337. | Fe / Cu | Cd/ Zn | Cd/ Zn |
| 338. | Zn / Cu | Cr / Ni | Cr / Cd |
| 339. | Mg / Cu | Cr / Cd | Zn / Al |
| 340. | Sn / Cu | Bi / Ni | Bi / Ni |
Электролиз растворов
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и электролита.
Электрод, на котором происходит восстановление, называется катодом, он заряжен отрицательно. Электрод, на котором происходит окисление, называется анодом, он заряжен положительно.
При электролизе водных растворов могут протекать процессы, связанные с электролизом воды, т.е. растворителя.
Катодные процессы
На катоде возможно восстановление:
· катионов металла Ме n+ + nē = Me;
· катиона водорода (свободного или в составе молекул воды):
2H + + 2ē = H 2 ( в кислой среде) ;
2H2O + 2 ē =H 2+ 2 OH — ( в нейтральной и щелочной средах).
Для выбора приоритетного процесса следует сравнить стандартные электродные потенциалы металла и водорода (табл. П.6, П.7). Потенциал восстановления катионов водорода необходимо использовать с учетом перенапряжения, 
1. Активные металлы (Li — Al) из-за низкой окислительной способности их ионов на катоде не осаждаются, вместо них идет восстановление ионов водорода.
2. Металлы средней активности (Mn, Zn, Fe, Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. Малоактивные металлы (стоящие в ряду напряжений после водорода) из-за высокой окислительной способности их ионов осаждаются на катоде без выделения водорода.
Анодные процессы
На аноде возможны процессы окисления:
· материала анода Ме — nē = Me n +
Анионы кислородосодержащих кислот, имеющие в своем составе атом
элемента в высшей степени окисления (SO4 2 — , NO3 — и др.), при электролизе водных растворов на аноде не разряжаются.
С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:


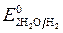
Так как


происходит восстановление воды: 2H2O — 4ē = O2 + 4 H +
среда щелочная среда кислая
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами:
SnCl 2 = Sn 2+ + 2Cl —





Так как


ионов олова: Sn 2+ + 2 ē = S n 2Cl — — 2 ē = Cl 2
Пример 3. Электролиз сульфата меди с медным анодом:

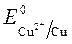



Так как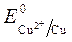

происходит восстановление Так как 
ионов меди:Cu 2+ +2ē = Cu анод растворяется: Cu — 2ē = Cu 2+
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем (1834).
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:

где m — масса образовавшегося вещества , г;
М — молярная масса вещества, г/ моль;
n — количество электронов, участвующих в электродном процессе;
t — время электролиза, с;
F — константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формулу использют в виде 
где V— объем газа, выделяющегося на электроде; V 0 — объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4А.
Решение.


Задание к подразделу 4.5
Рассмотрите катодные и анодные процессы при электролизе водных растворов веществ. Процессы на электродах обоснуйте значениями потенциалов (табл. П.6,7,8). Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами либо растворимым анодом. Рассчитайте массу или объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А.
Живите по правилу: МАЛО ЛИ ЧТО НА СВЕТЕ СУЩЕСТВУЕТ? Я неслучайно подчеркиваю, что место в голове ограничено, а информации вокруг много, и что ваше право.
Система охраняемых территорий в США Изучение особо охраняемых природных территорий(ООПТ) США представляет особый интерес по многим причинам.
Конфликты в семейной жизни. Как это изменить? Редкий брак и взаимоотношения существуют без конфликтов и напряженности. Через это проходят все.
ЧТО ПРОИСХОДИТ, КОГДА МЫ ССОРИМСЯ Не понимая различий, существующих между мужчинами и женщинами, очень легко довести дело до ссоры.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Видео:Коррозия металловСкачать

Примеры защиты металлов от коррозии
Видео:Технологический институт - гальванический элемент, электролиз, коррозия. Задачи.Скачать

Решение задач по химии на покрытие металлов
Задание 284.
Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
Решение:
При опускании пластинки из чистого цинка в раствор разбавленной кислоты, начавшееся выделение водорода вскоре почти прекратится, потому что на пластинке из цинка образуется оксидная плёнка, которая будет препятствовать дальнейшему взаимодействию цинка с разбавленной кислотой. Оксидная плёнка образуется при взаимодействии цинка с кислородом, растворённым в воде по схеме:
Если прикоснуться к цинковой пластинке медной палочкой, то возникнет гальваническая пара цинк — медь, в которой цинк будет являться анодом, а медь – катодом. Это происходит, потому что стандартный электродный потенциал цинка (-0,763 В) значительно отрицательнее, чем потенциал меди (+0,34 В).
Анодный процесс: Zn 0 — 2 
Катодный процесс в кислой среде: 2Н + + 2 
Образующиеся ионы Zn 2+ будут с имеющимися анионами кислоты давать соль, а ионы водорода Н + , деполяризуясь на медной палочке, Zn 0 — 2 = Zn 2+ образуют водород, который в виде пузырьков газа выделяется из раствора. Ионно-молекулярное уравнение реакции будет иметь вид:
Zn + 2H + = Zn 2+ + H2↑
Задание 285.
В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
Решение:
Для предотвращения коррозии стальных конструкций применяется протекторная защита: создаётся электрический контакт защищаемой конструкции с протектором – более активным металлом (обычно Zn, Mg, Al или их сплавы). При таком контакте возникает гальваническая пара типа Zn — Fe и коррозии подвергается протектор, а не сама стальная конструкция (трубопровод, корпус корабля и т.п.). Например, корпус корабля защищают протектором – цинковые брусья, которые крепят в нескольких местах днища корабля. Под действием морской воды и кислорода цинк разрушается, а корпус корабля защищается, таким образом, от коррозии. При этом протекают следующие электрохимические процессы:
Анодный процесс: Zn 0 — 2 
Катодный процесс:
а) в нейтральной или щелочной среде: 1/2O2 + H2O + 2 
б) в кислой среде: 1/2O2 + 2H + + 2 
Таким образом, цинк разрушается, окисляясь до ионов Zn2+, которые с гидроксильными ионами образуют нерастворимый гидроксид Zn(OH)2 или в виде ионов Zn2+ уходит в раствор, если реакция среды кислая. Основной металл остаётся неповреждённым.
Задание 286.
Железное изделие покрыли никелем. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
Железо имеет более электроотрицательный стандартный электродный потенциал (-0,44 В), чем никель (-0,24 В), поэтому железо является анодом, никель – катодом.
Анодный процесс – окисление металла: Fe 0 — 2 = Fe 2+
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Fe — Ni с водородной деполяризацией происходит следующие процессы:
Анодный процесс: Fe 0 — 2 
Катодный процесс: в кислой среде: 2Н + + 2 
Продуктом коррозии будет газообразный водород соединение железа с кислотным остатком (соль).
При коррозии пары Fe — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление железа:
Анодный процесс: Fe 0 — 2 
Катодный процесс:
в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксид-ионами ОН — образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
Так как никель имеет более электроположительный стандартный электродный потенциал, чем железо, то данное покрытие является катодным. При повреждении катодного покрытия (или наличия пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород. Следовательно, данное катодное покрытие может защищать железо от коррозии лишь при отсутствии пор и повреждений покрытия.
Видео:Электрохимическая коррозияСкачать

5.3 Электрохимическая коррозия металлов
Выполнить Номера:215 и 235
5.3 Электрохимическая коррозия металлов
Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды.
Механизм электрохимической коррозии аналогичен механизму процессов в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идёт процесс окисления (разрушения металла), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды).
Наиболее часто встречаются окислители:
— ионы водорода (коррозия с водородной деполяризацией)
2H+ + 2з → H2 (кислой среде)
2H2O + 2з → H2 + 2OH — (в нейтральной и щелочной среде)
O2 + 4з +4H+ → 2H2O (в кислой среде)
O2 + 4з + 2H2O → 4OH — (в нейтральной и щелочной среде)
Пример 1. Гальванопара алюминий – железо в воде (среда нейтральная). Учитываем, что в воде есть растворенный кислород.
Выписываем потенциалы алюминия и железа из таблицы потенциалов:
EoAl3+/Al = -1,88 В EoFe(OH)2/Fe = -0,46 В
восстановитель — Al; окислитель – O2
4 (-) Al0 – 3з → Al3+ — процесс окисления
3 (+) O2 + 4з + 2H2O → 4OH — — процесс восстановления
4Al + 3O2 + 6H2O = 4Al(OH)3
Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом. Подвергаться коррозии будет в первую очередь алюминий.
Пример 2. Определить процессы, протекающие при коррозии луженого железа в кислой среде.
Потенциалы: EoFe2+/Fe =-0,44 В, EoSn2+/Fe = -0,136 В, Eo2H+/H2 = 0 В
Восстановитель – Fe; окислитель — H+
Fe (-) Fe0 – 2з → Fe2+ — процесс окисления
Sn (+) 2H+ + 2з → H2 — процесс восстановления
Fe + 2H+ → Fe2+ + H2
Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом, т. е. от Fe к Sn.
Задания к подразделу 5.3
Рассмотрите коррозию гальванопары, используя потенциалы из таблицы 1, укажите анод и катод соответствующей гальванопары в различной коррозионной среде, напишите уравнения электродных процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе.
5.4 Электролиз растворов
Электролизом называется процесс, протекающий на электродах при пропускании через раствор или расплав электролита постоянного электрического тока. Электрод, на котором происходит восстановление, называется катодом. Он соединен с отрицательным полюсом источника постоянного тока. Электрод, на котором происходит окисление, называется анодом. Он соединен с положительным полюсом источника постоянного тока.
При электролизе водных растворов протекают процессы, связанные с электролизом воды.
На катоде возможно восстановление
— катионов металла Men+ + nз → Me0
— катиона водорода (свободного или в составе молекул воды)
2H+ + 2з → H2 (в кислой среде)
2H2O + 2з → H2 + 2OH — (в нейтральной и щелочной среде)
Для выбора приоритетного процесса необходимо сравнить стандартные электродные потенциалы металла и водорода. Потенциал восстановления водорода следует использовать с учётом его перенапряжения Eo2H2О/H2 =1,0 В. Все металлы при электролизе водных растворов можно разделить на 3 группы:
1. активные металлы (Li — Al) на катоде не осаждаются, вместо них идёт восстановление ионов водорода:
2H2O + 2з → H2 + 2OH-
2. металлы средней активности (Mn; Zn; Fe; Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. неактивные металлы (Ag; Cu; Au) из-за высокой окислительной способности их катионов осаждаются на катоде без выделения водорода:
На аноде возможны процессы окисления:
— материала анода: Me0 – nз → Men+
— анионов солей: 2Cl — — 2з → Cl2
— молекул воды: 2H2O – 4з → O2 + 4H+
Анионы кислородсодержащих кислот, имеющие в своём составе атом элемента в высшей степени окисления (SO42-; NO3-; PO43- и др.) при электролизе на аноде не разряжаются.
С учетом перенапряжения величину потенциала кислорода нужно считать равной +1,8 В.
Пример 1. Электролиз водного раствора сульфата натрия с инертными электродами: Na2SO4 = 2Na+ + SO42-
Так как EoNa+/Na Eo2H2О/H2 идет процесс восстановления катионов олова
Так как EoCl2/2Cl — Eo2H2О/H2 идет восстановление катионов меди:
Сульфат–ионы не разряжаются, так как EoCu2+/Cu
📸 Видео
Химия 9 Коррозия металловСкачать

Она убьет любую сталь! Гальваническая или электрохимическая коррозия. Как работает и как бороться.Скачать

§13, 9 кл. Коррозия металловСкачать

Гальваническая коррозия. Что это такое и как с этим бороться?Скачать

Коррозия металла (часть 2). Химия – ПростоСкачать

Гальваническая (протекторная) защитаСкачать

Коррозия простым языкомСкачать

Эксперимент «Защита от коррозии» из набора «Коррозия»Скачать

9 класс. Химия. Коррозия металлов. Защита от коррозииСкачать

Коррозия металлов, способы защиты от неё, 1980Скачать

§39, 9 кл. Диссоциация электролитов в водных растворахСкачать

Антикоррозионные покрытия: металлические, лакокрасочные, полиуретановые, силикатно-эмалевыеСкачать

Коррозия металла экспериментСкачать

Предотвращение коррозии под изоляцией с BelzonaСкачать

"Натуральные" ингибиторы коррозии. Гулан П.К. Специализация - Химия.Скачать

Целенаправленная профилактика питтинговой коррозии, вызванной хлоридами - neodisher PreStopСкачать

Обман в школах. Ингибиторы. Химия – ПростоСкачать