ГОУ ВПО «Красноярский государственный медицинский университет
Федерального агентства по здравоохранению и социальному развтию»
Кафедра Клиничео-лабораторной диагностики
К ПРАКТИЧЕСКОМУ ЗАНЯТИЮ для аудиторной работы
Тема: «Построение калибровочных графиков»
Утверждена на кафедральном заседании
(межкафедральной методической конференции)
«_____»__________________ 2010 г.
ГОУ ВПО КрасГМУ им. проф. -Ясенецкого
к. м.н., доцент _______________________
к. м.н., доцент _____________________
Учебная цель: Познакомить курсантов с правилами построения калибровочных графиков, методами расчета контрольных точек и способам проверки построенного графика.
На практических занятиях: специально разработанные задачи для закрепления на практике полученной теоретической базы.
Практические навыки, которыми должен владеть курсант
Вычисление точек для построения калибровочного графика двумя способами
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Знание методики проверки калибровочного графика
Знание основных принципов использования калибровочного графика
На цикле общего усовершенствования определить базовый уровень знания предмета, оценить умение курсанта находить наиболее верную тактику использования калибровочного графика в сложных ситуациях, которые могут создаться на рабочем месте.
На цикле ППС подробно разобрать требования к калибровочным материалам и правила их приготовления. Отработать на специальных примерах принципы построения калибровочного графика и способы расчета калибровочных растворов, и способы проверки правильности построения калибровочной кривой. В конце занятия проверить степень усвоения разобранной темы и подробнее остановиться на вызвавших затруднение вопросах.
При подготовке к занятию прочитать всю доступную литературу по данной теме, а в методическом кабинете проработать разработанное на кафедре учебное пособие. Самостоятельно используя стандартные наборы различных производителей рассчитать разными способами точки для построения калибровочной кривой, ответить на все контрольные вопросы которые приводятся в конце данного пособия. Если возникли какие-либо затруднения сформировать логически вопрос и задать его преподавателю на практическом занятии либо в начале, либо по ходу разбора темы.
1. Количественные проблемы биохимии, М. 1983
2. Унификация лабораторных методов исследования. Стандартизация качества унифицированных клинических лабораторных методов исследования, М., 1981.
3. Лабораторное дело, 1977, №4, 253.
4. Камышников по клинико-биохимической лабораторной диагностике: В 2т. т.1 – Мн.: Беларусь, 2000. – 495 с.: ил.
В основе всех колориметрических методов положено светопропускание и светопоглащение. Приборы, используемые в фотометрическом анализе позволяют определить оптическую плотность и процент светопропускания. Но в отделение выдается результат исследования не в единицах оптической плотности, а в единицах концентрации. Экстинция исследуемого образца сравнивается с экстинцией образца компонента с точно известной концентрацией. Расчеты ведут по формуле или калибровочному графику.
Калибровочный график – это графическое изображение связи между измеряемой величиной экстинцией и концентрацией вещества.
Методы исследования, в основе которых лежит сравнение с образцом являются методами сравнения и их точность зависит от точности приготовления калибровочных растворов и чистоты веществ.
Характеристика калибровочных материалов
Для получения воспроизводимых, контролируемых, статистически достоверных и сравниваемых результатов существует система измерений, включающая методологию и соответствующие вещества контролируемого состава. Экспертная группа по номенклатуре качественного контроля предлагает разделить калибровочные стандарты на группы:
— первичные – в которой масса стандартного вещества определяется взвешиванием;
— вторичные – содержание компонентов определяется аналитическим методом.
Требования к первичному стандарту
1. Вещество должно быть стабильным.
2. Вещество должно иметь точно установленный состав.
Видео:Решение задачи на построение калибровочного графика и расчет концентрации аналита в образце (excel)Скачать
3. Вещество должно иметь высокий эквивалентный вес, чтобы при взвешивании ошибка была минимальной.
4. Вещество не должно изменяться при очистке, сушке и т. д.
Этим требованиям в настоящее время соответствуют не все вещества, в основном неорганические.
В качестве калибровочных материалов могут использоваться вещества различной природы и степени чистоты, в зависимости от поставленных задач.
Правила при приготовлении калибровочных растворов
1. Используемое вещество должно быть максимально возможной чистоты с максимум содержания основного вещества – более 99,9 %. Чем чище вещество, тем оно стабильнее.
Например: есть вещества степени чистоты хч, чда, ч. Берем хч.
2. Навеска отвешивается с большой точностью на аналитических весах (в ряде случаев допустимо использование торсионных весов), но всегда в таре, с которой вещество можно смыть растворителем.
3. Навеска должна быть довольно большой, чтобы повысить точность взвешивания. Если по методике требуется слабый раствор, то готовят более концентрированный, а затем его разбавляют. Чем больше навеска – тем выше точность.
4. Иногда в методике есть специальные указания (например: высушить до постоянного веса и т. д.). Сушить можно прокаливанием, в термостате, в эксикаторе, выветриванием. Нужно посмотреть по химическому справочнику термоустойчивость вещества. Обязательно взвешивание до и после высушивания.
Нельзя готовить калибровочные растворы из гигроскопичных веществ.
5. Навеска тщательно смывается и растворяется в растворителе высокой чистоты. Вода должна быть свежеприготовленной, лучше (а для ряда методик только) бидистиллированной. При построении калибровочных кривых правильнее использовать не водные растворы, а стандартные сыворотки разного состава. Эти сыворотки самими не готовятся. Водные растворы хуже, так как при ряде исследований присутствующие в сыворотке белки оказывают определенное влияние – часть вещества может сорбироваться на белке и не участвовать в химической реакции — так называемый «матричный эффект». Например, в методике определения билирубина для калибровочного раствора берут сыворотку, так как билирубин в воде не растворяется, а растворенный в щелочи дает меньшую экстинцию.
Альбуминосодержащие калибровочные растворы следует применять в случаях, когда это указано в методике или если необходимо проверить влияние белка на надежность метода.
Диапазон стандартных растворов
Для любой исследуемой величины есть средняя величина, верхняя и нижняя граница норм, а при патологии может быть гипо — и гиперсодержание. Следовательно, в графике должны быть отражены все эти точки. Большое значение имеет чувствительность метода. Она определяется той наименьшей концентрацией вещества, которое еще может быть определено с достаточной точностью.
То есть концентрации веществ должны быть адоптированы к пределам нормы и чувствительности метода, и график обычно включает не менее 4-5 точек.
-Х—— средняя величина
При проверке надежности метода, кроме того, следует определить:
Видео:Расчет коэффициента корреляции в ExcelСкачать

-прямолинейность выше максимальной точки калибровочной кривой;
-прямолинейность между нулевой точкой и минимальной на калибровочной кривой. Для этого готовят еще по 3 точки (эквидистантные концентрации).
Для каждой выбранной точки готовят калибровочный раствор, который обрабатывают по методике в параллельных пробах (не менее 2-3), на график наносится среднее значение.
Общие требования
1. Разведение стандартного раствора готовят в арифметической, а не геометрической прогрессии, выдерживая 1 шаг: 0,1 мг, 0,2 мг, 0,3 мг и т. д.
2. При измерении оптических плоскостей следует учитывать оптическую плотность реактивов, иначе точка не пройдет через 0. Для этого колориметрируют против контроля, содержащего все реактивы.
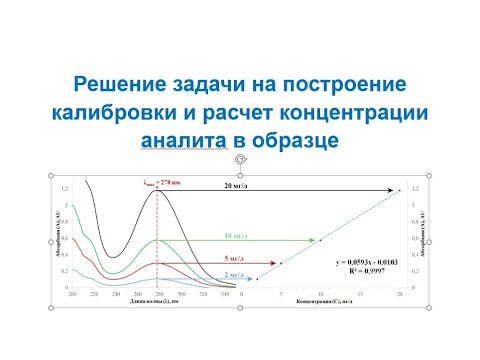
Оптическую плотность, полученную для калибровочных растворов, наносим на систему координат. Лучше всего пользоваться миллиметровой бумагой достаточно большого размера. По оси ординат откладывается плотность, по оси абсцисс – концентрация. Масштаб выбирается произвольно: для концентраций – чтобы можно было считать с точностью, соответствующей практическим требованиям с учетом пределов нормы и чувствительности метода; для экстинции – учитывая цену деления прибора. Оптимально, когда наклон кривой к оси абсцисс проходит под углом 450. При малом масштабе угол будет больше и кривая более крутая, при большем масштабе – кривая проходит более полого.
Если в пределах выбранных концентраций растворы соответствуют закону Ламберта-Бера, то график проходит через 0 точку и имеет вид прямой.
Всегда ли кривая в выбранном диапазоне концентраций проходит через точку 0? Нет, не всегда, даже если кривая правильная. Это может быть: 1. если реакция при больших и малых концентрациях протекает не строго стериохимически; 2. если исследование ведется не в монохромном свете. Надо перейти на другой прибор.
НО ВСЕГДА НАДО РАБОТАТЬ НА ЛИНЕЙНОМ УЧАСТКЕ КРИВОЙ.
Иногда это невозможно. Например, при определении белка по Лоури, где кривая очень быстро выходит на плато. В этом случае строят графическую калибровочную кривую. Кроме основных калибровочных растворов, проходящих по прямолинейному участку, берут не менее 10 стандартных растворов, проходящих по прямолинейному участку, берут не менее 10 стандартных растворов, соответствующих пологому участку. Т. е. на пологом участке будет много точек.
Приготовление калибровочных растворов
Из основного калибровочного вещества готовят ряд стандартных проб. Они могут быть приготовлены 2-мя способами, в зависимости от биохимии метода.
1 способ: Необходимая концентрация стандартного раствора обеспечивается за счет различных объемов одного и того же маточного (основного) стандартного раствора.
Расчет концентраций с помощью калибровочного графика. Построение графика
Читайте также:
| © www.freechemistry.ru, 2013 |
Калибровочные графики используются только в физических и физико-химических методах анализа. На фоне победных реляций физиков-теоретиков об успешном описании физических и физико-химических процессов возникает вопрос: если все так хорошо изучено, то зачем вообще нужны калибровочные графики? Они нужны для того, чтобы учесть все факторы, влияющие на процесс анализа, которые теоретически учесть довольно трудно. К факторам такого рода можно отнести сложную кинетику химической реакции, аномальные константы равновесия, коэффициенты активности т.п. Из этого следует, что легче построить калибровочный график, чем заниматься утомительными поправками к теоретическим прогнозам.
Принцип построения калибровочного графика несложен. Готовятся несколько стандартных растворов (5-6 растворов, реже меньше 4) с известным содержанием определяемого вещества. В каждом стандартном растворе измеряется аналитический сигнал прибором, который используется в данном виде анализа. По результатам измерений строится график в координатах аналитический сигнал – содержание вещества в стандартном растворе. Построенный график является калибровочным. Далее все становится еще проще: проводятся измерения в анализируемом растворе, в котором следует узнать концентрацию определяемого вещества. Получив величину аналитического сигнала, с помощью калибровочного графика, находится концентрация, которая соответствует этому сигналу. На этом процедура анализа считается завершенной.
Простота простотой, но надо разъяснить некоторые технические детали построения калибровочного графика. Когда говорят о калибровочном графике, то всегда (за малым исключением) подразумевают прямую линию. Прямая линия является либо естественной функцией аналитического сигнала от концентрации, либо экспериментальные данные подвергаются линеаризации, чтобы в итоге калибровка стала прямой. Отсюда возникает вопрос: а почему калибровка должна быть представлена в виде прямой? В наше время, когда компьютер стоит на каждом столе, не слишком ли примитивно строить прямые? Тут дело обстоит не столько в математической обработке результатов, сколько в потребности лишний раз убедиться в том, что калибровочная прямая подтверждает ожидаемый физико-химический закон. Оценку этого легче проводить по параметрам прямой, чем по виду кривой линии. Таким образом, если при построении калибровочной прямой мы лишний раз убеждаемся, что это действительно прямая, то со спокойной совестью мы можем констатировать ожидаемое течение реакции и нормальное функционирование прибора.
Приведем пример построения калибровки для спектрофотометрического метода анализа.
Оптическая плотность окрашенных растворов находится в линейной зависимости от концентрации окрашенного вещества в растворе. Об этом свидетельствует закон Бугера-Ламберта-Бера:
A — оптическая плотность;
ε – молярный коэффициент погашения;
C – молярная концентрация раствора, моль/л;
l – толщина кюветы, см.
Отсюда вывод о виде калибровочного графика отсюда однозначен: график должен быть прямой линией и исходить из нуля.
Действительность же приносит сюрпризы. Во-первых, калибровки часто не исходят из нуля. Во-вторых, калибровочный график имеет концентрационные пределы линейности. Со второй особенностью разбираться можно долго и безрезультатно, поэтому примем этот факт и смиримся с ним, используя только линейную область калибровки. С первым сюрпризом дело обстоит несколько проще. Причин, которые мешают исходить калибровочной прямой из нуля обычно две. Первая причина несерьезна и легко устранима. Она состоит в том, что кюветы имеют чуть разные размеры или дефекты стекла. Разность эта невелика и может достигать 0,001-0,002 единиц оптической плотности. Измерить эту разность несложно, достаточно залить в кюветы фоновый раствор, не содержащий анализируемого вещества, и измерить оптическую плотность растворов друг относительно друга.
Видео:Метод градуировочного графикаСкачать

Если же калибровочная прямая не исходит из нуля на более значительную величину, чем предполагает разность размеров кювет, то может идти речь о частичном разложении реактива, который вызывает окраску раствора с определяемым веществом. Иными словами, в результате разложения реактива образуется небольшое количество вещества, которое вступает в реакцию с определяемым веществом. Конечно, можно закрыть на это глаза, но лучше этого не делать и подвергнуть реактив очистке. Зачем это нужно? А делать это нужно для того, чтобы исключить побочные реакции, которые существенно снижают надежность последующих анализов.
Существует еще одно правило, которое следует неукоснительно соблюдать: не производить аналитические определения за пределами калибровочного графика. Это ни к чему хорошему не приводит, так как есть большой риск получения большой систематической ошибки. Но тут есть радующее душу исключение. Если калибровочная прямая исходит из нуля (если она теоретически должна из него исходить), то можно производить определения ниже нижней границы калибровки. Если же прямая должна исходить из нуля, но она из него не исходит, то риск ошибиться при определении малых концентраций вещества неизбежно многократно возрастает!
Тогда закономерно возникает вопрос: а что делать, если концентрация в анализируемой пробе находится за границами калибровочного графика? Ответ будет незатейлив: берите меньшую аликвоту для анализа пробы с высоким содержанием вещества и концентрируйте пробу для анализа с малым содержанием определяемого компонента.
🎥 Видео
7 класс - Алгебра - Определение углового коэффициентаСкачать

10 класс, 43 урок, Уравнение касательной к графику функцииСкачать

Корреляционно-регрессионный анализ многомерных данных в ExcelСкачать
Расчёт коэффициентов сезонностиСкачать

Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

КАРАСЕВ: СБИТЫЙ "ИЛ" - ИГРА НА СРЫВ ПЕРЕГОВОРОВ? РЕШАЮЩИЙ МОМЕНТ: ВОЗДУШНАЯ ВОЙНА и "ЗАМЕРШИЙ" ФРОНТСкачать

Excel. Расчет коэффициента корреляции. Шаг 7Скачать

Тема 3 Пример на нахождение углового коэффициента касательной - 1 частьСкачать

Видеоурок "Уравнение прямой с угловым коэффициентом"Скачать

Коэффициент корреляции Пирсона в ExcelСкачать

Дисперсия, среднее квадратичное отклонение, коэффициент вариации в ExcelСкачать

Касательная к графику функции в точке. 10 класс.Скачать
Прогнозирование в Excel с помощью линий трендаСкачать

Уравнение касательной в точке. Практическая часть. 1ч. 10 класс.Скачать





