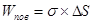Диспергирование и конденсация — методы получения свободнодисперсных систем: порошков, суспензий, золей, эмульсий и т. д. Под диспергированием понимают дробление и измельчение вещества, под конденсацией — образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.
В мировом производстве различных веществ и материалов процессы диспергирования и конденсации занимают одно из ведущих мест. Миллиарды тонн сырья и продуктов получают в свободнодисперсном состоянии. Это обеспечивает удобство их транспортирования и дозировки, а также дает возможность получать однородные материалы при составлении смесей.
В качестве примеров можно привести дробление и измельчение руд, каменного угля, производство цемента. Диспергирование происходит при сжигании жидкого топлива.
Конденсация происходит при образовании тумана, при кристаллизации.
Необходимо отметить, что при диспергировании и конденсации образование дисперсных систем сопровождается возникновением новой поверхности, т. е. увеличением удельной площади поверхности веществ и материалов иногда в тысячи и более раз. Поэтому получение дисперсных систем, за некоторым исключением, требует затрат энергии.
Рассмотрим диспергирование веществ в конденсированном состоянии. Чтобы разрушить твердое тело или жидкость и получить новую поверхность, необходимо преодолеть когезионные силы, или силы, обусловливающие целостность определенного объема твердого тела или жидкости. При диспергировании под действием внешних сил конденсированное вещество сначала претерпевает объемное деформирование (упругое и пластическое) и только после этого при определенном механическом усилии оно разрушается. Таким образом, работу, необходимую для диспергирования, можно разделить на две составляющие, одна из которых расходуется на объемное деформирование тела, другая — на образование новой поверхности.
Работа упругого и пластического деформирования пропорциональна объему тела:
где k — коэффициент пропорциональности, равный работе объемного деформирования единицы объема конденсированного тела; V — объем тела.
Работа образования новой поверхности при диспергировании пропорциональна приращению поверхности:
где s — работа образования единицы поверхности, т.е. поверхностное натяжение; DS — приращение поверхности, или площадь образовавшейся поверхности.
Полная работа, затрачиваемая на диспергирование, выражается уравнением Ребиндера:
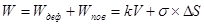
Так как работа объемного деформирования пропорциональна объему тела, при больших размерах тела полная работа диспергирования определяется, главным образом, работой упругого и пластического деформирования.
Когда в процессе измельчения размеры частиц диспергируемого материала становятся достаточно малыми, полная работа диспергирования уже определяется, главным образом, работой образования новой поверхности, т. е. работой по преодолению когезионных сил.
При дроблении и измельчении материалы разрушаются в первую очередь в местах прочностных дефектов (макро- и микротрещин). Поэтому по мере измельчения прочность частиц возрастает, что ведет к увеличению расхода энергии на их дальнейшее диспергирование.
Разрушение материалов может быть облегчено при использовании эффекта Ребиндера — адсорбционного понижения порочности твердых тел. Этот эффект заключается в уменьшении поверхностной энергии с помощью поверхностно-активных веществ, в результате чего облегчается деформирование и разрушение твердого тела. В качестве таких поверхностно-активных веществ, называемых в данном случае понизителями твердости, могут быть использованы, например, жидкие металлы для разрушения твердых металлов или типичные ПАВ.
Для понизителей твердости характерны малые количества, вызывающие эффект Ребиндера, и специфичность действия. Добавки, смачивающие материал, помогают проникнуть среде в места дефектов и с помощью капиллярных сил также облегчают разрушение твердого тела. Поверхностно-активные вещества не только способствуют разрушению материала, но и стабилизируют дисперсное состояние, препятствуя слипанию частиц.
Системы с максимальной степенью дисперсности могут быть получены только с помощью конденсационных методов.
- Системы и примеры
- Главная > Документ
- ГЛАВА XIII. ДИСПЕРСНЫЕ СИСТЕМЫ
- §1. Классификация дисперсных систем
- §2. Два метода получения дисперсных систем – диспергирование и конденсация
- §3.Молекулярно-кинетические свойства дисперсных систем
- §4. Устойчивость дисперсных систем
- Лако-красочные материалы — производство
- Технологии и оборудование для изготовления красок, ЛКМ
- Два общих метода получения дисперсных систем. Диспергирование
- 📸 Видео
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Системы и примеры
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

ГЛАВА XIII. ДИСПЕРСНЫЕ СИСТЕМЫ
§1. Классификация дисперсных систем
Дисперсные системы, рассматриваемые в коллоидной химии, гетерогенны, поэтому состоят как минимум из двух фаз. Одна из них является сплошной и называется дисперсионной средой. Другая фаза раздроблена и распределена в первой; её называют дисперсной фазой.
Наиболее общая классификация дисперсных систем основана на определении агрегатного состояния дисперсной фазы и дисперсионной среды. Сочетания трёх агрегатных состояний (твёрдое, жидкое и газообразное) позволяют выделить девять типов дисперсных систем (табл.7). Для краткости их условно обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель – дисперсионной среды, например обозначение Т/Ж показывает, что система состоит из твёрдой дисперсной фазы и жидкой дисперсионной среды (твёрдое в жидкости).
Таблица 7. Классификация дисперсных систем по агрегатному состоянию фаз
Условное обозначение системы
Название системы и примеры
Твёрдые гетерогенные системы: минералы, сплавы, ситаллы, бетон, композиционные материалы
Капиллярные системы: жидкость в пористых телах, адсорбентах; влажные почвы, грунты
Пористые тела: адсорбенты и катализаторы
Суспензии и золи: промышленные суспензии, пульпы, взвеси, пасты, илы
Эмульсии: природная нефть, кремы, молоко
Газовые эмульсии и пены
Аэрозоли: пыли, дымы.
Аэрозоли: туманы, в том числе промышленные облака
Коллоидная система не образуется
Одно из девяти сочетаний Г/Г не может соответствовать коллоидной системе, так как газы в обычных условиях при любых концентрациях дают истинные растворы (при очень высоких давлениях некоторые газовые системы образуют гетерогенные системы). Однако газовые смеси могут проявлять отдельные свойства гетерогенно-дисперсных систем благодаря непрерывным флуктуациям плотности и концентрации, вызывающим неоднородности в системе. Рассматривая жидкие растворы с молекулярной степенью дисперсности, к гетерогенно-дисперсным системам можно отнести растворы полимеров. Размеры макромолекул могут превышать размеры обычных коллоидных частиц. Эти системы обладают многими свойствами, характерными для типичных гетерогенно-дисперсных систем. Они как бы связывают в единое целое все дисперсные системы и указывают на непрерывность перехода от истинных молекулярных растворов к гетерогенным дисперсным системам.
Все дисперсные системы также можно разделить на два класса по кинетическим свойствам дисперсной фазы: свободнодисперсные системы , в которых дисперсная фаза подвижна, и связнодисперсные системы – системы с твердообразной дисперсионной средой, в которой частицы дисперсной фазы не могут свободно перемещаться.
И еще эти системы классифицируют по степени дисперсности. Свободнодисперсные системы подразделяют на ультрамикрогетерогенные, размер частиц которых лежит в пределах от 10 -9 до 10 -7 м (от 1 до 100 нм ), микрогетерогенные с размером частиц от 10 -7 до 10 -5 м (от 0,1 до 10 мкм ) и грубодисперсные с частицами, размеры которых превышают 10 -5 м .
Ультрамикрогетерогенные системы часто называют истинно коллоидными или просто коллоидными, так как раньше только такие системы считались объектом коллоидной химии. Такие частицы обладают определенным агрегатным состоянием.
С ростом числа молекул в частице она постепенно приобретает все свойства фазы. В современной литературе малоконцентрированные свободнодисперсные ультрамикрогетерогенные системы чаще называют золями (нем. Sole от лат. solutio – раствор). Среди них различают аэрозоли – золи с газообразной дисперсионной средой; лиозоли – золи с жидкой дисперсионной средой (греч. lios – жидкость). В зависимости от природы среды лиозоли называют гидрозолями (вода), органозолями (органическая среда) или, более конкретно, алкозолями (спирты) и т. д.
Cвязнодисперсные (структурированные) системы с жидкой дисперсионной средой называют гелями .
К микрогетерогенным системам относят суспензии (Т/Ж), эмульсии (Ж/Ж), пены (Г/Ж), порошки (Т/Г). Эти системы имеют большое значение в промышленности. Из грубодисперсных систем наиболее распространены системы Т/Г (песок, щебень и др.).
И, наконец, дисперсные системы классифицируют по интенсивности межмолекулярных взаимодействий на границе раздела фаз.
Различают лиофильные коллоидные системы , которые характеризуются высокой степенью родственности дисперсной фазы и дисперсионной среды и их сильным взаимодействием, чему соответствуют очень низкие значения межфазного натяжения.
При высоких значениях межфазного натяжения образуются термодинамически неравновесные (неустойчивые) лиофобные дисперсные системы. Это обусловлено существенным различием граничащих фаз по составу, свойствам и их слабым взаимодействием.
§2. Два метода получения дисперсных систем – диспергирование и конденсация
Диспергирование и конденсация – методы получения свободнодисперсных систем: порошков, суспензий, золей, эмульсий и т. д. Под диспергированием понимают дробление и измельчение вещества, под конденсацией – образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.
В мировом производстве различных веществ и материалов процессы диспергирования и конденсации занимают одно из ведущих мест. Миллиарды тонн сырья и продуктов получают в свободнодисперсном состоянии. Это обеспечивает удобство их транспортирования и дозировки, а также даёт возможность получать однородные материалы при составлении смесей.
В качестве примеров можно привести дробление и измельчение руд, каменного угля, производство цемента. Диспергирование происходит при сжигании жидкого топлива.
Конденсация происходит при образовании тумана, при кристаллизации.
Необходимо отметить, что при диспергировании и конденсации образование дисперсных систем сопровождается возникновением новой поверхности, т. е. увеличением удельной площади поверхности веществ и материалов иногда в тысячи и более раз. Поэтому получение дисперсных систем, за некоторым исключением, требует затрат энергии.
Рассмотрим диспергирование веществ в конденсированном состоянии. Чтобы разрушить твёрдое тело или жидкость и получить новую поверхность, необходимо преодолеть когезионные силы, или силы, обусловливающие целостность определенного объема твёрдого тела или жидкости. При диспергировании под действием внешних сил конденсированное вещество сначала претерпевает объёмное деформирование (упругое и пластическое) и только после этого при определенном механическом усилии оно разрушается. Таким образом, работу, необходимую для диспергирования, можно разделить на две составляющие, одна из которых расходуется на объёмное деформирование тела, другая – на образование новой поверхности.
Работа упругого и пластического деформирования пропорциональна объёму тела:
где k – коэффициент пропорциональности, равный работе объёмного деформирования единицы объёма конденсированного тела; V – объём тела.
Работа образования новой поверхности при диспергировании пропорциональна приращению поверхности:
где – работа образования единицы поверхности, т. е. поверхностное натяжение; S – приращение поверхности, или площадь образовавшейся поверхности.
Полная работа, затрачиваемая на диспергирование, выражается уравнением Ребиндера:

Так как работа объёмного деформирования пропорциональна объёму тела, при больших размерах тела полная работа диспергирования определяется, главным образом, работой упругого и пластического деформирования.
Когда в процессе измельчения размеры частиц диспергируемого материала становятся достаточно малыми, полная работа диспергирования уже определяется, главным образом, работой образования новой поверхности, т. е. работой по преодолению когезионных сил.
При дроблении и измельчении материалы разрушаются в первую очередь в местах прочностных дефектов (макро- и микротрещин). Поэтому по мере измельчения прочность частиц возрастает, что ведет к увеличению расхода энергии на их дальнейшее диспергирование.
Разрушение материалов может быть облегчено при использовании эффекта Ребиндера – адсорбционного понижения порочности твёрдых тел. Этот эффект заключается в уменьшении поверхностной энергии с помощью поверхностно-активных веществ, в результате чего облегчается деформирование и разрушение твёрдого тела. В качестве таких поверхностно-активных веществ, называемых в данном случае понизителями твердости, могут быть использованы, например, жидкие металлы для разрушения твёрдых металлов или типичные ПАВ.
Для понизителей твёрдости характерны малые количества, вызывающие эффект Ребиндера, и специфичность действия. Добавки, смачивающие материал, помогают проникнуть среде в места дефектов и с помощью капиллярных сил также облегчают разрушение твёрдого тела. Поверхностно-активные вещества не только способствуют разрушению материала, но и стабилизируют дисперсное состояние, препятствуя слипанию частиц.
Системы с максимальной степенью дисперсности могут быть получены только с помощью конденсационных методов.
§3.Молекулярно-кинетические свойства дисперсных систем
Частицы дисперсной фазы, имеющие размеры, сопоставимые с размерами молекул, участвуют в тепловом движении, что обусловливает определенное сходство коллоидных свободнодисперсных систем с молекулярными растворами.
По этой причине для них характерны явления, связанные с направленным переносом частиц в результате теплового движения, объединяемые общим названием молекулярно-кинетические явления . К ним относятся диффузия, осмос, а также броуновское движение, обусловленное тепловым движением молекул среды.
Остановимся подробнее на указанных явлениях.
Диффузия – процесс выравнивания концентрации молекул или коллоидных частиц, обусловленный их тепловым движением. Процесс переноса осуществляется при наличии градиента концентрации.
Главной характеристикой диффузии служит плотность диффузионного потока j d – количество вещества ( m ), переносимого в единицу времени ( t ) через единицу площади поверхности ( S ), перпендикулярной направлению переноса:

Если в среде имеется градиент концентрации С , характеризующий её изменение на единицу длины в направлении х (одномерный случай), то в изотропной (однородной по всем направлениям) покоящейся среде

где D – коэффициент диффузии, имеющий размерность [ м 2 /с ]; знак «минус» указывает на направление потока от бóльших концентраций к меньшим.
Уравнение (XIII.3) называется первым законом Фика .
Связь коэффициента диффузии с радиусом частиц ( r ) и вязкостью дисперсионной среды ( η ) имеет вид:

где k – константа Больцмана, T – абсолютная температура.
Это выражение впервые получено Эйнштейном (1908), оно применимо к частицам сферической формы.
Осмос – самопроизвольный перенос вещества через полупроницаемую мембрану, разделяющую два раствора (дисперсные системы) разной концентрации или раствор (дисперсную систему) и чистый растворитель (дисперсионную среду).
Характерное свойство полупроницаемой мембраны заключается в том, что через неё, как правило, способны проникать молекулы растворителя (дисперсионной среды), но не проникают молекулы растворенного вещества (частицы дисперсной фазы).
В результате идёт процесс выравнивания концентраций за счёт перехода растворителя (дисперсионной среды) из менее концентрированной системы в более концентрированную. Он будет идти до тех пор, пока его мольная доля в обоих объёмах не станет одинаковой.
Дополнительное давление, которое нужно приложить к раствору (дисперсной системе) для того, чтобы предотвратить поступление в него растворителя (дисперсионной среды) через полупроницаемую мембрану, называется осмотическим давлением.
Осмотическое давление ( π ) в разбавленных растворах недиссоциирующих веществ или дисперсных системах (золях) описывается следующим соотношением:

где С – число частиц в единице объема.
Приведенное соотношение (XIII.5) называется уравнением Вант-Гоффа.
Из уравнения (XIII.5) видно, что осмотическое давление увеличивается с ростом числа частиц в единице объёма даже при постоянной массе дисперсной фазы.
Из соотношения (XIII.5) также следует, что осмотическое давление в коллоидных системах должно быть очень мало по сравнению с давлением в истинных растворах, так как при одной и той же массовой концентрации в истинных растворах размеры частиц значительно меньше, а концентрация частиц соответственно больше.
Наиболее существенная черта всех осмотических процессов – увеличение объема раствора или дисперсной системы. Оно всегда имеет место, если молекулы растворенного вещества не могут выйти из раствора, а растворитель способен проникать в раствор.
Характерной особенностью дисперсных систем является возможность непосредственного наблюдения теплового движения частиц – броуновского движения, впервые обнаруженного английским ботаником Р.Броуном (1827).
Наблюдая в микроскоп за частицами пыльцы растений, находящимися в воде, Броун обнаружил, что они находятся в непрерывном движении. Опыты с мельчайшими крупинками различных веществ (минеральных и органических) показали, что независимо от природы вещества при достаточно сильном измельчении всегда наблюдается подобное хаотическое движение частиц.
Проведенными исследованиями была доказана природа броуновского движения. Молекулы среды (жидкости или газа) сталкиваются с частицей дисперсной фазы, в результате чего она получает огромное число ударов со всех сторон. Если частица имеет сравнительно большой размер, то число этих ударов велико, и по соответствующему закону статистики результирующий импульс оказывается равным нулю, такая частица не будет двигаться под действием теплового движения молекул. Кроме того, частицы с большой массой обладают инерционностью и мало чувствительны к ударам молекул. Очень малые частицы (в ультрамикрогетерогенных системах) имеют значительно меньшие массу и поверхность. На такую частицу будет приходиться существенно меньшее число ударов, поэтому вероятность неравномерного распределения импульсов, получаемых с разных сторон, увеличивается. Это происходит как вследствие неодинакового числа ударов с разных сторон частицы, так и вследствие различной энергии молекул, сталкивающихся с частицей. В зависимости от размеров и формы частица приобретает колебательное, вращательное или поступательное движение.
Таким образом, броуновское движение является следствием теплового движения молекул дисперсионной среды и прямым отражением законов статистики.
§4. Устойчивость дисперсных систем
Под устойчивостью дисперсных систем понимают постоянство во времени свойств таких систем – характера распределения частиц дисперсной фазы в объёме, а также их дисперсности.
Проблема устойчивости дисперсных систем является одной из важнейших. Она имеет огромное значение для протекания многих процессов – природных и промышленных.
Обеспечение устойчивости необходимо при получении промывочных жидкостей, тампонажных (цементных) растворов, водотопливных эмульсий и т. д.
Снижение устойчивости требуется для разрушения водонефтяных эмульсий, при очистке промышленных выбросов, удалении шлама выбуренной породы и т. д.
Устойчивость дисперсных систем подразделяют на два вида: устойчивость к осаждению частиц дисперсной фазы (седиментация) и устойчивость к их укрупнению (агрегация).
Эти процессы характерны для свободнодисперсных систем, хотя укрупнение частиц в определенных условиях возможно и в связнодисперсных системах.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Лако-красочные материалы — производство
Видео:Урок 132. Основные понятия гидродинамики. Уравнение непрерывностиСкачать

Технологии и оборудование для изготовления красок, ЛКМ
Видео:Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Два общих метода получения дисперсных систем. Диспергирование
Диспергирование и конденсация — методы получения свободно — дисперсных систем: порошков, суспензий, золей, в том числе аэрозолей, эмульсий и т. д. Под диспергированием понимают дробление и измельчение вещества, под конденсацией — образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты.
В мировом производстве различных веществ и материалов процессы диспергирования и конденсации занимают одно из ведущих мест. Миллиарды тонн сырья и продуктов получают в свободнодисперсном состоянии. Это обусловлено особенностями вещества в дисперсном состоянии, которые обеспечивают удобство расфасовки, транспортирования, дозировки, способствуют увеличению скоростей химических реакций и процессов растворения, выщелачивания, сорбции, экстракции и других процессов, дают возможность получать однородные материалы при составлении смесей и материалы с более высокими проч
ностными свойствами, с большой удельной поверхностью (катализаторы, сорбенты).
В качестве примеров можно привести дробление и измельчение руд, добычу и транспортирование каменного угля, производство цемента, минеральных солей и удобрений, которые выпускаются в порошкообразном состоянии. Диспергирование происходит в форсунках при сжигании жидкого топлива, при подготовке шихты, в массообменных аппаратах. Конденсация происходит при образовании тумана в производстве серной и фосфорной кислот, в ректификационных аппаратах, при кристаллизации, упаривании растворов. За последние годы резко возрос выпуск эмульсионных, аэрозольных и пастообразных продуктов: смазок, кремов, паст, парфюмерных средств, лекарственных препаратов, средств защиты растений и т. д.
Необходимо отметить, что при диспергировании и конденсации образование дисперсных систем (порошкообразование, во — локнообразование, пленкообразование) сопровождается возникновением новой поверхности, т. е. увеличением удельной площади поверхности веществ и материалов иногда в тысячи и более раз. Поэтому получение дисперсных систем, за некоторым исключением (например, самопроизвольное диспергирование, которое рассматривается в разделе, посвященном устойчивости дисперсных систем), требует затраты энергии.
Рассмотрим диспергирование веществ в конденсированном состоянии. Чтобы разрушить твердое тело или жидкость и получить новую поверхность, необходимо преодолеть когезионные силы, или силы, обусловливающие целостность определенного объема твердого тела или жидкости. При диспергировании под действием внешних сил конденсированное вещество сначала претерпевает объемное деформирование (упругое и пластическое) и только после этого при определенном механическом усилии оно разрушается. Таким образом, работу, необходимую для диспергирования, можно разделить на две составляющие, одна из которых расходуется на объемное деформирование тела, другая — на образование новых поверхностей.
Работа упругого и пластического деформирования пропорциональна объему тела:
Где k — коэффициент пропорциональности, равный работе объемного деформирования единицы объема конденсированного тела; V — объем тела.
Работа образования новой поверхности при диспергировании пропорциональна приращению поверхности:
Где а — энергия образования единицы поверхности, или поверхностное натяжение; As — приращение поверхности, или площадь образовавшейся поверхности.
Полная работа, затрачиваемая на диспергирование, выражается уравнением Ребиндера:
Так как работа объемного деформирования пропорциональна объему тела, a V
d3 (d — линейный размер тела), и изменение поверхности пропорционально его начальной поверхности, s
Где k и ki — коэффициенты пропорциональности.
Из соотношения (11.203) следует, что при больших размерах тела (при больших значениях D) можно пренебречь работой образования поверхности, тогда
Т. е. полная работа диспергирования определяется, главным образом, работой упругого и пластического деформирования.
Соотношение (11.204) можно использовать для вычисления работы дробления как первого этапа диспергирования до сравнительно крупных кусков материала.
При малых значениях а, когда можно пренебречь работой объемного деформирования, уравнение (II.203) переходит в соотношение
Чем мельче диспергируемый материал, тем лучше должно выполняться соотношение (11.205). Таким образом, это соотношение можно использовать для определения работы измельчения — второго этапа диспергирования. На этом этапе, как следует из соотношения (11.205), полная работа диспергирования определяется, главным образом, работой образования новой поверхности, т. е. работой по преодолению когезионных сил.
При дроблении и измельчении материалы разрушаются в первую очередь в места, прочностных дефектов (макро — и микротрещин). Поэтому по мере измельчения прочность частиц возрастает, что обычно используют для создания более прочных материалов. В то же время увеличение прочности материалов по мере их измельчения ведет к большему расходу энергии на дальнейшее их диспергирование.
Разрушение материалов может быть облегчено при использовании эффекта Ребиндера — адсорбционного понижения прочности твердых тел. Этот эффект заключается в уменьшении поверхностной энергии с помощью поверхностно-активных веществ, в результате чего облегчается деформирование и раз-( рушение твердого тела. В качестве таких поверхностно-активных веществ, называемых в данном случае понизителями твердости, могут быть использованы, например, жидкие металлы для разрушения твердых металлов, органические вещества для уменьшения прочности органических монокристаллов.
Для понизителей твердости характерны малые количества, вызывающие эффект Ребиндера, и специфичность действия. Добавки, смачивающие материал, помогают проникнуть среде в места дефектов и с помощью капиллярных сил также облегчают разрушение твердого тела. Поверхностно-активные вещества не только способствуют разрушению материала, но и стабилизируют дисперсное состояние, так как, покрывая поверхность частиц, они тем самым препятствуют обратному слипанию их или слиянию (для жидкостей). Это также способствует достижению высокодисперсного состояния.
Для получения дисперсных систем методом диспергирования широко используют механические аппараты: дробилки, мельницы, жернова, ступки, краскотерки, вальцы, встряхивате — ли. Жидкости распыляются и разбрызгиваются с помощью форсунок, центрифуг, волчков, вращающихся дисков. Диспергирование газов осуществляют, главным образом, с помощью барботирования их через жидкость. Часто для диспергирования жидкостей, полимеров, легкоплавких металлов, графита и других материалов используют ультразвуковой метод. Он основан на превращении электрической энергии с помощью пьезоэлектрического осциллятора в ультразвуковые колебания (от 20 тыс. до 1 млн. колебаний в 1 с), вызывающие повышение давления в среде до сотен мегапаскалей (МПа), под действием которого происходит разрушение материала.
Несмотря на широкое применение диспергационных методов, они не могут быть использованы для получения дисперсных систем максимальной дисперсности—1—100 нм. Такие системы могут быть получены только с помощью конденсационных методов.
📸 Видео
Адиабатный процесс. 10 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Галилео. Эксперимент. Поверхностное натяжениеСкачать

ЛР-10-2-03 Определение коэффициента поверхностного натяжения методом отрыва капельСкачать

Гальванический элементСкачать

Уравнивание реакций горения углеводородовСкачать

Коллоидная химия. Лекция 1. Физико-химия поверхностных явленийСкачать

Предельные вероятности состоянийСкачать

Поверхностные явления: адгезия, смачивание, адсорбция | Коллоидная химияСкачать

Матвеенко В. Н. - Коллоидная химия - Электрические свойства дисперсных системСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Матвеенко В. Н. - Коллоидная химия - Поверхностно-активные веществаСкачать

Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Урок 420. Дифракция света. Дифракционная решеткаСкачать