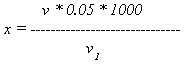Принцип определения. По количеству трилона Б – натриевой соли этилендиаминотетрауксусной кислоты (порошок белого цвета), пошедшего на титрование пробы воды с индикатором эриохромом черным Т, рассчитывают содержание растворенных в ней солей кальция и магния. Так как индикатор меняет свою окраску не только от изменения концентрации ионов кальция и магния, но и в зависимости от рН раствора, в титруемый раствор добавляют буферную смесь (NH4OH + NH4Cl), поддерживающую рН около 10.
Реактивы:
Раствор трилона Б, 0,05 н. раствор: растворяют 9,3 г трилона Б в дистиллированной воде с последующим доведением объема до 1 л.
Буферный раствор: 20 г химически чистой NH4Cl растворяют в дистиллированной воде, добавляют 100 мл 20 %‑ного раствора NH4OH и доводят объем дистиллированной водой до 1 л.
Раствор индикатора: 0,5 г эриохрома черного Т растворяют в 10 мл буферного раствора и доводят объем 96 %‑ным этиловым спиртом до 100 мл.
Ход анализа. В коническую колбу емкостью 200–250 мл наливают 50 мл исследуемой воды, добавляют 5 мл буферной смеси и 10–15 капель индикатора эриохрома черного Т (до появления интенсивного вишнево‑красного цвета). При непрерывном покачивании колбы пробу титруют раствором трилона Б. По мере прибавления трилона Б вишнево‑красный цвет переходит в лиловый. С этого момента титрование следует проводить медленнее. Окончание титрования устанавливают по появлению синего цвета с зеленоватым оттенком.
Расчет. Содержание растворимых в воде солей кальция и магния вычисляют но формуле:
где х – количество растворимых в воде солей кальция и магния, мг‑экв/л;
v – количество трилона Б, пошедшее на титрование, мл;
0,05 – нормальность трилона;
1000 – пересчет на 1 л воды;
v1 – объем исследуемой воды, мл.
Для перевода в градусы жесткости полученную цифру умножают на 2,8.
Определение общей жесткости лучше проводить по таблице 2, составленной В.П. Дацкевичем. В таблице нужно найти цифру, равную количеству трилона Б, пошедшему на титрование. В левой (вертикальной) графе указаны градусы жесткости, в верхней (горизонтальной) – десятые доли градуса. Таблица составлена для анализа, проведенного в 100 мл воды 0,1 н. раствором трилона Б или 0,05 н. раствором, но при исследовании 50 мл воды.
Чтобы приготовить воду нужной жесткости для общего, а в особенности для нерестового аквариумов, сначала следует определить жесткость водопроводной и дистиллированной воды, из которых будет составляться вода для аквариума. Химически обессоленная вода имеет нулевую жесткость. Пользуясь данными таблицы 3, водопроводную воду смешивают с химически обессоленной и получают воду нужной жесткости. Предварительно водопроводную воду подогревают до 90° в течение 30 минут и охлаждают.
Пример. Для аквариума, где будут нереститься неоновые рыбы, требуется вода жесткостью 3°, а мы располагаем водопроводной водой, жесткость которой 8°. В левой вертикальной графе указана требуемая жесткость воды, в горизонтальной графе – жесткость водопроводной воды. В‑горизонтальной графе под цифрой 8 находим цифру, соответствующую 3° жесткости вертикальной графы, – 1666. Значит, для получения воды жесткостью 3° к 1 л водопроводной воды нужно добавить 1666 мл дистиллированной. Далее делаем пересчет на все количество воды нерестового аквариума.
Содержание водородных ионов в воде (рН)
Небольшая часть молекул воды диссоциирована на водородные (Н) и гидроксильные ионы (ОН). В химически чистой воде молярные концентрации этих ионов равны и при 25° составляют 10
7 моль/л. Таким образом, величина произведения обеих концентраций равна 10
14 . Эта величина остается постоянной и в присутствии веществ, при диссоциации которых образуются водородные и гидроксильные ионы. Поэтому вполне достаточно установить концентрацию одного из них. Практически определяют концентрацию водородных ионов.
Поскольку концентрация водородных ионов может иметь самое различное значение и подразделяться на несколько порядков, принято выражать ее величиной рН, представляющей собой десятичный логарифм концентрации ионов водорода, взятый с обратным знаком:
(Н+) = 10 ‑рН , pH = – lg(H + ).
Определение концентрации водородных ионов осуществляется в интервале от 1 до 10
14 мг‑экв/л, что соответствует величине рН от 0 до 14; рН 7 отвечает нейтральному состоянию раствора. меньшие ее значения – кислотному, а более высокие – щелочному.
На концентрацию водородных ионов большое влияние оказывает жесткость и количество растворимого углекислого газа, а эти показатели в аквариумной воде постоянно меняются, даже в течение одних суток.
Аквариумист должен уметь определить концентрацию водородных ионов в воде, поскольку она оказывает огромное влияние на рост и развитие рыб и растений. Особое значение приобретает рН воды в периоды размножения рыб и развития икры и личинок (в первые три дня их жизни).
В аквариумной практике в зависимости от величины рН различают воду: рН от 1,0 до 3,0 – сильнокислая, рН от 3 до 5,0 – кислая, рН от 5,0 до 6,0 – слабокислая, рН от 6,0 до 7,0 – очень слабокислая, рН 7,0 – нейтральная, рН от 7,0 до 8,0 – очень слабощелочная, рН от 8,0 до 9,0 – слабощелочная, рН от 9,0 до 10,0 – щелочная и рН выше 10,0 – сильнощелочная. Для нормальной жизни и размножения большинства аквариумных рыб наиболее подходящей является вода, рН которой колеблется от 6 до 8, а для большинства растений оптимальным является рН от 6 до 6,5.
Дата добавления: 2016-01-26 ; просмотров: 3447 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Принцип работы системы умягчения водыСкачать

Aquaria 2 .RU
дорогие аквариумисты! с 1.12.2011 сайт aquaria2.ru превращен в памятник. на нем закрыта регистрация, создание новых материалов и комментариев.
активная версия аквариумного сайта теперь доступна по адресу http://aquaria.ru. все материалы и регистрации пользователей aquaria2, созданные до 29.11.2011, блоги, темы форума, комментарии перенесены на новый сайт.
Видео:Собираем настраиваем умягчитель и оксидайзер. Инструкция по первому запуску оксидайзера и умягчителяСкачать

Навигация
Видео:Стандартизация раствора Трилона БСкачать

Метод определения общей жесткости воды с помощью трилона Б
Принцип определения. По количеству трилона Б — натриевой соли этилендиаминотетрауксусной кислоты (порошок белого цвета), пошедшего на титрование пробы воды с индикатором эриохромом черным Т, рассчитывают содержание растворенных в ней солей кальция и магния. Так как индикатор меняет свою окраску не только от изменения концентрации ионов кальция и магния, но и в зависимости от рН раствора, в титруемый раствор добавляют буферную смесь (NH 4 OH + NH 4 Cl), поддерживающую рН около 10.
Раствор трилона Б, 0,05н. раствор: растворяют 9,3 г трилона Б в дистиллированной воде с последующим доведением объема до 1 л.
Буферный раствор: 20г химически чистой NH 4 Cl растворяют в дистиллированной воде, добавляют 100 мл 20%-ного раствора NH 4 OH и доводят объем дистиллированной водой до 1 л.
Раствор индикатора: 0,5г эриохрома черного Т растворяют в 10 мл буферного раствора и доводят объем 96%-ным этиловым спиртом до 100 мл.
Ход анализа. В коническую колбу емкостью 200-250 мл наливают 50 мл исследуемой воды, добавляют 5 мл буферной смеси и 10-15 капель индикатора эриохрома черного Т (до появления интенсивного вишнево-красного цвета). При непрерывном покачивании колбы пробу титруют раствором трилона Б. По мере прибавления трилона Б вишнево-красный цвет переходит в лиловый. С этого момента титрование следует проводить медленнее. Окончание титрования устанавливают по появлению синего цвета с зеленоватым оттенком.
Расчет. Содержание растворимых в воде солей кальция и магния вычисляют но формуле:
v * 0.05 * 1000
x = ——————————
v 1
где х — количество растворимых в воде солей кальция и магния, мг-экв/л;
v — количество трилона Б, пошедшее на титрование, мл;
0,05 — нормальность трилона;
1000 — пересчет на 1 л воды;
v 1 — объем исследуемой воды, мл.
Для перевода в градусы жесткости полученную цифру умножают на 2,8.
Определение общей жесткости лучше проводить по таблице 2, составленной В.П.Дацкевичем. В таблице нужно найти цифру, равную количеству трилона Б, пошедшему на титрование. В левой (вертикальной) графе указаны градусы жесткости, в верхней (горизонтальной) — десятые доли градуса. Таблица составлена для анализа, проведенного в 100 мл воды 0,1 н. раствором трилона Б или 0,05 н. раствором, но при исследовании 50 мл воды.
Чтобы приготовить воду нужной жесткости для общего, а в особенности для нерестового аквариумов, сначала следует определить жесткость водопроводной и дистиллированной воды, из которых будет составляться вода для аквариума. Химически обессоленная вода имеет нулевую жесткость. Пользуясь данными таблицы 3, водопроводную воду смешивают с химически обессоленной и получают воду нужной жесткости. Предварительно водопроводную воду подогревают до 90° в течение 30 минут и охлаждают.
Пример. Для аквариума, где будут нереститься неоновые рыбы, требуется вода жесткостью 3°, а мы располагаем водопроводной водой, жесткость которой 8°. В левой вертикальной графе указана требуемая жесткость воды, в горизонтальной графе — жесткость водопроводной воды. В-горизонтальной графе под цифрой 8 находим цифру, соответствующую 3° жесткости вертикальной графы,- 1666. Значит, для получения воды жесткостью 3° к 1 л водопроводной воды нужно добавить 1666 мл дистиллированной. Далее делаем пересчет на все количество воды нерестового аквариума.
Видео:Жесткость водыСкачать

Работа 36. Умягчение воды методом ионного обмена
Цель работы: проведение умягчения воды методом Н-катиониро- вания, определение остаточной жесткости воды и обменной емкости катионита.
Для приведения качества воды в соответствие с технологическими нормами проводится водоподготовка. Одним из основных процессов водоподготовки является умягчение воды — удаление из нее катионов Са 2+ и Mg 2+ . Одним из наиболее современных и широко применяемых способов умягчения воды является метод ионного обмена, который позволяет добиться наиболее глубокого умягчения воды. Ионный обмен протекает на ионитах, представляющих собой химически устойчивые твердые синтетические высокомолекулярные соединения, обладающие ионообменными свойствами. Ионы одного знака в этих соединениях закреплены на твердой полимерной матрице, а ионы другого знака, слабосвязанные с матрицей, способны переходить в раствор и замещаться на другие ионы того же знака. В зависимости от того, какие ионы переходят в раствор, различают катиониты, обратимые по катионам R»
nKt + , и аниониты, обратимые по анионам R» + nAn
Для умягчения воды используют катиониты. Воду пропускают через слой зернистого катионита, и ионы жесткости Са 2+ и Mg 2+ обмениваются на ионы катионита (Н + , Na + , реже NH>). Реакцию ионного обмена при использовании Н-катионита можно схематично представить уравнениями:
и
При Н-катионировании из воды удаляются ионы жесткости Са 2+ и Mg 2+ , а также все другие катионы солей, т.е. происходит умягчение и снижение солесодержания воды. Однако при этом вода обогащается ионами водорода Н + , уменьшается ее pH, она становится более коррозионно-агрессивной. Поэтому Н-катионирование воды обычно проводят в сочетании с ОН-анионированием, что позволяет практически полностью обессолить воду.
Максимальное количество молей эквивалентов ионов, поглощаемое 1 г катионита, называют его обменной емкостью е, ммоль экв/г. Обменную емкость катионита определяют из соотношения:
где Кв — объем воды, пропущенной через катионит, л; /н# — масса катионита, г; ДЖо — жесткость, поглощенная катионитом.
Если умягченная вода имеет некоторую остаточную жесткость Жо, ост, то: ДЖо — Жо — Жо, ост, ммоль экв/л.
В настоящей работе исходную воду определенного объема пропускают с небольшой скоростью через колонку ионообменного фильтра, содержащего Н-катионит известной массы. После Н-катионирования проводят определение остаточной общей жесткости воды методом титрования трилоном Б с Са-ИСЭ и контролем по индикатору, как описано в лабораторной работе 36.
Вопросы и задачи для самоконтроля
- 1. Можно ли обессолить воду с помощью ионного обмена?
- 2. Какой процесс следует проводить для умягчения воды: катио- нирования или анионирования? Составьте уравнения реакций, протекающих при умягчении воды с помощью ионного обмена.
3. Общая жесткость воды равна 4 ммоль/л. Через ионнообменный фильтр пропущено 100 л Н20. Сколько молей ионов Са 2+ и Mg 2+ задержано фильтром, если известно, что жесткость снизилась до 0,5 ммоль/л?
Оборудование: бюретка на 25 мл, колонка с Н-катионитом или Na- катионитом известной массы, стакан химический на 500 мл, мерный цилиндр на 100 мл, колба коническая.
Реактивы: вода природная или отстоявшаяся водопроводная, 0,1 н. (0,05 М) раствор трилона Б, аммиачный буфер (pH = 10), раствор индикатора кислотного хром темно-синего или кристаллический эриох- ром черный Т.
1. Сформируйте табл. 7.32 экспериментальных и расчетных данных, как показано ниже. [1] [2] [3] [4] [5]
^ТБ? МЛ исходная вода
^ТБ> МЛ умягченная вода
Емкость катионита е, моль экв/г
ценной воды, аналогично тому, как была определена Ж,, исходной воды в п. 3. Результаты двух титрований запишите в ст. 4 табл. 7.32.
7. Если при добавлении индикатора в умягченную воду раствор сразу принял голубоватую окраску, то произошло полное умягчение воды: КТБ = 0 и Жо, ост = 0.
Обработка экспериментальных данных
- 1. Определите среднее значение объема титранта КСР по результатам двух титрований исходной воды. Результат запишите в ст. 2 табл. 7.32.
- 2. Рассчитайте общую жесткость исходной воды по формуле (7.49), исходя из усредненного объема титранта. Запишите полученный результат в ст. 3 табл. 7.32.
- 3. По результатам двух титрований умягченной воды определите среднее значение Vcp объема титранта, пошедшего на титрование умягченной воды. Результат запишите в ст. 4 табл. 7.32.
- 4. Рассчитайте остаточную общую жесткость умягченной воды Жо ост по формуле (7.49). Запишите полученный результат в ст. 5 табл. 7.32.
- 5. Рассчитайте по формуле (7.54) минимальную обменную емкость е катионита для умягчения измеренного объема исследуемой воды до Жо, ост- Результат запишите в ст. 7 табл. 7.32. Сделайте вывод об эффективности использованного катионита.
- 6. Запишите реакции, идущие на Н-катионите при умягчении воды.
с использованием цифровой лаборатории
В данном опыте точка эквивалентности при титровании трилоном Б определяется по скачку потенциала Са-ИСЭ, а объем титранта — по датчику жидкого реагента. Кроме того, добавляется индикатор, поэтому одновременно фиксируется и объем щелочи, при котором происходит смена окраски. Двойной контроль делает эксперимент более точным, позволяет уменьшить ошибки измерения.
Оборудование: компьютер, приставка-переходник для электродов, ионоселективный электрод Са-ИСЭ, электрод сравнения, датчик объема жидкого реагента, шприц на 10 мл, магнитная мешалка, штатив химический, штатив для электродов, стакан химический на 200 мл, мерный цилиндр на 100 мл, бюретка на 25 мл, колонка с Н-катионитом или Na-катионитом известной массы.
Реактивы: вода природная или отстоявшаяся водопроводная, 0,1 н. (0,05 М) раствор трилона Б, глициновый буфер (2 М глицин + 1 М NaOH), раствор индикатора кислотного хром темно-синего или кристаллический эриохром черный Т.
- 1. Получите у преподавателя объем воды (около 0,5 л) для анализа и колонку с катионитом известной массы та, которую запишите в ст. 1 табл. 7.32.
- 2. Проведите определение общей жесткости Ж^, исходной воды комплексонометрическим методом на установке (рис. 7.5), как описано в п. 2—13 опыта 1 лабораторной работы 35 с использованием цифровой лаборатории. Результаты двух титрований запишите в ст. 2 табл. 7.32. Отметьте объем добавленного трилона Б, при котором произошло изменение окраски индикатора.
- 3. Проведите умягчение воды, пропустив оставшуюся воду (около 300 мл) через колонку с катионитом. Вода должна вытекать из колонки со скоростью не более 1 капли в секунду.
- 4. Измерьте точно объем умягченной воды с помощью мерного цилиндра и запишите значение в ст. 6 табл. 7.32.
- 5. Проведите определение остаточной общей жесткости Ж,, ост умягченной воды комплексонометрическим методом на установке (рис. 7.5), аналогично тому, как была определена Ж*, исходной воды в п. 2. Отметьте объем добавленного трилона Б, при котором произошло изменение окраски индикатора.
- 6. Если при добавлении индикатора с буфером в умягченную воду раствор сразу принял голубоватую окраску, то произошло полное умягчение воды. То есть КТБ = 0 и Ж,, 0Ст = 0-
Обработка экспериментальных данных
- 1. Сформируйте табл. 7.32 экспериментальных и расчетных данных по результатам двух титрований.
- 2. По полученным компьютерным кривым двух титрований исходной воды определите объем трилона Б, при котором произошли скачки потенциала (наиболее резкое изменение рСа). Запишите значения в ст. 2 табл. 7.32. По результатам двух титрований определите среднее значение объема титранта Vcp. Запишите в ст. 2 табл. 7.32.
- 3. Рассчитайте общую жесткость исходной воды по формуле (7.49). Запишите полученный результат в ст. 3 табл. 7.32.
- 4. По полученным компьютерным кривым двух титрований умягченной воды определите объем трилона Б, при котором произошли скачки показателя рСа. Запишите значения в ст. 4 табл. 7.32. По результатам двух титрований определите среднее значение объема ти- транта VCf). Запишите в ст. 4 табл. 7.32. Отметьте, совпадает ли значение объема, полученного в п. 4 с объемом, при котором произошла смена окраски индикатора.
- 5. Рассчитайте остаточную общую жесткость умягченной воды Жо ост по формуле (7.49). Запишите полученный результат в ст. 5 табл. 7.32.
- 6. Рассчитайте по формуле (7.54) обменную емкость е катионита, необходимую для умягчения измеренного объема исследуемой воды до Жо ост. Результат запишите в ст. 7 табл. 7.32. Сделайте вывод об эффективности ионного обмена на данном катионите.
- 7. Запишите реакции, идущие на Н-катионите при умягчении воды.
🎬 Видео
Видеолекция 10. Умягчители. Из чего состоят и как работают.Скачать

Почему не работает умягчитель? Как настроить умягчитель. Очистка воды.Скачать

Чистка умягчителя воды, как проводить правильно и зачем. Регенерация ионообменной смолы.Скачать

Жесткость воды и способы её устранения. Видеоурок 23. Химия 9 классСкачать

Ионообменная смолаСкачать

СИСТЕМА УМЯГЧЕНИЯ ВОДЫ | УМЯГЧИТЕЛЬ ВОДЫ | DISTELСкачать

Стресс-тест методов измерения жесткости водыСкачать

Видеолекция 11 часть 1. Умягчители. Подбор и расчет ПО ШАГАМ.Скачать

269. Как самому настроить фильтр Умягчения / Смягчения воды / KrausenСкачать

Как выбрать фильтр умягчитель воды? Оборудования для смягчения водыСкачать

Ионообменные фильтрыСкачать

Жесткость воды (соли жесткости)Скачать

Как работает умягчитель воды.Скачать

Видеолекция 8. Методы умягчения воды. Водоочистка.Скачать

Умягчитель от железа, марганца и жесткости, Экотар В. Pentair 368. ochistkavodi.ruСкачать

Настройка клапана RUNXIN F116Q3 от компании Termoshop.ruСкачать