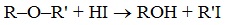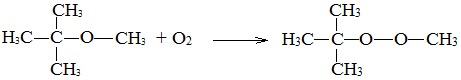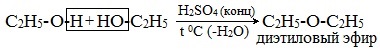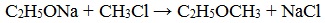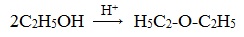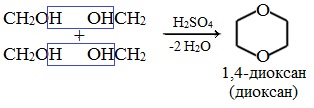Некоторые способы получения простых эфиров были рассмотрены при изучении галогеналканов, алкенов, одноатомных спиртов. В данном разделе подробнее рассмотрим получение, физические и химические свойства простых эфиров .
Видео:13.3. Сложные эфиры: Химические свойстваСкачать

Получение простых эфиров
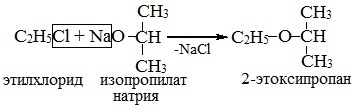
- Реакция Вильямсона – взаимодействие галогенированных углеводородов с алкоголятами:
При этом способе получения используются первичные реагирующие соединения.
- Межмолекулярная дегидратация спиртов протекает под действием окиси алюминия и температуре 300°С или серной кислоты как дегидратирующего агента. В результате получают симметричные простые эфиры, например, по этому принципу получают серный эфир (диэтиловый эфир):
Его получение происходит в 2 стадии. Сначала, при взаимодействии этанола с избытком серной кислоты, получается этилсерная кислота, которая, затем реагирует с новой порцией этанола с образованием диэтилового эфира:
- Каталитическое присоединениеспиртов к олефинам или алкинам:
При присоединении спиртов к алкинам образуются виниловые эфиры:
- Оксимеркурирование алкенов протекает в несколько стадий. Сначала при действии на алкены ацетата ртути в водном растворе тетрагидрофурана (ТГФ) или в водной уксусной кислоте при 20°С образуется ртутьорганические соединения. При этом присоединение ацетата ртути к алкену происходит согласно правилу Марковникова. Далее при воздействии таких растворителей как спирты, уксусная кислота, ацетонитрил и др. получаются простые эфиры:
Видео:Простые эфиры. Получение. Все 4 реакции ЕГЭ.Скачать

Физические свойства
Простые эфиры — это прозрачные бесцветные жидкости, обладающие характерным «эфирным» запахом. Они являются легколетучими и пожароопасными.
Растворимость простых эфиров
Простые эфиры растворимы в протонных кислотах, что связано с основными свойствами эфирного кислорода. Этот кислород имеет две свободные электронные пары, которые не могут использоваться для проявления обычной валентности и принять электроны. Однако для осуществления связи кислород может предоставить свою электронную пару в общее пользование:
В зависимости от строения эфира, они могут иметь хорошую растворимость в воде или вовсе не растворяться (см. таблицу ниже). В большинстве органических растворителей простые эфиры хорошо растворимы.
Точки плавления и кипения простых эфиров
Простые эфиры кипят при гораздо более низких температурах, чем соответствующие спирты. Например, метиловый спирт кипит при +65°С, а метиловый эфир – при -23,7°С. Это связано с тем, что эфиры, в отличие от спиртов, лишены гидроксильного водорода и поэтому не имеют возможности образовывать водородные связи, объединяющие одну молекулу с другой. Т.е. простые эфиры не способны к ассоциации молекул.
Видео:Простые эфиры. Химические свойства. Все 3 реакции ЕГЭ.Скачать

Химические свойства простых эфиров
Простые эфиры – малореакционноспособная группа органических соединений, проявляющие слабоосновные свойства. Они могут расщепляются лишь некоторыми веществами при нагревании (концентрированной йодистоводородной кислотой или воздействием металлического натрия). Водные растворы кислот и щелочей не действуют на простые эфиры.
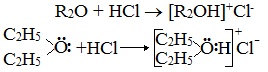
- Образование оксониевых солей при воздействии сильных кислот:
- Образование комплексных соединений с солями (Меервейн Г.Л.):
- Расщепление простых эфиров:
Под действием концентрированных йодоводородной или бромоводородной кислот:
Под действием активных металлов при повышенной температуре (Шорыгин П.П.):
Под действием серной кислоты:
- Окисление простых эфиров происходит с образованием перекисных соединений (автоокисление):
Простые эфиры при хранении легко окисляются кислородом воздуха с образованием перекисей. При использовании простых эфиров, особенно при перегонке их необходимо хорошо очистить от накопленных перекисей, которые могут стать причиной взрыва.
Видео:Сложные эфиры за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать

Простые эфиры химические свойства уравнения
Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R’–O–R», где R’ и R» — различные или одинаковые радикалы.
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
предельные
непредельные
ароматические
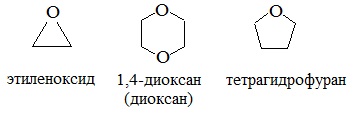
циклические
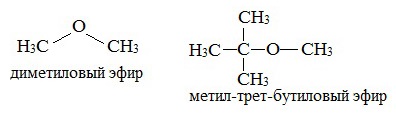
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир». Например, CH3-O-CH3 — диметиловый эфир; C2H5-O-CH3 — метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО – (в одной молекуле спирта) на группу RO – (от другой молекулы):
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R’ образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
В этой реакции происходит нуклеофильное замещение галогена (Cl – ) на алкоксигруппу (CH3O – ):
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры) этиленоксид (эпоксид) 
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (CH3CH2)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Видео:ХИМИЯ ЕГЭ - Простые эфиры: строение, изомерия, физические свойстваСкачать

Урок №61—62. Химические свойства и получение спиртов. Простые эфиры
Простые эфиры — органические вещества, имеющие формулу R-O-R’, где R и R’ — алкильные, арильные или другие заместители.
Простые эфиры являются летучими жидкостями с приятным запахом. Широко используются как растворители в промышленности и лаборатории.
Химические свойства
1. Простые эфиры галогенируются по атому, соседнему с кислородом:
2. Расщепление простых эфиров
При действии концентрированными йодоводородной или бромоводородной кислот на простые эфиры происходит расщепление эфира на спирт и галогеналкан:
R–O–R + HI → R–OH + R–I
Если простой эфир несимметричен, присоединение галогена происходит неселективно, в результате образуется смесь двух спиртов и двух галогенидов:
2R–O–R’ + 2HI → R–OH + R’–OH + R–I + R’–I
3. Горение
Получение
1. Гидрирование
2. Межмолекулярная дегидратация
При действии на первичные спирты концентрированной серной кислоты в мягких условиях происходит межмолекулярная дегидратация, образуется простой эфир. Обычно реакцию проводят при температуре около 140°С.
3. Реакция Вильямсона
Реакция Вильямсона — реакция получения простых эфиров из галогеналканов и алкоголятов спиртов.
Простейшая реакция получения простых эфиров — межмолекулярная дегидратация спиртов пригодна только для получения симметричных простых эфиров, а реакция Вильямсона позволяет получать простые эфиры почти любого строения.
Смесь алкилгалогенида и алкоголята щелочного металла кипятят. Галоген (как правило, хлор или бром) и ион металла образуют соль, а оставшиеся свободные частицы соединяются в простой эфир:
Применение
1. Простые эфиры используются как растворители для жиров, смол, красителей и лаков.
2. Также они используются в качестве растворителей в органических реакциях.
3. Некоторые эфиры применяют как анестетики, топливные присадки для повышения октанового числа и смазочные масла.
Анестетики — лекарственные средства, обладающие способностью вызывать уменьшения чувствительности тела или его части вплоть до полного прекращения восприятия информации об окружающей среде и собственном состоянии — анестезию.
4. Некоторые простые эфиры являются инсектицидами и фумигантами, поскольку их пары токсичны для насекомых.
5. Ароматические простые эфиры находят применение в качестве антиоксидантов и консервантов.
6. Некоторые ароматические простые эфиры имеют приятный запах, благодаря чему их используют в парфюмерной промышленности
🎥 Видео
Сложные эфиры и мыла. 1 часть. 11 класс.Скачать

13. Простые эфиры. Номенклатура, изомерия, получение, физические и химические свойства, применениеСкачать

13.1. Сложные эфиры: строение, номенклатура, изомерия. ЕГЭ по химииСкачать

47. Простые и сложные эфиры (часть 1)Скачать

Опыты по химии. Получение сложного эфираСкачать

Сложные эфиры. Химические свойства. Все 5 реакций ЕГЭ.Скачать

Сложные эфиры и мыла. 2 часть. 11 класс.Скачать

13.2. Сложные эфиры: Способы полученияСкачать

7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Сложные эфиры | Органическая химия ЕГЭ, ЦТСкачать

7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Вся теория по спиртам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать