Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
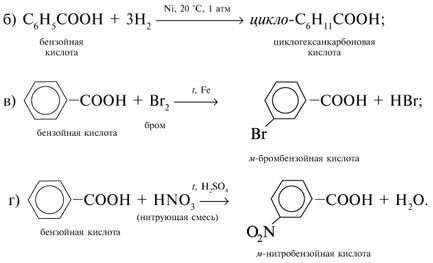
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
Видео:ПЕНТАХЛОРИД ФОСФОРА, ХЛОРСУЛЬФОНОВАЯ КИСЛОТА и многое другое!Скачать  Урок 27. Химические свойства карбоновых кислотРассмотрим химические свойства карбоновых кислот на примере уксусной кислоты.
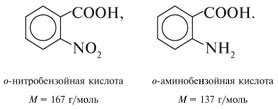
Если М = а = 90, то у = (3,26 – 0,03•90)/14 = 0,56/14 = 0,04 моль, что не соответствует условию задачи, где х + у = 0,03 моль. Если М = а = 104, то у = (3,26 – 0,03•104)/14 = 0,01 моль. Следующий гомолог: М = а = 118 г/моль не подходит, т.к. тогда количество вещества у = (3,26 – 0,03•118)/14 = –0,02 моль – отрицательная величина. Ответ. В состав смеси входили кислоты НООССН2СООН (0,02 моль) и НООССН2СН2СООН УПРАЖНЕНИЯ. 1. Составьте уравнения реакций бензойной кислоты С6Н5СООН со следующими реагентами: 2. Запишите уравнения реакций бензойной кислоты, в которых происходит расщепление связи 3. Составьте уравнения реакций, с помощью которых изобутановую кислоту (СН3)2СНСООН можно превратить в следующие соединения: а) изобутират натрия (СН3)2СНСООNa; 4. Составьте уравнения реакций: а) декарбоксилирование бензойной кислоты С6Н5СООН до бензола под действием горячего раствора КМnО4; б) восстановление бензольного кольца бензойной кислоты (Н2, Ni, 20 °С, 1 атм) с образованием циклогексанкарбоновой кислоты; 5. Неизвестная кислота может быть либо орто-нитробензойной кислотой (tпл = 147 °С), либо орто-аминобензойной (антраниловой) кислотой (tпл = 146 °С). При нейтрализации 0,201 г образца этой кислоты расходуется 12,4 мл раствора щелочи с концентрацией 0,098 моль/л NaOH. Какая это кислота? 6. К 24,4 г смеси уксусной и муравьиной кислот прибавили 227,3 мл 10%-го раствора гидроксида натрия (плотность – 1,1 г/мл). Для связывания избытка щелочи с образованием кислой соли потребовалось 2,8 л (н.у.) оксида серы(IV). Определите состав исходной смеси кислот. 7. После прокаливания натриевой соли пропионовой кислоты RCOONa получен белый остаток, растворимый в воде. Этот остаток изменяет окраску влажного красного лакмуса в синий цвет и реагирует с разбавленной соляной кислотой с выделением пузырьков газа. Какой возможный состав остатка? Напишите уравнение реакции термического разложения натриевой соли пропионовой кислоты во влажном воздухе. Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Ответы на упражнения к теме 2Видео:Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  Урок 271. а) С6Н5СООН + КОН 2. 3. 4. 5. Найдем количество вещества NaOH в объеме V = 12,4 мл (0,0124 л) раствора с молярной концентрацией cмол(NaOH) = 0,098 моль/л:
Количества веществ одноосновной кислоты RCOOH и щелочи NaOH, расходуемые в реакции нейтрализации, одинаковые, т.е. Ответ. орто-Нитробензойная кислота. 6. Масса NaOH, содержащегося в заданном объеме V = 227,3 мл с концентрацией c(NaOH) = 10% и плотностью Избыток щелочи (m*) найдем из уравнения реакции: В реакции со смесью кислот НСООН и СН3СООН израсходовалось 20 г NaOH.
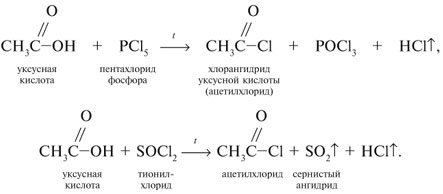
Запишем уравнения реакций: Расход количества вещества щелочи в реакциях (1) и (2) такой же, как у кислот. Зная общую массу смеси кислот (m(смеси) = 24,4 г) и расход щелочи (20 г), составим систему двух уравнений с двумя неизвестными: Решая систему, найдем: у = 0,1 моль, z = 0,4 моль. По массе это составляет: m(CH3COOH) = 0,1•60 = 6 г, Концентрация в процентах по массе: Ответ. Состав исходной смеси кислот – 6 г (24,6%) СН3СООН и 18,4 г (75,4%) НСООН. 7. Уравнение реакции термического разложения натриевой соли пропионовой кислоты во влажном воздухе: Белый остаток после прокаливания – это сода Na2CO3. В воде сода растворяется и гидролизуется: Образующаяся щелочь NaOH окрашивает красный лакмус в синий цвет. Сода реагирует с кислотой НСl с выделением газа СО2: Видео:Свойства карбоновых кислот | Химия ЕГЭ 10 класс | УмскулСкачать  Уксусной кислоты с хлоридом фосфора 5. Химические свойстваКарбоновые кислоты образуют разнообразные производные (сложные эфиры, ангидриды, амиды и др.), которые участвуют во многих важных реакциях. Общая формула производных карбоновых кислот: где ацильный радикал может быть связан с остатками (Х ) спирта, аммиака, карбоновой кислоты и других соединений, образуя соответствующие производные. 4.2.2.1 ГАЛОГЕНАНГИДРИДЫ – (ацилгалогениды) кислот рассматривают функциональные производные, которые получаются замещением ОН -группы карбоксила на галоген. Простейшие галогенангидриды карбоновых кислот представляют собой жидкости с резким запахом. Они энергично реагируют с водой, образуя соответствующие карбоновые кислоты. Вследствие малой подвижности ОН -группы в карбоксиле это замещение осуществляют при взаимодействии карбоновых кислот с галогенидами фосфора или хлористым тионилом как более сильными нуклеофилами. Видео:Получение ортофосфорной кислоты!#химиядома#фосфорнаякислота#оксидфосфора5Скачать  1. Взаимодействие с хлоридом фосфора (V):Видео:Кислоты фосфора, которых боятся все! | Химия ЕГЭ 2023 | УмскулСкачать  2. Взаимодействие с тионилхлоридом:Характеристика реакционной способности. Галогенангидриды относятся к соединениям с высокой реакционной способностью. Они легко обменивают галоген на нуклеофильные группы, поскольку на реакционном центре (С -атоме карбонильной группы) имеется дефицит электронов, эти превращения могут быть отнесены к S N реакциям. Для ацилгалогенидов характерна большая полярность связей, что вызвано электроноакцепторным действием атома галогена. Электронная плотность на углеродном атоме карбоксильной группы сильно занижена. Ацилгалогениды обладают сильными электрофильными свойствами. Химические свойства. Хлорангидриды применяются в качестве ацилирующих средств для введения ацильного радикала в различные классы органических соединений. Видео:Синтез ПЕНТАХЛОРИДА ФОСФОРАСкачать  1. Гидролиз:5. Получение пероксидов ацилов. Перекись ацила образуется при взаимодействии растворов хлористого ацетила в эфире или пентане с пероксидом водорода и гидроксидом натрия или с пероксидами металлов (пероксидами натрия или бария): 6. Реакции с алкоголятом натрия и ацетатом серебра: 4.2.2.2 АНГИДРИДЫ КИСЛОТ –ангидриды кислот можно рассматривать как продукты межмолекулярной дегидратации кислот. Однако реакция дегидратации протекает только в жестких условиях, и чаще всего ангидриды получают реакцией ацилирования солей карбоновых кислот хлорангидридами, при этом может быть получен и смешанный ангидрид. Ангидриды карбоновых кислот – бесцветные жидкости или кристаллические вещества. Ангидриды низших карбоновых кислот – жидкости с резким запахом, кипящие при температуре более высокой, чем соответствующие им кислоты. Ангидриды плохо растворимы в воде. Водный раствор уксусного ангидрида медленно гидролизируется. Ацидолиз карбоновых кислот: 1. Использование ангидридов как ацилирующих средств. Ангидриды, как и галогенангидриды, обладают большой химической активностью, являются хорошими ацилирующими средствами (часть 1, глава 8.5.2, часть 2, глава 2, 3.3, часть 3, глава 1), вступая в те же реакции, что и галогенангидриды, однако менее энергично: 4.2.2.3 АМИДЫ КАРБОНОВЫХ КИСЛОТ – функциональные производные кислот, в которых гидроксил карбоксильной группы замещен на аминогруппу. У амидов в аминогруппе атомы водорода могут быть замещены на углеводородные радикалы. В таком случае их называют N -алкил- или N -ариламидами. Амиды также можно рассматривать как производные аммиака, у которого атом водорода замещен на ацильный остаток. Амиды представляют собой бесцветные кристаллические вещества или жидкости, растворяющиеся в воде и органических растворителях. Амиды, в молекулах которых имеются связи N–Н , ассоциированы вследствие образования межмолекулярных водородных связей и имеют более высокие температуры кипения. В амидной группе связи делокализованы благодаря плоскому строению и наличию n ,π -сопряженной системы. Это приводит к перераспределению электронной плотности: на атоме азота электронная плотность по сравнению с аммиаком и аминами понижается, а на углеродном атоме по сравнению с альдегидами и кетонами повышается. Амиды с низкой молекулярной массой высокополярны и хорошо растворимы в воде. Их часто используют в качестве растворителей. В молекулах амидов осуществляется значительное взаимодействие между НЭП атома азота и π -электронной системой двойной связи С=О . Образуется сопряженная система связей, изменяются природа связей С–N и С–О и распределение электронной плотности. В результате связь С–N становится короче, а связь С=О несколько длиннее по сравнению с несопряженными соединениями: Сравнение основных свойств аминов и амидов. Основность амидов меньше, чем у аммиака и алифатических аминов. В молекуле амида есть два основных центра электрофильной атаки – атомы азота и кислорода, к которым может присоединяться протон. На атоме азота электронная плотность понижена и более выгодной является атака протона по кислороду, при которой сохраняется стабильная сопряженная система связей. Амиды, содержащие N – H связи, обладают слабокислыми свойствами, но являются более сильными кислотами, чем аммиак. В водном растворе амиды дают нейтральную реакцию. Однако, при взаимодействии с активными металлами амиды, содержащие N – H связи, отщепляют протон, так как при этом образуется стабилизированный делокализацией отрицательного заряда амид-анион. потеря сопряженной системы сопряженная система сохраняется У циклических амидов (имидов) кислотность выражена более ярко, так как атом азота находится под влиянием двух карбонильных групп. По сравнению с аминами амиды карбоновых кислот являются слабыми основаниями ввиду сильного взаимодействия неподеленной электронной пары атома азота с карбонильной группой. Способы получения амидов CH3COOH + PCl5 = CH3COCl(ацтилхлорид) + POCl3(хлороокись фосфора) + HCl. Вы находитесь на странице вопроса «написать уравнение реакции. а)пропиловой кислоты с гидроксидом натрия б)уксусная кислота с хлоридом фосфора (5) в). Текст доступен по лицензии Creative Commons Attribution-ShareAlike ; в отдельных случаях могут действовать дополнительные условия. Карбоновые кислоты обладают всеми свойствами обычных кислот. Вопросы — лидеры Кто знает или сможет создать очень вонючий и стойкий запах, которым можно было побрызгать или помазать и запах не провет 1 ставка. Материал из Википедии — свободной энциклопедии. Ацетилирование ацетилхлоридом часто проводят в присутствии неорганический оснований гидроксид, карбонат или ацетат натрия — реакция Шоттена-Баумана либо третичных аминов пиридинтриэтиламин — модификация Айнхорна активируют ацетилхлорид за счёт образования ацетиламмонийных солей и нейтрализуют образующийся HCl. Взаимодействие с хлоридом фосфора V: Вследствие электроноакцепторного влияния карбоксильной группы СООН атомы водорода при углероде в -положении довольно подвижные и могут замещаться на атомы хлора или брома:. Методы синтеза В промышленности ацетилхлорид синтезируют реакцией уксусной кислоты с хлоридами фосфора треххлористым или пятихлористым фосфором: Органическая плз помогите вн koko channel Ученикзакрыт 6 лет назад Дополнен 6 лет. По сравнению с аминами амиды карбоновых кислот являются слабыми основаниями ввиду сильного взаимодействия неподеленной электронной пары атома азота с карбонильной группой. Обозначим количества веществ уксусной кислоты и муравьиной кислоты:. Амиды представляют собой бесцветные кристаллические вещества или жидкости, растворяющиеся в воде и органических растворителях. В промышленности ацетилхлорид синтезируют реакцией уксусной кислоты с хлоридами фосфора треххлористым или пятихлористым фосфором:. Ирина Рудерфер Высший разум 6 лет назад при взаимодействии уксусной кислоты с металлическим натрием: Подскажите, как решить данные неравенства 1 ставка. Общая формула производных карбоновых кислот: 1. Роял рц точка biz; Ацетилхлорид также используется для ацетилирования ароматических соединений по Фриделю-Крафтсу. Белый остаток после прокаливания — это сода Na 2 CO 3. Запишите уравнения реакций бензойной кислоты, в которых происходит расщепление связи С-ОН в карбоксильной группе. Хлорангидриды получают действием хлорида фосфора V на кислоты: Обозначим количества веществ уксусной кислоты и муравьиной кислоты:. В промышленности ацетилхлорид синтезируют реакцией уксусной кислоты с хлоридами фосфора треххлористым или пятихлористым фосфором:. При нагревании амидов с водоотнимающими средствами например, с пентаоксидом фосфора Р 2 О 5 образуются нитрилы карбоновых кислот:. Видео:Специфические химические свойства карбоновых кислот | Химия ЕГЭ 10 класс | УмскулСкачать  Химические свойства. ПолучениеАцетилхлорид — это Что такое Ацетилхлорид?Видео:Фосфогипс. Фосфорная кислота. Минеральные удобрения. Химия – ПростоСкачать  АцетилхлоридА. С 2 Н 5 СОН Б. НСООН В. С 2 Н 5 СООСН 3 Г. СН 3 ОН 2. Напишите уравнения реакция: A. Этанола с пропионовой кислотой Б. Окисления муравьиного альдегида гидроксидом меди (II). B. Этилового эфира Уксусной кислоты с гидроксидом натрия. СН 4 → С 2 Н 2 → СН 3 СОН → СН 3 СООН → (CH 3 COO) 2 Mg. 4. Рассчитайте массу кислоты, полученной при нагревании 55 г 40% -го раствора этаналя с избытком гидроксида меди (II) Самостоятельная работа по теме «Кислородсодержащие органические соединения» 11 класс 1. Определите классы соединений, дайте названия веществ, формулы которых: А. СН 2 ОН-СНОН-СН 2 ОН Б. С 6 Н 5 -СН 2 ОН В. СН 3 ОСН 3 Г. СН 3 СОО СН 3 A. Пропионовой кислоты с гидроксидом натрия. Б. Уксусной кислоты с хлоридом фосфора (5). B. Гидролиза пропилового эфира уксусной кислоты (пропилэтаноата). Укажите их тип, условия осуществления и назовите исходные вещества и продукты реакций. 3. Напишите уравнения реакций, при помощи которых можно осуществить превращения по СН 4 → СН 3 С1 → СН 3 ОН → НСОН → НСООН. Укажите условия осуществления реакций и названия всех веществ. 4. Вычислите массу 60%-й уксусной кислоты, затраченной на нейтрализацию 120 г 25% -го раствора гидроксида натрия. Самостоятельная работа по теме «Кислородсодержащие органические соединения» 11 класс 1. Определите классы соединений, дайте названия веществ, формулы которых: А. С 3 Н 7 СООН. Б. С 2 Н 5 ОН В. НСООСН 3 . Г. С 6 Н 5 ОН. 2. Напишите уравнения реакций: A. Муравьиной кислоты с оксидом магния. Б. Межмолекулярной дегидратации спирта пропанол-1. B. Гидролиза тристеаринового жира. Укажите их тип, условия осуществления и назовите исходные вещества и продукты реакций. 3. Напишите уравнения реакций, при помощи которых можно осуществить превращения С 2 Н 6 →С 2 Н 5 Вr → С 2 Н 5 ОН → СН 3 СОН →СН 3 СООН. Укажите условия осуществления реакций и названия всех веществ. 4. Вычислите массу металлического серебра, полученного при окислении 600 г 40% -го раствора формалина избытком аммиачного раствора оксида серебра. Способы получения . 1 . Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве окислителей применяются />K М n О 4 и K 2 С r 2 О 7 . 2 Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих, три атома галогена у одного атома углерода. При этом образуются спирты, содержащие группы ОН у одного атома углерода — такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:/>
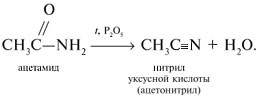
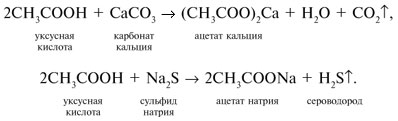
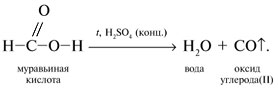
3 . Получение карбоновых кислот из цианидов (нитрилов) — это важный способ, позволяющий наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия, например:/> СН 3 -В r + NaCN → CH 3 — CN + NaBr . Образующийся нитрил уксусной кислоты (метилцианид) при нагревании легко гидролизуется с образованием ацетата аммония: CH 3 CN + 2Н 2 О → CH 3 COONH 4 . При подкислении раствора выделяется кислота: CH 3 COONH 4 + HCl → СН 3 СООН + NH 4 Cl . 4 . Использование реактива Гриньяра по схеме:/> Н 2 О 5 . Гидролиз сложных эфиров:/> R — COOR 1 + КОН → R — COOK + R ‘ OH , R — COOK + HCl → R — COOH + KCl . 6 . Гидролиз ангидридов кислот:/> (RCO ) 2 O + Н 2 О → 2 RCOOH . 7 . Для отдельных кислот существуют специфические способы получения./> Муравьиную кислоту получают нагреванием оксида углерода ( II ) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой: Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха: 2С 4 Н 10 + 5 O 2 → 4СН 3 СООН + 2Н 2 О. Для получения бензойной кислоты можно использовать окисление монозамешенных гомологов бензола кислым раствором перманганата калия: 5С 6 Н 5 -СН 3 + 6 KMnO 4 + 9 H 2 SO 4 = 5С 6 Н 5 СООН + 3 K 2 SO 4 + 6 MnSO 4 + 14 H 2 O . Кроме того, бензойную кислоту можно получить из бензальдегида с помощью реакции Канниццаро . В этой реакции бензальдегид обрабатывают 40-60%-ным раствором гидроксида натрия при комнатной температуре. Одновременное окисление и восстановление приводит к образованию бензойной кислоты и соответственно фенилметанола (бензилового спирта): Химические свойства . Карбоновые кислоты — более сильные кислоты, чем спирты, поскольку атом водорода в карбоксильной группе обладает повышенной подвижностью благодаря влиянию группы СО. В водном растворе карбоновые кислоты диссоциируют:/> RCOOH Тем не менее из-за ковалентного характера молекул карбонов ых кислот указанное выше равновесие диссоциации достаточно сильно сдвинуто влево. Таким образом, карбоновые кислоты — это, как правило, слабые кислоты. Например, этановая (уксусная) кислота характеризуется константой диссоциации К а = 1,7*10 -5 . /> Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на ее кислотность вследствие оказываемого ими индуктивного эффекта . Такие заместители, как хлор или фенильный радикал оттягивают на себя электронную плотность и, следовательно, вызывают отрицательный индуктивный эффект (-/). Оттягивание электронной плотности от карбоксильного атома водорода приводит к повышению кислотности карбоновой кислоты. В отличие от этого такие заместители, как алкильные группы, обладают электронодонорными свойствами и создают положительный индуктивный эффект, +I. Они понижают кислотность. Влияние заместителей на кислотность карбоновых кислот наглядно проявляется в значениях констант диссоциации K a для ряда кислот. Кроме того, на силу кислоты оказывает влияние наличие сопряженной кратной связи. Карбоновые кислоты Формула K a Пропионовая CH 3 CH 2 COOH 1,3*10 -5 Масляная CH 3 CH 2 CH 2 COOH 1,5*10 -5 Уксусная CH 3 COOH 1,7*10 -5 Кротоновая CH 3 — CH = CH — COOH 2,0*10 -5 Винилуксусная CH 2 =CH-CH 2 COOH 3,8*10 -5 Акриловая CH 2 =CH-COOH 5,6*10 -5 Муравьиная HCOOH 6,1*10 -4 Бензойная C 6 H 5 COOH 1,4*10 -4 Хлоруксусная CH 2 ClCOOH 2,2*10 -3 Тетроновая CH 3 — C ≡ C — COOH 1,3*10 -3 Дихлоруксусная CHCl 2 COOH 5,6*10 -2 Щавелевая HOOC — COOH 5,9*10 -2 Трихлоруксусная CCl 3 COOH 2,2*10 -1 Взаимное влияние атомов в молекулах дикарбоновых кислот приводит к тому, что они являются более сильными, чем одноосновные. 2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот: 2 RCOOH + М g → (RCOO ) 2 Mg + Н 2 , 2 RCOOH + СаО → (RCOO ) 2 Ca + Н 2 О, RCOOH + NaOH → RCOONa + Н 2 О, RCOOH + NaHCO 3 → RCOONa + Н 2 О + СО 2 . Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей: CH 3 COONa + HCl → СН 3 СООН + NaCl . Соли карбоновых кислот в водных растворах гидролизованы: СН 3 СООК + Н 2 О Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных. 3 . Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (/>X ) образуются функциональные производные кислот, имеющие общую формулу R -СО- X ; здесь R означает алкильную либо арильную группу. Хотя нитрилы имеют другую общую формулу ( R — CN ), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот. Хлорангидриды получают действием хлорида фосфора ( V ) на кислоты: R-CO-OH + РС l 5 → R-CO- Cl + РОС l 3 + HCl . 📺 ВидеоХлороводородная кислота. 9 класс.Скачать  Карбоновые кислоты. Химические свойства (часть 2). Химия 10 классСкачать  44. Карбоновые кислоты (часть 3)Скачать  Химия ЕГЭ 2022 / Задание 32Скачать  Функциональные производные карбоновых кислотСкачать 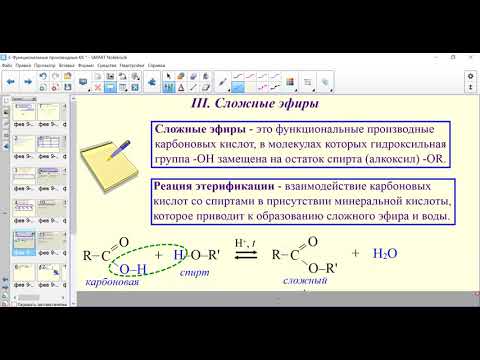 ЛЕКЦИЯ 2. КИСЛОТЫСкачать  РАЗБОР 5 ВАРИАНТА из сборника Добротина 2024 | Химия ЕГЭ УМСКУЛСкачать  Фосфорная кислота- кислота, которую все пробовали на вкус (чистую, а не в составе кока колы).Скачать  Химические свойства карбоновых кислотСкачать  РАЗБОР ВАРИАНТА №5 ИЗ СБОРНИКА ДОБРОТИНА 2024 | ЕГЭ ХИМИЯ | НООСкачать  Разбор открытого варианта ФИПИ | ЕГЭ Химия 2022Скачать  |

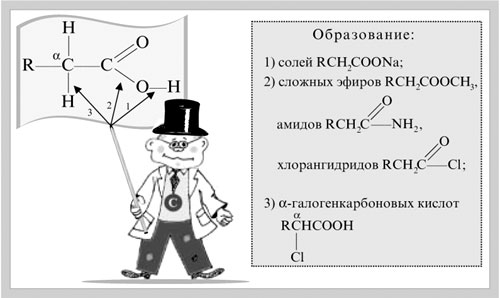
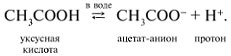
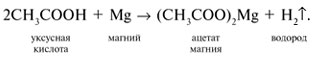
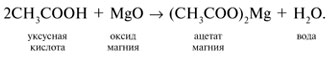
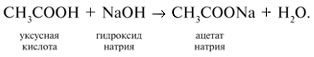
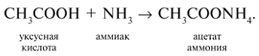
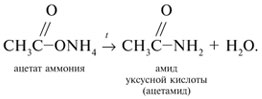
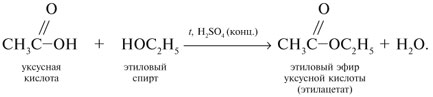
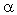 -положении довольно подвижные и могут замещаться на атомы хлора или брома:
-положении довольно подвижные и могут замещаться на атомы хлора или брома: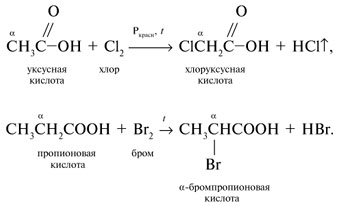
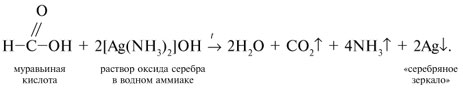
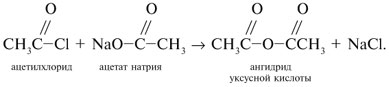
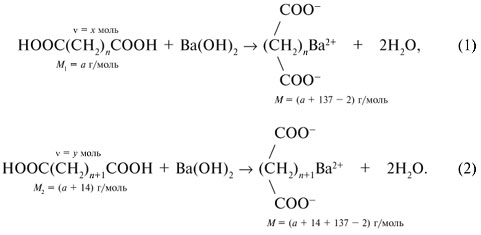
 = х моль других участвующих в реакции (1) веществ – Ва(ОН)2 и (СН2)n(СОО)2Ва. Аналогично в реакции (2):
= х моль других участвующих в реакции (1) веществ – Ва(ОН)2 и (СН2)n(СОО)2Ва. Аналогично в реакции (2): С6Н5СООК + Н2О;
С6Н5СООК + Н2О; 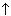 ;
; 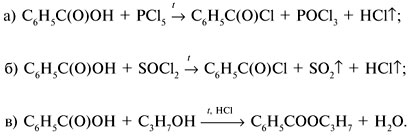
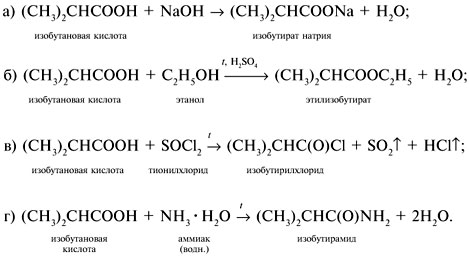
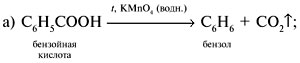
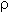 = 1,1 г/мл, составляет:
= 1,1 г/мл, составляет: 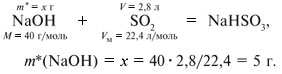
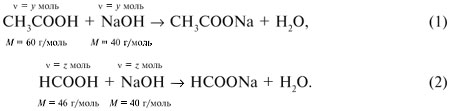
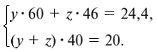
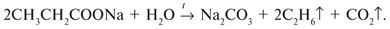














 RCOO — + Н +
RCOO — + Н +