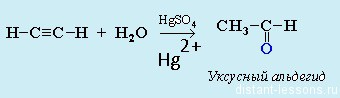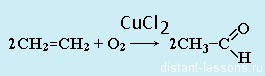Представьте себе запах свежеиспеченной булочки с ванилью… ммм! Вкуснотища!
Когда этот ароматизатор добавляют в выпечку, слюнки текут!
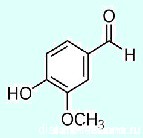
А знаете, что из себя представляет ванилин?
Структурная формула:
Вот эта группа в самом верху молекулы — -HС=O — карбонильная группа. Вещества, в составе которых присутствует такая группа, называются альдегидами, и зачастую, пахнут они очень приятно…
Видео:Опыты по химии. Реакция серебряного зеркалаСкачать

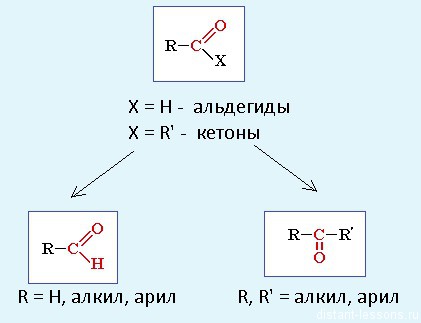
Альдегиды и кетоны
Альдегиды и кетоны относятся к карбонильным органическим соединениям.
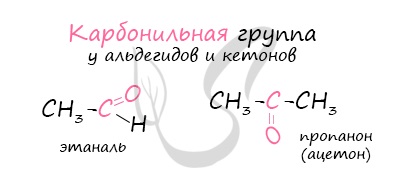
Карбонильными соединениями называют органические вещества, в молекулах которых имеется группа >С=О (карбонил или оксогруппа).
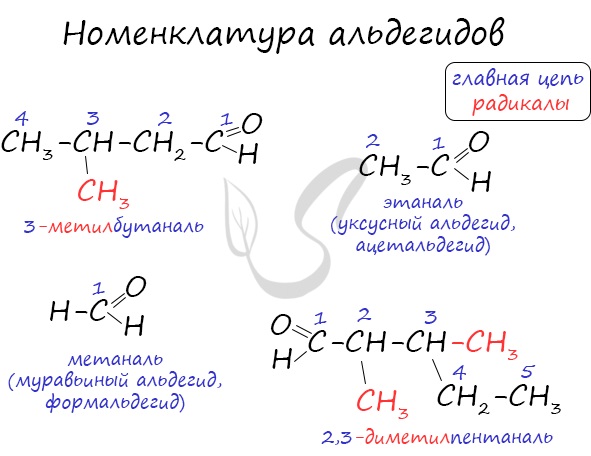
Номенклатура:
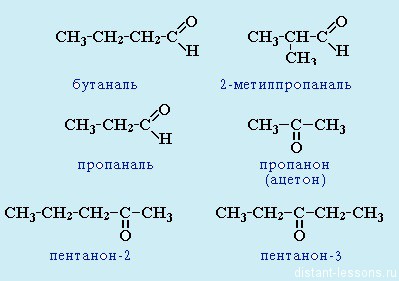
Альдегиды: называют радикал, затем окончание «аль»:
- метаналь H2C=O , или формальдегид (тривиальное название), муравьиный альдегид
- этаналь СH3-CH=O , или ацетальдегид, уксусный альдегид
Нумерацию цепи начинают с карбонильного атома С:
- 2-метил — пропаналь (CH3)2CHCH=O
Кетоны: название радикала, потом окончание «он»:
- пропанон (СH3)2C=O — Ацетон
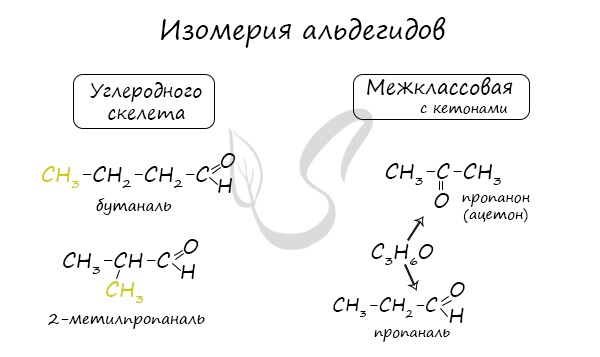
Изомерия альдегидов:
— изомерия углеродного скелета
— межклассовая изомерия (альдегиды кетоны)
— изомерия положения функциональной группы
Химические свойства:
Здесь все как всегда 🙂 Есть химические реакции по радикалу R, есть реакции по функциональной группе. В данном курсе мы рассмотрим основные реакции по карбонильной группе
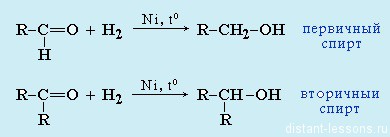
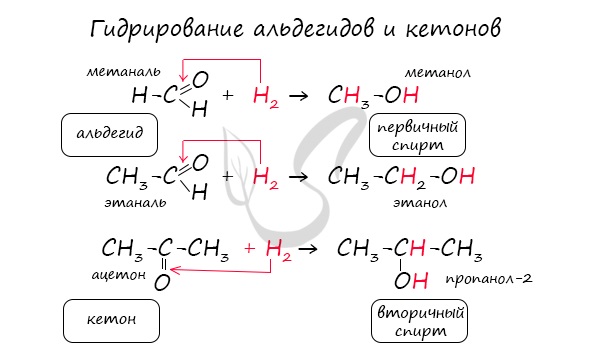
- Восстановление: альдегиды при восстановлении образуютпервичные спирты ,
кетоны — вторичные спирты.
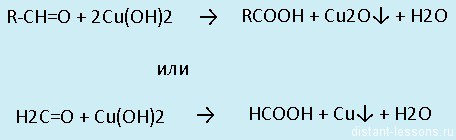
- Окисление: альдегиды окисляются до карбоновых кислот — группа -СOH превращается а группу -COOHВсе реакции — качественные на карбонильную группу!

Реакция «серебряного зеркала»
Реакция «медного зеркала»
Кетоны в такие реакции не вступают. У них идет «жесткое окисление» — разрыв связи С-С
Получение альдегидов и кетонов
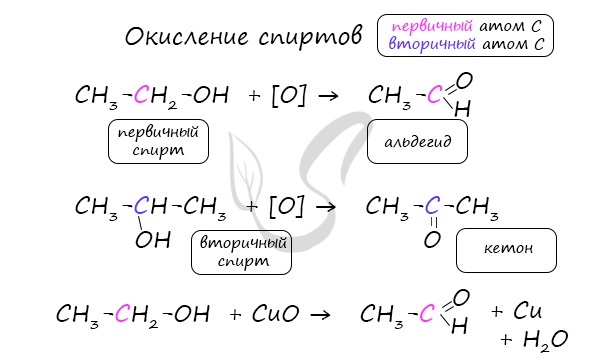
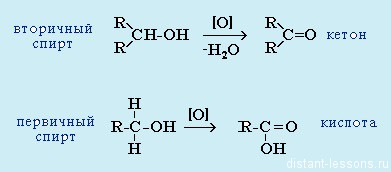
- Из спиртов реакцией окисления: из первичных спиртов образуются альдегиды, из вторичных — кетоны
- Гидратация алкинов— реакция Кучерова. Обязательное условие — присутствие соли ртути (2+) в качестве катализатора:
Чтобы получить кетон, надо просто взять любой другой гомолог ацетилена.
В самом начале лекции мы говорили про ваниль.
Почти все альдегиды и кетоны имеют интересные запахи:
(С6Н5)2С=О — бензофенон — запах герани;
СН3(СН2)7С(Н)=О — запах апельсина, цитрусовых;
С6Н5С(Н)=О — бензальдегид — запах горького миндаля;
В парфюмерии есть даже такой термин — «альдегидная нотка»!
Самыми известными цветочно-альдегидными ароматами считаются:
Arpege от Lanvin (1925)
Madame Rochas (1960)
Climat Lancome (1967)
Hermes Caleche (1961)
First Van Cleef & Arpels (1976)
из последнего Dia Amouage (2002)
и, конечно, Chanel #5 Eau Premiere.
- в ЕГЭ это вопрос А16 — Характерные химические свойства альдегидов
- в ГИА (ОГЭ) это B2— Первоначальные сведения об органических веществах: кислородсодержащих веществах
Видео:Медный стаканчик или реакция медного зеркала. (химия)Скачать

Обсуждение: «Альдегиды и кетоны»
В 6 вопросе в одну стадию этаналь можно получить как из ацетилена реакцией Кучерова, так и из этилена вакер-процессом!
Это ЕГЭ-шный вариант вопроса части А, в которых зачастую игнорируются реакции окисления. Они проявляются уже только в части С
Видео:Качественная реакция на альдегиды с гидроксидом медиСкачать

Альдегиды
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь — CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
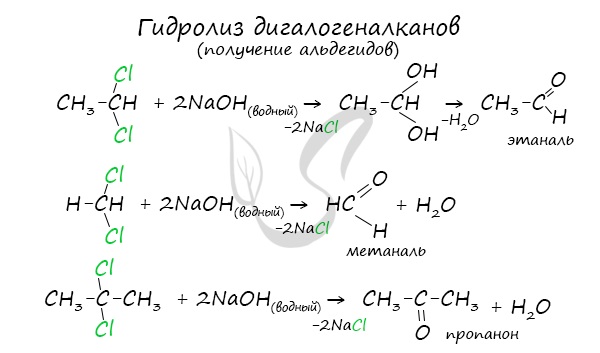
Получение альдегидов и кетонов
- Окисление спиртов
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
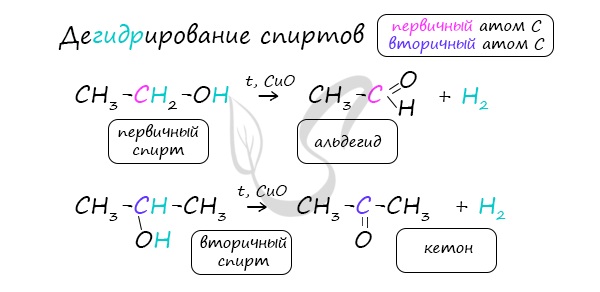
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
Химические свойства альдегидов и кетонов
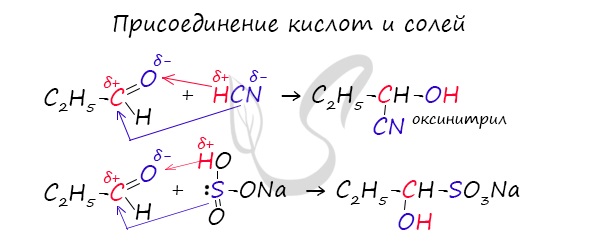
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты.
Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Реакция серебряного зеркала с глюкозой | Качественная реакция глюкозы на альдегидную группу |Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 📽️ ВидеоРеакция серебряного зеркалаСкачать  Получение серебра - реакция серебряного зеркала! (химия)Скачать  Опыты по химии. Окисление муравьиного альдегида гидроксидом меди (II)Скачать  серебряное зеркало с глюкозойСкачать  Реакция окисления альдегидов | ХимияСкачать  Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать  ВСЯ ТЕОРИЯ ПО АЛЬДЕГИДАМ ДЛЯ ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать  Качественная реакция на альдегиды I ЕГЭ по химииСкачать  Реакция серебряного зеркала. Химический опытСкачать  ЗЕРКАЛО В ПРОБИРКЕ. САМАЯ КРАСИВАЯ ХИМИЧЕСКАЯ РЕАКЦИЯСкачать  10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  Реакция серебряного зеркала I ЕГЭ по химииСкачать  81. Реакция серебряного зеркалаСкачать  СЕРЕБРЯНОЕ ЗЕРКАЛО - ХИМИЧЕСКАЯ РЕАКЦИЯСкачать  Качественные реакции на альдегидыСкачать  Качественная реакция глюкозы с гидроксидом меди (II)Скачать  |