- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Промышленное получение азотной кислоты уравнения
- 9.1.1. Технологические свойства азотной кислоты
- 9.1.2 Применение азотной кислоты
- 9.1.3 Сырье для производства азотной кислоты
- 9.1.4 Общая схема азотнокислотного производства
- 9.2. Физико–химические основы синтеза азотной кислоты из аммиака
- 9.2.1. Окисление аммиака до оксида азота (II)
- 9.2.2 Окисление оксида азота (II) и димеризация оксида азота (IV)
- 9.2.3. Абсорбция оксида азота (IV)
- 9.2.4. Расчетные уравнения синтеза азотной кислоты
- 9.3. Производство разбавленной азотной кислоты
- 9.3.1. Принципиальная схема производства
- 9.3.2. Технологическая схема производства азотной кислоты АК–72
- 9.4. Концентрирование разбавленной азотной кислоты
- 9.5. Перспективы развития азотнокислотного производства
- Получение азотной кислоты
- Общее описание
- Получение
- Применение
- Что мы узнали?
- 📺 Видео
Видео:Видео 360 | Производство азотной кислоты. Неорганическая химия. Азот.Скачать

Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Видео:11-класс | Химия | Производство азотной кислоты. Производство чугуна и сталиСкачать

Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Видео:Получение концентрированной азотной кислотыСкачать

Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Видео:Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

Промышленное получение азотной кислоты уравнения
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитрующим и окисляющим действием по отношению к органическим соединениям, в концентрированном виде пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и оборонной технике.
9.1.1. Технологические свойства азотной кислоты
Безводная азотная кислота (моногидрат HNO3) представляет бесцветную жидкость с температурой кристаллизации –41,6 0 С, температурой кипения 82,6 0 С и плотностью 1.513 г/м 3 . Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения – гидраты состава и .
Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает, достигая максимума 120,7 0 С при азеотропном составе кислоты 68,4% (мас.), после чего снижается. Это имеет существенное значение для концентрирования азотной кислоты.
Теплота разбавления азотной кислоты водой существенно меняется с ее концентрацией и составляет для моногидрата HNO3 33,68 кДж/моль. Безводная азотная кислота малоустойчива термически и разлагается уже при хранении по уравнению
Скорость разложения возрастает с повышением концентрации; для 99% кислоты температурный градиент составляет всего 5 0 С.
При нагревании процесс ускоряется и протекает по уравнению
Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желто–оранжевый цвет. Для удаления оксида из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется нитроолеум — соединение состава , являющееся промежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы, кроме золота, платины, титана, тантала, родия и иридия, в концентрированном виде пассивирует железо и его сплавы.
9.1.2 Применение азотной кислоты
Области применения азотной кислоты весьма разнообразны. Большая часть ее (до 75–80%) расходуется на производство азотных и комплексных минеральных удобрений и разнообразных нитратов, 10–15% идет на получение взрывчатых веществ и ракетного топлива, остальное количество потребляется производством красителей, органическим синтезом и в цветной металлургии (травление металлов). На рис. 9.1 представлено применение азотной кислоты в различных областях народного хозяйства.
Рисунок 9.1 – Использование азотной кислоты
9.1.3 Сырье для производства азотной кислоты
В настоящее время в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака (рис.9.2).
Рисунок 9.2 – Сырье для производства азотной кислоты
В настоящее время основную массу азотной кислоты производят из синтетического аммиака, получаемого на основе конверсии природного газа. Аммиак, поступающий из цеха синтеза, содержит катализаторную пыль и пары компрессорного масла, являющиеся каталитическими ядами на стадии окисления аммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием через матерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком. Аналогично очищают от механических и химических примесей воздух, который поступает в цех через заборную трубу, устанавливаемую, как правило, вдали от территории предприятия. Для очистки воздуха используются орошаемые водой скрубберы и матерчатые двухступенчатые фильтры.
9.1.4 Общая схема азотнокислотного производства
Существуют два способа производства азотной кислоты:
- получение разбавленной кислоты с последующим концентрированием ее в случае необходимости;
- непосредственное получение концентрированной кислоты.
Наиболее распространен первый способ, что связано с использованием в народном хозяйстве как концентрированной, так и разбавленной кислоты. Методы различаются физико–химическими закономерностями протекающих процессов и технологическими схемами. Однако независимо от схемы синтез азотной кислоты из аммиака описывается общей химической схемой
Первая стадия процесса ( конверсия аммиака ) одинакова как для получения разбавленной, так и для получения концентрированной кислоты, вторая стадия (переработка нитрозных газов) отличается рядом особенностей. Решающее значение при выборе параметров той или иной технологической схемы имеет выбор оптимального давления на каждой из стадий процесса. В производстве азотной кислоты повышение давления существенно интенсифицирует химические реакции на всех стадиях процесса, способствует эффективности теплообмена, позволяет использовать более современные массообменные устройства, уменьшает размеры аппаратуры и коммуникаций и в конечном итоге позволяет снизить капитальные расходы.
В то же время повышение давления оказывает и негативное влияние на экономические показатели работы агрегата. К ним относятся: ускорение побочных реакций на стадии окисления аммиака, снижение степени конверсии, потери катализатора вследствие его уноса потоком газа и необходимостью частой замены его, что связано с остановкой производства.
Технико–экономический анализ показывает, что применение единого (повышенного) давления на всех стадиях производства целесообразно лишь в том случае, когда мощность установки не превышает 600–800 т/сутки. Установки большей мощности экономически выгодно создавать только с использованием разных давлений на стадии конверсии аммиака и стадии переработки нитрозных газов.
Видео:15 урок Производство аммиака,азотной кислотыСкачать

9.2. Физико–химические основы синтеза азотной кислоты из аммиака
9.2.1. Окисление аммиака до оксида азота (II)
При окислении аммиака кислородом воздуха на катализаторе возможно протекание следующих реакций:
а также реакция с участием образующегося оксида азота (II):
Все реакции практически необратимы, поэтому направление процесса окисления определяется соотношением скоростей реакций 1–4. Из трех основных реакций окисления аммиака (1–3) реакция 3 термодинамически наиболее вероятна, так как протекает с максимальным выделением тепла. Поэтому в отсутствие катализатора окисление аммиака идет преимущественно до элементарного азота. Для ускорения целевой реакции окисления до оксида азота (II) применяют селективно действующие катализаторы. Платиновые катализаторы используют в современных установках в виде пакета сеток из сплава платины с 7,5% родия или двухступенчатые катализаторы в виде слоя таблетированной смеси оксидом железа (III) и хрома (III). Введение родия повышает механическую точность и уменьшает потери платины за счет ее уноса током газа. Поверхность подобных катализаторов достигает 1,5 м 2 /м 3 объема.
Платиновые катализаторы весьма чувствительны к каталитическим ядам, содержащимся в аммиаке и воздухе, образующим аммиачно–воздушную смесь ( АмВС ). Фосфористый водород вызывает его необратимое, а ацетилен, сероводород и органические соединения серы обратимое отравление. Так как вследствие этого активность катализатора снижается, его периодически регенерируют промывкой соляной или азотной кислотой.
В процессе работы поверхность катализатора разрушается и частицы его уносятся с потоком газа. Эрозия катализатора тем больше, чем выше температура, давление и объемная скорость газа, проходящего через катализатор. Для систем, работающих под высоким давлением, унос катализатора составляет 0,3–0,4 г на 1 тонну азотной кислоты.
Из двух реакций (2 и 3), конкурирующих с целевой реакцией окисления аммиака (1), наиболее опасной является реакция 3, приводящая к образованию элементарного азота. Скорость обеих реакций (1 и 3) может быть описана общим для гетерогенных реакций уравнением
и зависит от таких параметров процесса как температура (через кМ), давление и состав АмВС, то есть отношение кислород: аммиак (через DС), время контактирования, то есть время пребывания АмВС в зоне катализатора. Влияние этих факторов на скорость окисления аммиака до оксида азота (II) по реакции 1, до азота по реакции 3 и, следовательно, выход продуктов окисления, различно.
Температура. Повышение температуры способствует увеличению скорости реакций и коэффициента диффузии аммиака в смеси и поэтому является наиболее эффективным средством увеличения скорости процесса, протекающего преимущественно в диффузионной области. Это подтверждается термодинамическими данными табл. 9.1.
Таблица 9.1 – Термодинамические характеристики реакций окисления аммиака
Из таблицы следует, что вероятность реакции окисления до оксида азота (II) с повышением температуры возрастает почти вдвое, а реакции окисления до азота почти не изменяется.
Состав АмВС. Соотношение аммиака и кислорода в газовой смеси влияет на температурный режим и общую скорость процесса в том случае, если лимитирующей в нем является химическая реакция, то есть процесс протекает в кинетической области. При стехиометрическом соотношении компонентов в АмВС степень превращения аммиака в оксид азота (II) не превышает 0,65 дол. ед. Для увеличения выхода оксида азота (II) процесс ведут при отношении О2 : NH3 ==1,8 : 2,0, что соответствует содержанию в АмВС 0,095 –0,105 об. долей аммиака и 0,18–0,19 об. долей кислорода. Избыток кислорода используется на стадии доокисления оксида азота (II), а указанный состав АмВС обеспечивает автотермичность процесса окисления и лежит за пределами взрывчатости АмВС.
Давление.Повышение давления ускоряет процесс окисления аммиака за счет увеличения концентрации реагентов и производительности катализатора, что позволяет сократить размеры аппаратуры. При этом, однако, снижается выход оксида азота (II) и увеличивается эррозия и унос катализатора, что удорожает продукцию. Так, если при атмосферном давлении (10 5 Па) унос катализатора не превышает 0,05 г на тонну азотной кислоты, то при давлении 0,8 МПа он достигает 0,4 г/тонну.
Время контактирования. Скорость каталитического окисления аммиака до оксида азота (II) весьма высока. За десятитысячные доли секунды степень превращения составляет 0,97–0,98 дол.ед. при атмосферном давлении и 0,98–0,96 при давлении 0,8–1,0 МПа. Время контактирования может быть рассчитано из формулы:
- (9.1)
где Vk – объем катализатора, определяемый в случае платинового катализатора числом сеток в пакете;
W – объемная скорость АмВС.
Время контактирования зависит от природы катализатора и составляет: для платиновых катализаторов 10 –4 – 10 –5 с, для окисных катализаторов около 10 –2 с. Увеличение времени контактирования, то есть снижение объемной скорости АмВС, приводит к развитию реакции окисления аммиака до элементарного азота.
Оптимальный режим процесса на этой стадии должен обеспечить селективность окисления аммиака, минимальные потери катализатора вследствие его уноса и автотермичность процесса. Этим требованиям удовлетворяют следующие условия: температура 800 0 С, давление 0,1–1,0 МПа, молярное отношение О2:NH3 = 1,8–2,0, время контактирования 1– 2×10 –4 с.
Для соблюдения этих условий исходная АмВС должна иметь состав: аммиак 0,10 – 0,115 об. дол., кислород 0,18 – 0,19 об. дол., азот 0,70–0,72 об. дол.
При использовании АмВС такого состава нитрозные газы, выходящие из контактного аппарата, содержат от 0,08 до 0,11 об. дол. оксида азота (II).
9.2.2 Окисление оксида азота (II) и димеризация оксида азота (IV)
Нитрозные газы , полученные на стадии окисления аммиака, содержат оксид азота (II) , азот, кислород и пары воды. При окислении оксида азота (II) в оксид азота (IV) в этой системе протекают три параллельных реакции:
Все реакции обратимы, протекают в гомогенной системе с выделением тепла и уменьшением объема. Вследствие этого понижение температуры и повышение давления сдвигает равновесие их вправо.
Константа равновесия реакции 1 окисления оксида азота (II) выражается уравнением
и сильно зависит от температуры (табл. 1.2).
Таблица 1.2 – Значение Кр реакции окисления оксида азота (II) для различных температур
Из табл. 1.2 следует, что при температурах ниже 100 0 С равновесие реакции 1 почти полностью сдвинуто в сторону образования оксида азота (IV). При повышении температуры оно сдвигается влево и выше 700 0 С образования оксида азота (IV) практически не происходит. Так как нитрозные газы выходят из реактора при температуре около 800 0 С, в них оксид азота (IV) практически отсутствует. Для превращения оксида азота (II) в оксид азота (IV) газы необходимо охладить ниже 100 0 С.
Обычно переработку нитрозных газов ведут при 10–50 0 С. В этих условиях часть оксида азота (IV) димеризуется в тетроксид N2O4. Степень димеризации оксида азота (IV) существенно зависит от температуры. При температуре выше 150 0 С равновесие реакции 2 почти полностью сдвинуто влево и тетроксид азота в газе практически отсутствует. Даже при –20 0 С степень димеризации оксида азота (IV) не превышает 92%.
Скорости реакций 1 и 2 различны, поэтому соответствующие равновесия устанавливаются не одновременно. Реакция окисления 1 протекает с меньшей скоростью, поэтому скорость всего процесса на этой стадии производства определяется именно скоростью окисления оксида азота (II), которая выражается общим для гомогенных реакций уравнением
Для этой реакции характерна аномальная зависимость ее скорости от температуры. Она ускоряется при понижении температуры и почти полностью прекращается с повышением температуры до определенного предела. Это объясняется особым механизмом окисления оксида азота (II) в оксид азота (IV), которое протекает в две стадии через образование промежуточного продукта – димера оксида азота (II) (консекутивная реакция):
Реакция образования димера обратима, протекает с выделением тепла и значительно быстрее, чем реакция его последующего окисления. Поэтому при повышении температуры равновесие реакции образования димера сдвигается влево и равновесная концентрация димера в газе понижается. Так как скорость реакции окисления димера зависит от его концентрации, то уменьшение скорости при повышении температуры вызывает снижение скорости окисления димера и, следовательно, оксида азота (II) до оксида азота (IV).
Скорость реакции димеризации оксида азота (IV) в тетроксид весьма высока, поэтому равновесие реакции 2 устанавливается практически мгновенно, и соотношение оксидов NO2 : N2O4 определяется условиями этого равновесия, установившегося в газе.
Таким образом, понижение температуры и повышение давления в нитрозном газе способствует окислению оксида азота (II) в оксид азота (IV) в димеризации последнего.
9.2.3. Абсорбция оксида азота (IV)
Нитрозные газы, поступающие на абсорбцию, представляют сложную смесь различных оксидов азота (NO2, N2O4, NO, N2O), элементарного азота, кислорода и паров воды.
Все оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но за исключением оксида азота (II) взаимодействуют с ней. Реакция хемосорбции — поглощение оксидов азота водой сопровождающееся химической реакцией, протекающей в системе «газ–жидкость», описываемой уравнениями:
и распада нестойкой азотистой кислоты по уравнению
Суммируя уравнения 1 и 3 и 2 и 3, получаем итоговые уравнения поглощения оксидов азота водой:
Из этих уравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислоты и один моль оксида азота (II) , который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизм образования азотной кислоты при абсорбции оксида азота (IV) водой, а затем образующейся водной азотной кислотой заключается в том, что оксид азота (IV) диффундирует через пограничный слой газа к поверхности жидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой (реакция 1) со скоростью, превышающей скорость диффузии и скорость реакции разложения азотистой кислоты (реакция 3). Образующийся оксид азота (II) выделяется в газовую фазу, где окисляется кислородом до оксида азота (IV).
Состояние системы «NO2–HNO3–H2O» и, следовательно, концентрация получаемой азотной кислоты зависят от температуры, давления, парциального давления оксида азота (IV) в поглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижении температуры и концентрации кислоты и повышения давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, при том тем интенсивнее, чем выше концентрация его в нитрозных газах. При атмосферном давлении и температуре 25 0 С абсорбция оксида азота практически прекращается, когда концентрация кислоты достигает 0,65 мас. долей.
Таким образом, возможность получения азотной кислоты концентрацией более 0,65 мас.дол. объективно ограничена температурой и давлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальных условиях производства при температуре 40 0 С, давлении 0,1 МПа и понижении содержания оксида азота вследствие его поглощения из газа концентрация получаемой кислоты не превышает 0,5 мас.дол. Получение азотной кислоты более высокой концентрации требует иной технологии.
Степень абсорбции оксида азота (IV) непосредственно связана с абсорбционным объемом аппаратуры. Повышение степени абсорбции требует, особенно в конце процесса, значительного увеличения абсорбционного объема. Так, если степень абсорбции, равная 0,92 дол.ед., может быть достигнута при Vаб = 22 м 3 /т кислоты, то для повышения ее до 0,98 дол. единицы, то есть на 6,5%, абсорбционный объем должен быть увеличен до 70 м 3 /т. (рис.1.3). Так как увеличение абсорбционного объема вызывает резкое возрастание капитальных затрат, то экономически более выгодно не добиваться степени абсорбции выше 0,98 дол.ед, а поглощать остатки оксида азота (IV) в отходящих газах щелочными поглотителями с последующим окислением образовавшегося нитрита натрия концентрированной азотной кислотой и возвращением оксида азота (II) в цикл (инверсия оксида азота (II)):
Рисунок 9.3 – Использование азотной кислоты
9.2.4. Расчетные уравнения синтеза азотной кислоты
Процесс синтеза азотной кислоты из аммиака протекает в несколько стадий, каждая из которых включает несколько химических реакций. Для количественных расчетов процесса, в частности, определения расходных коэффициентов и общего выхода азотной кислоты на исходное сырье целесообразно пользоваться итоговым уравнением, полученным суммированием уравнений реакций каждой стадии после соответствующих операций деления и умножения их:
Видео:Три способа получения азотной кислоты [NurdRage]Скачать
![Три способа получения азотной кислоты [NurdRage]](https://i.ytimg.com/vi/T0IGRlvcU4I/0.jpg)
9.3. Производство разбавленной азотной кислоты
9.3.1. Принципиальная схема производства
Независимо от конкретной технологической схемы принципиальная схема производства разбавленной азотной кислоты включает шесть основных операций (рис.1.4).
Рисунок 9.4 – Принципиальная схема производства разбавленной кислоты:
- очистка аммиака и воздуха и их смешение;
- окисление аммиака на катализаторе;
- охлаждение нитрозных газов с использованием теплоты процесса окисления;
- охлаждение нитрозных газов с использованием теплоты процесса окисления;
- окисление оксида азота (II) и образование азотной кислоты;
- очистка (нейтрализация) отходящих газов.
АмВС – аммиачно–воздушная смесь; НГ – нитрозные газы; ОГ – отходящие газы
Аммиак и воздух, очищенные от примесей, смешиваются и направляются на стадию окисления аммиака. Разогретая за счет теплоты реакций газовая смесь (нитрозные газы) охлаждается в котле–утилизаторе с выработкой технологического пара и холодильнике, где происходит частичное окисление оксида азота (II) до оксида азота (IV). Дальнейшее окисление его осуществляется одновременно с образованием азотной кислоты в процессе абсорбции оксида азота (IV) водой. Отходящие газы, содержащие остаток оксида азота (IV), не вступившего в реакцию, очищают нейтрализацией раствором карбоната натрия, после чего выбрасываются в атмосферу.
В приведенной принципиальной схеме производства разбавленной азотной кислоты операции окисления аммиака и переработки нитрозных газов различаются режимами проведения процессов. Для первой стадии оптимальными условиями являются высокая температура и относительно низкое давление, для второй стадии – низкая температура и высокое давление, что вытекает из физико–химических закономерностей этих процессов. Поскольку определяющим параметром является давление, все существующие технологические схемы производства разбавленной азотной кислоты делятся на три типа:
- при атмосферном давлении (тип I);
- при высоком давлении (тип II);
- с двумя степенями давления (комбинированные схемы) (тип III).
Характеристики и особенности этих типов технологических схем приведены в табл. 9.3.
Таблица 9.3 – Характеристики технологических схем производства разбавленной азотной кислоты
Вследствие малой производительности, громоздкости аппаратуры, значительных потерь аммиака, малой степени абсорбции и, как следствие, необходимости в дорогостоящих очистных сооружениях установки, работающие при атмосферном давлении, потеряли свое значение и не строятся.
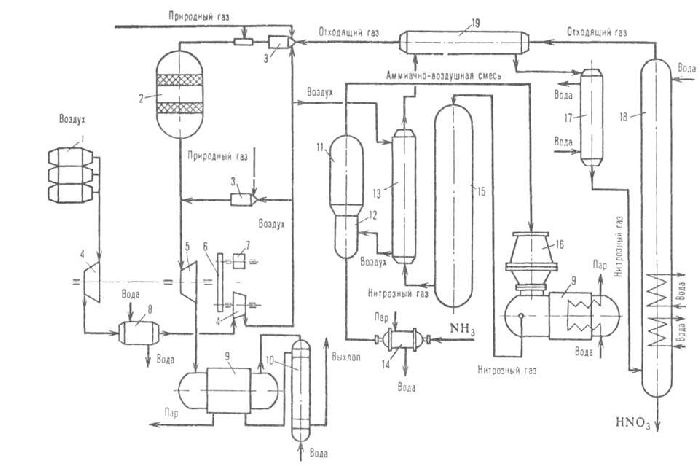
9.3.2. Технологическая схема производства азотной кислоты АК–72
Эта отечественная технологическая схема производства разбавленной азотной кислоты с двумя ступенями давления (комбинированная схема) (рис. 9.5) является наиболее современной.
Рисунок 9.5 – Технологическая схема производства азотной кислоты АК-72:
- фильтр очистки воздуха;
- воздушный компрессор;
- контактный аппарат;
- подогреватель газообразного аммиака;
- продувочная колонна;
- испаритель жидкого аммиака;
- фильтр очистки аммиака;
- смесительная камера контактного аппарата;
- встроенный котел–утилизатор;
- экономайзер (водонагреватель);
- холодильник;
- абсорбционная колонна;
- нитрозный компрессор;
- подогреватель отходящих газов;
- холодильник–конденсатор;
- система каталитической очистки выхлопных газов;
- рекуперационные газовые турбины.
В ее основу положен замкнутый энерготехнологический цикл с двухступенчатой конверсией аммиака и охлаждением нитрозных газов (I стадия) под давлением 0,108 МПа. В этой схеме обеспечиваются наиболее оптимальные условия каждой из стадий производства – окисления аммиака и переработки нитрозных газов. В схеме предусмотрены:
- выпуск продукции в виде 60% азотной кислоты;
- тщательная очистка аммиака и воздуха;
- охлаждение нитрозных газов с промывкой их от нитрита и нитрата аммония;
- каталитическая очистка выхлопных газов;
- использование вторичных энергетических ресурсов (теплоты – для подогрева выхлопных газов перед их каталитической очисткой и энергии сжатых газов для приводов воздушного и нитрозного компрессоров).
Атмосферный воздух, очищенный от пыли в фильтре 1, сжимается до 0,42 МПа в воздушном компрессоре 2 и делится на два потока. Один подается в контактный аппарат 3, другой через подогреватель аммиака 4 – в продувочную колонну 5. Газообразный аммиак из испарителя 6 очищается в фильтре 7 и нагревается в подогревателе 4 горячим воздухом до 80–120 0 С. Очищенный аммиак и воздух поступают в смесительную камеру 8 контактного аппарата 3. Образовавшаяся АмВС, содержащая около 0,11 об. дол. аммиака, проходит тонкую очистку в керамическом фильтре, встроенном в контактный аппарат, и поступает на двухступенчатый катализатор, состоящий из платиноидных сеток и слоя окисного катализатора. Образовавшиеся нитрозные газы проходят котел–утилизатор 9, размещенный в нижней части контактного аппарата, и поступают последовательно сначала в экономайзер 10 и затем в холодильник 11, где охлаждаются до 55 0 С. При охлаждении нитрозных газов происходит конденсация паров воды с образованием азотной кислоты различной концентрации, которая подается в абсорбционную колонну 12. Нитрозные газы сжимаются в нитрозном компрессоре 13 до 0,108– 0,110 МПа, разогреваясь при этом до 230 0 С, охлаждаются в холодильнике 14, являющимся одновременно подогревателем отходящих газов, до 150 0 С и холодильнике–конденсаторе 15 до 40–60 0 С, после чего подаются в абсорбционную колонну 12, в которую сверху поступает вода (паровой конденсат). Образовавшаяся 58–60% кислота из нижней части колонны направляется в продувочную колонну 5, где освобождается от растворенных в ней оксидов азота, и оттуда в хранилище. Отходящие газы из абсорбционной колонны, пройдя подогреватель 14, поступают в систему каталитической очистки 16, состоящей из топки и каталитического реактора. Очищенные выхлопные газы с содержанием оксидов азота не более 0,008 % объема при температуре 750 0 С направляются в рекуперационные турбины 17 и 18, обеспечивающие работу воздушного 2 и нитрозного 13 компрессоров.
Контактный аппарат в системе АК–72 цилиндрической формы имеет диаметр 4 м и высоту 5,6 м. Сжатый воздух проходит по кольцевому зазору между внутренним корпусом реакционной части аппарата и наружным корпусом и поступает в встроенный в верхнюю часть аппарата смеситель, где смешивается с аммиаком. Образовавшаяся АмВС проходит фильтр, направляется на катализатор. В нижней части аппарата расположены змеевики котла–утилизатора, в которые поступают нитрозные газы после катализатора.
Видео:Производство азотной кислоты.Промышленные способы получения|Хим. технология неорг. веществСкачать

9.4. Концентрирование разбавленной азотной кислоты
В целом ряде производств (нитрование ароматических углеводородов, получение нитратов целлюлозы, спиртов и др.) используется не разбавленная (45–60%), а концентрированная (96–98%) азотная кислота, которая не может быть получена по описанным выше схемам. Для получения подобной кислоты используются два метода: концентрирование разбавленной кислоты и прямой синтез из жидких оксидов азота.
При простом упаривании водой азотной кислоты нельзя получить продукт концентрацией выше азеотропа (68,5%), для которого содержание азотной кислоты в парах и жидкой фазе одинаково. Чтобы увеличить концентрацию получаемой этим способом кислоты, ее перегоняют в присутствии водоотнимающих средств (ВОС). Тогда при кипячении тройной смеси «Н2О–HNO3–ВОС» в парах уменьшается содержание водяного пара и возрастает содержание паров азотной кислоты. При конденсации паров образуется высококонцентрированная азотная кислота. При этом ее концентрация зависит от состава тройной смеси и природы ВОС.
В существующих технологических схемах концентрирования разбавленной азотной кислоты в качестве ВОС используются техническая серная кислота концентрацией 92–93 % или концентрированный раствор (плав) нитрата магния, содержащий 80% соли.
Видео:Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать

9.5. Перспективы развития азотнокислотного производства
Исключительное значение азотной кислоты для многих отраслей народного хозяйства и оборонной техники и большие объемы производства обусловили интенсивную разработку эффективных и экономически выгодных направлений совершенствования азотнокислотного производства. К таким направлениям относятся:
- создание систем высокой единичной мощности (до 400 тыс. т/год), работающих по комбинированной схеме;
- разработка высокоактивных избирательно действующих неплатиновых катализаторов окисления аммиака;
- возможно более полное использование энергии сжатых отходящих газов и низкопотенциальной теплоты процессов путем создания полностью автономных энерготехнологических схем;
- создание замкнутого оборота охлаждающей воды;
- решение проблемы очистки отходящих газов с утилизацией оксидов азота путем внедрения адсорбционно–десорбционного метода очистки на силикагеле и цеолитах;
- возможно более полное удаление остатков оксидов азота из отходящих газов с использованием в качестве восстановителей горючих газов и аммиака.
Видео:9 класс Урок 1. Строение и получение азотной кислоты.Скачать

Получение азотной кислоты

Средняя оценка: 4
Всего получено оценок: 185.
Средняя оценка: 4
Всего получено оценок: 185.
Азотную кислоту впервые стали получать ещё в XVII веке. Современный лабораторный метод предполагает получение кислоты из нитратов. Для получения азотной кислоты в промышленности используется метод окисления аммиака.
Видео:Производство аммиака учебный фильм Союза химиковСкачать

Общее описание
Формула азотной кислоты HNO3. Это сильная бесцветная кислота с резким запахом. Она неограниченно растворима в воде. Имеет небольшие температуры плавления (-41°C) и кипения (82,6°С). Плотность кислоты – 1,52 г/см 3 .

Концентрированная азотная кислота выделяет ядовитые газы – оксиды азота. Азотная кислота окисляет органические вещества: разрушает бумагу, натуральную ткань, вызывает ожоги на коже.
Азотная кислота в небольшом количестве образуется в дождевой воде при разрядах молнии.
Видео:Начинаем решать 11-й вариант сборника Добротина (номера 1-28)Скачать

Получение
Азотную кислоту впервые получили алхимики из селитры и железного купороса при термической реакции:
В современной химии существуют лабораторные и промышленные способы получения азотной кислоты. В лабораториях кислоту получают путём нагревания смеси из нитратов и концентрированной серной кислоты:
В промышленности азотную кислоту получают окислением аммиака. Метод осуществляется в три этапа.
Сначала аммиак окисляют на платиновых катализаторах до оксида азота (II):
Это реакция необратима.
Оксид азота (II) или монооксид окисляют до диоксида или оксида азота (IV):
Конечным этапом является поглощение диоксида азота водой в избытке кислорода:
Все реакции протекают с выделением тепла, т.е. являются экзотермическими. Две последние реакции обратимы, поэтому итоговая концентрация чистой азотной кислоты невысока (45-58 %).
Для повышения концентрации в реакции оксида азота (IV) с водой смещают равновесие, увеличивая давление. Также разбавленную азотную кислоту могут смешивать с серной кислотой и нагревать. Азотная кислота испаряется и конденсируется.
Лабораторный метод получения азотной кислоты обнаружил немецкий алхимик Иоганн Рудольф Глаубер в XVII веке.
Видео:Производство азотной кислоты (советский выпуск)Скачать

Применение
Азотная кислота используется:
- при производстве удобрений;
- в изготовлении взрывчатых веществ;
- в качестве окислителя ракетного топлива;
- для травления печатных форм в типографии;
- при изготовлении красок и лаков;
- в производстве лекарств;
- для определения золота в сплавах;
- для получения органических соединений.
Азотная кислота ядовита. При попадании на кожу разрушает белок, оставляя долго заживающие язвы.
Видео:Получение АЗОТНОЙ кислотыСкачать

Что мы узнали?
Азотную кислоту получают промышленным и лабораторным путём. В промышленности используется метод окисление аммиака, который включает три реакции. Сначала окисляется аммиак, затем оксид азота (II). Конечной реакцией является поглощение диоксида азота водой. Для повышения концентрации в обратимых реакциях повышают давление. В лабораториях кислоту получают действием серной кислоты на нитраты. Азотная кислота используется в промышленности для производства удобрений, взрывчатки, лекарств, красок.
📺 Видео
Как сделать азотную кислоту за 15 минут в домашних условиях...Скачать

🔥 5 экспериментов с АЗОТНОЙ КИСЛОТОЙ.Скачать

Азотная кислота. Физические и химические свойства. 9 класс.Скачать

Новые заводы России: оборудование на заводе «КАМАЗа», цех на заводе «Дальхимфарм»Скачать

как получают азотную кислотуСкачать

Чтение технологических схем производства азотной кислоты. Солошенко К.ВСкачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать













