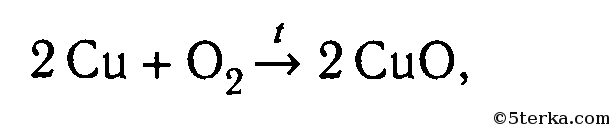Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 → 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Видео:Взаимодействие оксида меди с серной кислотойСкачать

Please wait.
Видео:Окисление этанола оксидом меди (II). Опыт 3Скачать

We are checking your browser. gomolog.ru
Видео:Опыты по химии. Взаимодействие угля и оксида меди (II)Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Оксид меди II и алюминийСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de4e5eca9749711 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Реакция обмена между оксидом меди (II) и серной кислотойСкачать

Практическая работа № 4. Признаки химических реакций
Практическая работа включает четыре опыта.
Опыт 1
Прокаливание медной проволоки и взаимодействие оксида меди (II) с серной кислотой
Зажгите спиртовку (газовую горелку). Возьмите тигельными щипцами медную проволоку и внесите ее в пламя. Через некоторое время выньте проволоку из пламени и счистите с нее образовавшийся черный налет на лист бумаги. Опыт повторите несколько раз. Поместите полученный черный налет в пробирку и прилейте в нее раствор серной кислоты. Подогрейте смесь. Что наблюдаете?
Образовалось ли новое вещество при накаливании меди? Запишите уравнение химической реакции и определите ее тип по признаку числа и состава исходных
веществ и продуктов реакции. Какие признаки химической реакции вы наблюдали? Образовалось ли новое вещество при взаимодействии оксида меди (II) с серной кислотой? Определите тип реакции по признаку числа и состава исходных веществ и продуктов реакции и запишите ее уравнение.
1. При прокаливании медной проволоки медь окислятся:
и образуется черный оксид меди (II). Это реакция соединения.
2. Образовавшийся оксид меди (II) растворяется в серной кислоте, раствор становится голубого цвета, образуется сульфат меди (II):
Это реакция обмена.
Взаимодействие мрамора с кислотой
Положите в небольшой стакан 1—2 кусочка мрамора. Прилейте в стакан столько соляной кислоты, чтобы ею покрылись кусочки. Зажгите лучинку и внесите ее в стакан.
Образовались ли новые вещества при взаимодействии мрамора с кислотой? Какие признаки химических реакций вы наблюдали? Запишите уравнение химической реакции и укажите ее тип по признаку числа и состава исходных веществ и продуктов реакции.
1. Мрамор растворился в соляной кислоте, произошла химическая реакция:
Опыт 3
Взаимодействие хлорида железа (III) с роданидом калия
В пробирку налейте 2 мл раствора хлорида железа (III), а затем несколько капель раствора роданида калия KSCN — соли кислоты HSCN, с кислотным остатком SCN — .
Какими признаками сопровождается эта реакция? Запишите ее уравнение и тип реакции по признаку числа и состава исходных веществ и продуктов реакции.
Раствор стал ярко-красным, образовался роданид железа (III):
Это реакция обмена.
Опыт 4
Взаимодействие карбоната натрия с хлоридом кальция
В пробирку налейте 2 мл раствора карбоната натрия. Затем добавьте несколько капель раствора хлорида кальция. Что наблюдаете? Запишите уравнение химической реакции и укажите ее тип по признаку числа и состава исходных веществ и продуктов реакции.
Наблюдается выделение белого кристаллического осадка сульфата бария:
Это реакция обмена.

задача №4
к главе «Глава 5. Простейшие операции с веществами (химический практикум). ».
🎥 Видео
Получение Оксида меди (II). Preparation of copper oxide (II)Скачать

🔥 Оксид меди 2. Получение двухвалентного оксида меди [CuO]- Preparation of bivalent copper oxide.Скачать
![🔥 Оксид меди 2. Получение двухвалентного оксида меди [CuO]- Preparation of bivalent copper oxide.](https://i.ytimg.com/vi/sP6je5DSl9c/0.jpg)
Оксид Меди (II). Получение Двухвалентного Оксида Меди (CuO) - элэктролизом + эксперимент (легко)Скачать

Качественная реакция на оксид медиСкачать

Окисление этилового спирта оксидом меди(II)Скачать

8 класс. Химия. Как получить оксид меди (ll).Скачать

Опыты по химии. Взаимодействие водорода с оксидом меди (II)Скачать

Реакция оксида меди(II) со спиртом.Скачать

Получение ОКСИДА МЕДИ CuO. Реакция ГИДРОКСИДА МЕДИ и ГИПОХЛОРИТА НАТРИЯ ( БЕЛИЗНЫ). Опыты по химииСкачать

Получение CuO // Получение двухвалентного оксида меди [CuO]Скачать
![Получение CuO // Получение двухвалентного оксида меди [CuO]](https://i.ytimg.com/vi/jpU6duDPIt0/0.jpg)
Восстановление меди водородом из оксида меди (II)Скачать

Получение оксида меди IIэкспериментСкачать

Взаимодействие водорода с оксидом меди (II)Скачать

Получение ЗАКИСИ МЕДИ!Скачать

Реакция обмена между оксидом меди II и серной кислотойСкачать