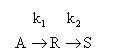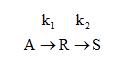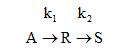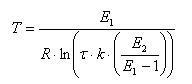Видео:Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Поиск, обзор и навигация
Магазин работ
ПиАХТ
Чертежи
Видео:Химия 11 класс (Урок№17 - Принципы химического производства. Промышленное получение металлов.)Скачать

Раздел 3. Химические реакторы
Задача 3.1-1 Проводится жидкофазная реакция первого порядка A -> R. Константа скорости реакции равна 0,45 мин -1 . Объемный расход реагента составляет 30 л/мин. Определить степень превращения вещества А в реакторах РИС-н и РИВ объемом 150л каждый.
Задача 3.1-2 Жидкофазная обратимая реакция 2A R проводится в РИС-н объемом 2,6 м 3 . Константа скорости прямой реакции k1=31,4 м 3 /(кмоль*мин), обратной k2=2 мин -1 . Концентрация исходного вещества 0,6 моль/л. Требуемая степень превращения хА=0,8. Определить производительность реактора по продукту R.
Задача 3.1-3 В реакторе протекает реакция второго порядка 2A = R с константой скорости реакции равной 2,8*10 -1 л/(моль*с). Начальная концентрация вещества А на входе в реактор равна 0,85 моль/л, степень превращения вещества А 0,9. Определить какое количество вещества А можно переработать в РИС-н объемом 2 м 3 и в РИВ объемом 0,6 м3.
Задача 3-1-4 Жидкофазная обратимая реакция второго порядка A + B = R + S проводится в реакторе идеального смешения объемом 40 л. Константа скорости прямой реакции k1=1,8 л/(моль•мин), обратной – k2=0,8 л/(моль•мин). Вещества А и В подаются раздельно в стехиометрическом соотношении. Концентрации веществ в индивидуальных потоках равны 0,5 моль/л. Определить, какое количество веществ А и В перерабатывается за 1 ч, если степень превращения вещества А составляет 0,85 от равновесной.
Задача 3.1-5 В жидкофазном процессе протекает реакция второго порядка 2А → R. с константой скорости реакции равной 2,3 л/(моль·мин). Объемный расход смеси с концентрацией исходного реагента СА0 = 0,5 кмоль/м 3 равен 3,6 м 3 /ч. Определить производительность РИС-н объемом 0,4 м 3 по продукту R. Рассчитать объем РИВ для полученной производительности.
Скачать решение задачи 3.1-5 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 3.1-6 В реакторе периодического действия при проведении реакции получены следующие результаты:
Используя данные результаты, сравнить эффективность РИВ и РИС-н для степени превращения 0,8.
Задача 3.1-7 Жидкофазный процесс, описываемый реакцией первого поряд-ка A → R, проводится в реакторе идеального смешения, время пребывания в котором составляет 360 с. Объемный расход исходного вещества равен 4 м 3 /ч. Концентрация вещества А СА0 = 2 кмоль/м 3 .
Рассчитать производительность по продукту R, если известно, что за 120 с в реакторе периодического действия в продукт превращается 40% исходного вещества.
Задача 3.1-8 Жидкофазный процесс описывается простой реакцией первого порядка A → R с константой скорости реакции k = 0,45 мин -1 . Объемный расход вещества А составляет 30 л/мин. Определить степени превращения вещества А в РИС-н и РИВ объемом по 145 л.
Задача 3.1-9 Реактор периодического действия за 8 ч работы производит 4,75 кмоль продукта. Для того чтобы загрузить реактор и нагреть его до температуры реакции, требуется 0,2 ч, а чтобы выгрузить продукт и подготовить реактор к следующему циклу, — 0,8 ч. Определить необходимый объем реактора, если 90 % поступающего в реактор исходного реагента с концентрацией 8 моль/л подвергается превращению, константа скорости реакции = 0,003 мин -1 .
Задача 3.1-10 Жидкофазный процесс описывается простой реакцией перво-го порядка с константой скорости равной 0,12 мин -1 . Концентрация вещества А в исходном потоке равна 3 кмоль/м 3 . Требуемая степень превращения вещества А ха = 0,85. Определить, какое количество вещества А можно переработать за 1 ч в реакторе идеального смешения и реакторе идеального вытеснения объемом 0,8 м 3 .
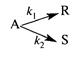
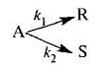
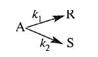
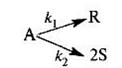
Задача 3.1-11 В реакторе периодического действия при изотермическом режиме работы и без изменения массовой плотности реакционной смеси проводят параллельную реакцию первого порядка
Через 50 мин после начала реакции 90% исходного вещества разложилось. Получившийся продукт содержит на 1 моль продукта S — 9,1 моль продукта R. На начало реакции продукты R и S отсутствовали. Определить константы скоростей реакций.
Задача 3.1-12 Жидкофазная реакция А + В → R проводится в непрерывном реакторе смешения. Константа скорости реакции k = 0,005 л/(моль•мин). Потоки веществ А и В подаются в реактор раздельно с равными объемными скоростями. Концентрации веществ в индивидуальных потоках соответственно СА = 2,4 моль/л, СВ = 3,6 моль/л. Необходимая степень превращения вещества А равна 80%. Определить допустимый расход веществ А и В в час.
Задача 3.1-13 Производство этилацетата описывается химическим уравнением:
Константа скорости прямой реакции 7,9•10 -6 м 3 /(кмоль•с), константа равновесия при температуре реакции — 2,9. Водный раствор реакционной смеси содержит 25 % массовых долей кислоты, 46 % массовых долей спирта и не содержит эфира. Требуемая степень превращения кислоты составляет 35 %.
Рассчитать объем трубчатого реактора для производства 25 т/сут этилацетата, принимая, что плотность реакционной смеси остается постоянной и равной 1020 кг/м 3 .
Скачать решение задачи 3.1-13 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 3.1-14 Жидкофазная реакция 2A → R + S имеет константу скорости 0,38 л/(моль•с). Объемный расход вещества А с концентрацией СА0 = 0,4 моль/л равен 40 л/мин.
Определить объемы реакторов РИС-н и РИВ при проведении процесса до степеней превращения 0,3; 0,5; 0,7; 0,9.
Задача 3.1-15 Жидкофазная необратимая реакция первого порядка проводится в реакторе смешения периодического действия без изменения массовой плотности реагирующих веществ. Продукты реакции в исходном растворе отсутствуют. За время t = 120 с в целевой продукт превращается 20% исходного вещества.
Определить степень превращения в непрерывном реакторе смешения при времени пребывания 360 мин.
Скачать решение задачи 3.1-15 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 3-1-16 Жидкофазная необратимая реакция первого порядка имеет константу скорости 0,45 мин -1 . Объемный расход реагента А с концентрацией СА0 = 1,6 моль/л составляет 3,6 м 3 /ч.
Определить производительность по продукту R в реакторе идеального смешения и реакторе идеального вытеснения, если их объемы равны 145 л.
Задача 3.1-17 Жидкофазная реакция A → 2R имеет константу скорости реакции равную 3,8ч -1 . Объёмный расход исходного вещества составляет 33,5 м 3 /ч. Концентрация СА0=0,8 моль/л. Рассчитать суточную производительность по продукту R для реактора смешения объемом 4м.
Задача 3.1-18 Жидкофазная обратимая реакция второго порядка 2А ↔ R + S имеет константу скорости прямой реакции k = 2-10 -3 м 3 /(кмоль*с) и константу равновесия КP = 9. Объемный расход исходного вещества с концентрацией СA0 = 1,5 моль/л составляет 4,8 м3/ч, требуемая степень превращения вещества А — 80% равновесной степени превращения.
Определить необходимые объемы реакторов идеального смешения и идеального вытеснения для проведения данного процесса.
Задача 3.1-19 Жидкофазная реакция A + B = R + S с константой скорости прямой реакции k1 = 1,8 л/(моль•мин) и константой скорости обратной реакции k-1 = 0,8 л/(моль•мин), проводится в реакторе идеального смешения объемом 40 л. Потоки веществ А и В подаются в реактор раздельно с равными концентрациями СА = СВ = 0,8 моль/л. Вещества А и В в реакторе находятся в стехиометрическом соотношении. Требуемая степень превращения вещества А хА = 0,9 хАравн. Рассчитать объемный расход реагентов.
Задача 3.1-20 Жидкофазная реакция 2А → R с константой скорости реакции равной 0,4 мин -1 проводится в реакторе идеального смешения объемом 0,5 м 3 . Объемный расход вещества А составляет 20 л/мин. Определить какую степень превращения можно достигнуть в этих условиях, и рассчитать объем реактора идеального вытеснения для достижения той же степени превращения и производительность по продукту R.
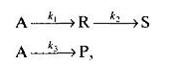
Задача 3.1-21 В непрерывном реакторе идеального смешения осуществляется жидкофазный процесс, описываемый последовательной реакцией
Константы скорости реакций k1=0,6 ч -1 , k2=0,8 ч -1 . Объёмный расход реакционной смеси равен 2,4 м 3 /ч. Исходные концентрации веществ соответственно: СА0=5моль/л, СR0=СS0=0.
Рассчитать необходимый объем реактора для получения максимального выхода целевого продукта R, степень превращения исходного вещества А, селективность и выход по целевому продукту, суточную производительность по продукту R.
Задача 3.1-22 В непрерывном реакторе идеального вытеснения осуществляется жидкофазный процесс, описываемый последовательной реакцией
Константы скорости реакций k1=0,6 ч -1 , k2=0,8 ч -1 . Объёмный расход реакционной смеси равен 2,4 м 3 /ч. Исходные концентрации веществ соответственно: СА0=5моль/л, СR0=СS0=0.
Рассчитать необходимый объем реактора для получения максимального выхода целевого продукта R, степень превращения исходного вещества А, селективность и выход по целевому продукту, суточную производительность по продукту R.
Задача 3.1-23 В проточном реакторе идеального смешения проводится реакция:
A+B -k→R
Однако вещества А и В склонны к полимеризации, описываемой уравнениями:
2A -k2 → S и 2B -k2 → D
Определить оптимальное соотношение А и В в реакторе для получения максимального выхода целевого продукта R.
Задача 3.1-24 Жидкофазный процесс описывается сложной параллельной реакцией
Объемный расход вещества А с концентрацией СА0 = 0,8 кмоль/м 3 равен 2,4 л/мин. Требуемая степень превращения xА = 0,85.
Выбрать тип реактора, рассчитать его объем, интегральную селективность и производительность по целевому продукту R, если: 1) k1 = 1,5 мин -1 ; k 2 = 4 мин -1 ; 2) k 1 = 4 мин -1 ; k 2 = 1,5 мин -1 .
Скачать решение задачи 3.1-24 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 3.1-25 Жидкофазный процесс описывается последовательной реакцией
Константы скорости реакций k1=2 ч -1 , k2=0,8 ч -1 . Объёмный расход реакционной смеси равен 1,2 м 3 /ч. Исходная концентрация вещества А равна СА0=1,8моль/л.
Рассчитать объем реактора идеального смешения для получения С, селективность и производительность по продукту R.
Задача 3.1-26 Жидкофазный процесс описывается реакцией:
A -k1 → R
A -k 2 → S
Константы скоростей реакции k 1 = 3,8 мин -1 ; k 2 = 1,5 мин -1 . Исходная концентрация вещества А с равна 1,4 моль/л. Требуемая степень превращения хА = 0,9.
Определить какое количество вещества А можно переработать в РИС-н объемом 0,6 м 3 и в РИВ объемом 0,2 м 3 . Рассчитать селективность и производительность по целевому продукту R.
Задача 3.1-27. Газофазная необратимая реакция второго порядка А → 3R исследовалась в опытном реакторе, представляющем собой трубу длиной 1,8 м и диаметром 2,54 см. Реакцию изучали при температуре 350 °С под давлением 4,9*10 5 Па. Расход исходной смеси газа составлял 31*10 -5 м 3 /с. При этих условиях была достигнута степень превращения ХА = 0,6. Промышленный процесс проводят при температуре 350 °С и давлении 2,45*10 6 Па. Мощность промышленной установки по газу составляет 2,35*10 -2 м 3 /с. Исходная газовая смесь содержит 50% вещества А и 50% инерта. Требуемая степень превращения 0,8.
Определить, какое количество труб указанного размера должен иметь промышленный реактор.
Задача 3.1-28 Газофазный процесс, описываемый простой необратимой ре-акцией 2A → 3R + S первого порядка, проводится при температуре 457 °С и давлении 9,8*10 5 Па. Константа скорости равна 1,25*10 -3 с -1 , скорость подачи исходного реагента — 2,5*10 -3 кмоль/с, требуемая степень превращения 0,9.
Определить объем реактора идеального вытеснения для проведения данного процесса.
Задача 3.1-29 Газофазная реакция А → S осуществляется в реакторе идеального вытеснения до степени превращения равной 0,9. Константа скорости реакции k = 2,3•10 -2 с -1 . В реактор подается исходный реагент А в количестве 2•10 -4 кмоль/с при температуре 227 °С и давлении 9,8•10 4 Па.
Рассчитать требуемый объем реактора.
Задача 3.1-30 Определить объем реактора идеального вытеснения для проведения процесса разложения фосфина. Реакция 2РН3 = 2Р(г) + 3Н2 протекает по первому порядку.
Процесс проводится под давлением 4,51*10 5 Па и при температуре 377 °С. Расход фосфина составляет 5,03*10 -4 кмоль/с. Константа скорости реакции равна 2,78*10 -3 с -1 .
Газовая постоянная К = 0,804*10 4 Па-м 3 /(кмоль*град). Требуемая степень превращения фосфина равна 0,8.
Задача 3.1-31 Реакция метана с серой СН4 + 2S2 = CS2 + 2H2S проводится при температуре 873 К и атмосферном давлении в реакторе идеального вытеснения. Расход серы в общем количестве газа, подаваемого в реактор, в 2 раза больше, чем расход метана. Константа скорости реакции k= 11,9 м 3 /(моль•ч).
Определить время пребывания реакционной смеси в реакторе для достижения степени превращения метана равной 0,7.
Задача 3.1-33 Жидкофазный процесс, описываемый обратимой реакцией второго порядка A + B = R + S с константами скорости прямой k1 = 22 л/(моль-мин) и обратной k-1 = 2 л/(моль-мин) реакций, проводится в РИС-н объемом 0,5 м 3 . Потоки веществ А и В подаются в реактор раздельно с равными концентрациями САисх=СВисх. После взаимного разбавления потоков концентрация СА0 = 1,6 кмоль/м3, а соотношение концентраций СА0:СВ0 = 1:1,5. Процесс проводится до хВ = 0,6.
Определить объемные потоки исходных веществ и производительность по продукту R. Рассчитать производительность системы состоящей из трех реакторов указанного объема, соединенных последовательно, при достижении заданной степени превращения.
Задача 3.1-34 Жидкофазный процесс описывается сложной реакцией
A + 3B = D + S
2А= R
2R = Р
Исходная смесь, в которой отсутствуют продукты реакций, подается с объемным расходом 5 л/с и концентрацией вещества А СА0 = 10 кмоль/м 3 . На выходе из реактора концентрации CB = 2, СA = 5, CR = 1, CS = 3кмоль/м 3 Определить расход реагента В.
Задача 3.1-35. Процесс описывается реакцией второго порядка типа 2А → R с константой скорости равной 2,8*10 -2 м 3 /(кмоль с). Исходная концентрация вещества А в потоке составляет 0,8 кмоль/м 3 . Требуемая степень превращения вещества А состовляет 0,85. Определить часовую производительность по продукту R в реакторе вытеснения объемом 0,6 м 3 и в реакторе смешения объемом 2 м 3 .
Задача 3.1-36. Жидкофазный процесс описывается последовательной реакцией типа
Константы скорости реакций k1=0,5 ч -1 , k 2 =0,8 ч -1 . Исходная концентрация вещества А равна 1,8моль/л. Объёмный расход вещества а составляет 18 м 3 /ч. Рассчитать объем реактора смешения для получения максимального количества вещества R, селективность и производительность по продукту R.
Задача 3.1-37 Жидкофазная реакция типа А=2R имеет константу скорости k=0,12мин -1 . Концентрация вещества А равна 3,0моль/л. Реакция осуществляется в реакторе вытеснения объемом 0,3. Заданная степень превращения вещества А составляет 0,88. Определить производительность по продукту R.
Задача 3.1-38 Жидкофазная реакция типа А=2R имеет константу скорости k=3,8 ч -1 Объемный расход исходного вещества с концентрацией 0,8 моль/л составляет 14,5 м 3 /ч.
Определить суточную производительность по продукту R для реактора смешения объемом 4 м 3 .
Задача 3-1-40 Жидкофазный процесс описывается реакцией первого порядка с константой скорости 0,12 мин -1 . Концентрация вещества А в исходном потоке равна 3 кмоль/м3. Требуемая степень превращения вещества А составляет 0,88.
Определить какое количество вещества А можно переработать в реакторе идеального смешения объемом 3,6 м3.
Задача 3.1-41 Процесс описывается реакцией второго порядка с константой скорости реакции равной 2,3*10 -3 м 3 /(кмоль*с). Исходная концентрация вещества А составляет 0,6 моль/л, объемный расход вещества А — 3,6 м3/ч. Определить производительность реактора смешения объемом 0,4 м 3 по продукту R.
Задача 3.1-42. Процесс описывается реакцией второго порядка с константой скорости 2,3-10 -2 м 3 /(кмоль-с). Исходная концентрация вещества А составляет 0,6 моль/л, объемный расход вещества А — 3,6 м 3 /ч.
Определить производительность реактора вытеснения объемом 200 л по продукту R.
Задача 3.1-43 Процесс описывается реакцией первого порядка А -> 2R с константой скорости 2,3*10 -3 с -1 . Исходная концентрация вещества А составляет 1,6 моль/л, объемный расход вещества А = 3,6 м 3 /ч. Заданная степень превращения по веществу А равна 0,86.
Определить производительность реактора вытеснения по продукту R и его объем.
Задача 3.1-44 Процесс описывается реакцией первого порядка типа А=2R с константой скорости k=2,3*10 -3 с -1 . Исходная концентрация вещества А составляет 1,6 моль/л, заданная степень превращения по веществу А – 0,86. Объём реактора смешения равен 0,3 м 3 .
Определить, какое количество вещества А можно переработать за сутки.
Задача 3.1-45 Процесс описывается обратимой реакцией первого порядка А 2R с константами скоростей k1 = 2,4 ч -1 (прямой реакции), k2 = 0,4 л/(моль*ч) (обратной). Исходная концентрация вещества А составляет 1,6 моль/л. Заданная степень превращения вещества R равна 0,9 равновесной. Объем реактора смешения составляет 0,3 м 3 . Определить производительность реактора по веществу R за сутки.
Задача 3.1-46 Процесс описывается обратимой реакцией первого порядка 2А R с константами скоростей k1 = 61,4 м /(моль*ч) (прямой реакции), k2 = 2,4 ч (обратной). Исходная концентрация вещества А составляет 1,4 моль/л. Заданная степень превращения вещества R равна 0,8 равновесной. Объем реактора смешения составляет 0,22 м3. Определить производительность реактора по веществу R за час.
Задача 3.1-47 Процесс описывается реакцией первого порядка типа А=2R с константой скорости k=0,6 мин -1 . Заданная степень превращения по веществу А – 0,85. Исходная концентрация вещества А составляет 1,8 кмоль/м3, производительность реактора по продукту R= 5,8кмоль/ч. Определить требуемый объем реактора вытеснения.
Задача 3.1-48 Процесс описывается реакцией первого порядка типа А=2R с константой скорости k=0,24 мин -1 . Заданная степень превращения по веществу А = 0,8. Исходная концентрация вещества А составляет 1,8 кмоль/м , производительность реактора по продукту R= 5,8кмоль/ч.
Определить требуемый объем реактора смешения и объемный расход исходной смеси.
Задача 3.1-49. Процесс описывается реакцией типа 2А → R с константой скорости равной 0,64 л/(моль мин). Заданная степень превращения вещества А состовляет 0,8, исходная концентрация вещества А составляет 1,8 кмоль/м 3 , производительность реактора по продукту R = 3,8 кмоль/ч. Определить требуемый объем реактора смешения.
Задача 3.1-50. Процесс описывается реакцией типа 2А → R с константой скорости равной 0,24 л/(моль*мин). Исходная концентрация вещества А составляет 1.8 кмоль/м 3 , производительность реактора по продукту R = 3,8 кмоль/ч, концентрация продукта R на выходе – 0,8 моль/л.
Определить требуемый объем реактора вытеснения и получаемую степень превращения вещества А.
Задача 3.1—51. Процесс описывается реакцией типа 2А → R с константой скорости равной 0,24 л/(моль мин). Исходная концентрация вещества А составляет 1.8 кмоль/м 3 . Процесс проводится в реакторе вытеснения объемом 0,8 м 3 . Объемный расход вещества А равен 1,8 м 3 /ч. Определить производительность реактора по продукту R.
Задача 3.1-52 Процесс описывается реакцией типа А + В = R с константой скорости равной 0,54 л/(моль/мин). Объемные потоки вещества А с концентрацией 1,8 моль/л и вещества В с концентрацией 2,7 моль/л равны 100 и 80 л/мин. Производительность реактора по продукту R составляет 8,64 кмоль/ч, концентрация продукта R на выходе — 0,8 моль/л. Определить требуемый объем реактора смешения.
Задача 3.1-53 Процесс описывается реакцией типа А + В → R с константой скорости равной 0,28 л/(моль/мин). Объемные потоки вещества А с концентрацией 1,6 моль/л и вещества В с концентрацией 2,0 моль/л равны 100 л/мин. Процесс проводится в реакторе смешения объемом 1,2 м 3 . Определить производительность реактора по продукту R.
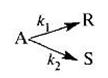
Задача 3.1-54. Процесс описывается параллельной реакцией типа
с константами скоростей k1=2,8*10 -1 л/(моль*мин) и k2=0,12 л/(моль*мин). Объемный поток вещества А с концентрацией 1,6 моль/л равен 100 л/мин, объем реактора смешения -1,2м 3 .
Определить производительность реактора и селективность процесса по веществу R
Задача 3.1-55. Процесс описывается параллельной реакцией типа
с константами скоростей k1=2,8*10 -1 л/(моль*мин) и k2=0,12 л/(моль*мин). Объемный поток вещества А с концентрацией 1,6 моль/л равен 100 л/мин, объем реактора вытеснения -0,4 м 3 .
Определить производительность реактора и селективность процесса по веществу S.
Задача 3.1-56. Процесс описывается параллельной реакцией типа
с константами скоростей k1=2,8*10 -1 л/(моль*мин) и k2=0,12 л/(моль*мин). Объемный поток вещества А с концентрацией 1,6 моль/л равен 100 л/мин. Процесс проводится в реакторе вытеснения. Определить объем реактора и концентрацию вещества S при условии, что производительность реактора по продукту R составляет 4,8 м 3 .
Задача 3.1-57. Процесс описывается параллельной реакцией типа
с константами скоростей k1=2,8*10 -1 л/(моль*мин) и k2=0,12 л/(моль*мин). Объемный поток вещества А с концентрацией 1,6 моль/л равен 100 л/мин. Процесс проводится в реакторе смешения. Определить объем реактора и достигаемую в нем степень превращения вещества А при условии, что производительность по продукту R составляет 4,8кмоль/ч.
Задача 3-1-58. Процесс описывается параллельной реакцией типа с константами скоростей k1 = 2,8*10 -1 л/(моль*мин) и k2 = 0,12 л/(моль*мин). Поток вещества А поступает с концентрацией 1,6 моль/л. Процесс проводится в реакторе вытеснения объемом 140л. Степень превращения вещества А составляет 0,7.
Определить производительность реактора по продукту R.
Задача 3.1-59 Процесс описывается параллельной реакцией типа:
A -(k1) → R
A -(k2) → S
с константами скоростей k1 = 2,8*10 -1 л/(моль*мин) и k2 = 0,12 л/(моль*мин). Поток вещества А поступает с концентрацией 1,6 моль/л. Процесс проводится в реакторе смешения объемом 200 л. Степень превращения вещества А составляет 0,8. Определить допустимый расход вещества А.
Задача 3.1-60 Процесс описывается параллельной реакцией типа:
A -(k1) → R
A -(k2) → S
с константами скоростей k1 = 1,8*10 -1 л/(моль*мин) и k2 = 0,06*10 -1 л/(моль•мин). Объемный поток вещества А равен 250 л/мин. Процесс проводится в реакторе смешения объемом 250 л. Концентрация вещества R на выходе из реактора равна 1,2 моль/л.
Определить концентрацию вещества А на входе в реактор и степень превращения вещества А.
Задача 3.1-61 Процесс описываемый последовательной реакцией типа A → R → S с константами скоростей k1 = 1,8•10 -1 л/(моль•мин) и k2 = 0,06 л/(моль•мин). Объемный поток вещества А равен 40л/мин. Процесс проводится в реакторе смешения объемом 60 л. Концентрация вещества А на входе в реактор составляет 2,4 моль/л. Определить концентрации веществ на выходе из реактора.
Задача 3.1-62 Процесс описываемый последовательной реакцией типа A → R → S с константами скоростей k1 = 1,8*10 -1 л/(моль*мин) и k2 = 0,06 л/(моль*мин). Объемный поток вещества А равен 40л/мин. Процесс проводится в реакторе смешения объемом 260 л. Концентрация вещества А на входе в реактор составляет 2,4 моль/л. Определить производительность реактора по продукту R, степень превращения вещества А и селективность по продукту R.
Задача 3.1-63 Процесс описываемый последовательной реакцией типа A → R → S с константами скоростей k1=2,4*10 -1 л/(моль*мин) и k2=0,18 л/(моль*мин). Объемный поток вещества А равен 3,6 м 3 /ч. Процесс проводится в реакторе смешения объемом 240 л. Концентрация вещества А на входе в реактор составляет 3,4 моль/л.
Определить концентрации всех веществ на выходе из реактора, степень превращения А и селективность по продукту R.
Задача 3.1-65 Процесс описываемый последовательной реакцией типа A → R → S с константами скоростей k1 = 1,2*10 -1 л/(моль*мин) и k2 = 0,8 л/(моль*мин). Объемный поток вещества А равен 3,6 м 3 /ч. Концентрация вещества А на входе в реактор составляет 3,4 моль/л, а степень првращения его — 0,48. Определить концентрации веществ R и S на выходе из реактора и объем реактора смешения.
Задача 3.1-66. В непрерывном реакторе идеального смешения проводится последовательная реакция типа
Константы скорости реакций k1=2 ч -1 , k2=0,8 ч -1 . Исходная концентрация вещества А равна СА0=5 кмоль/м 3 . Продукты R и S на входе в реактор отстутствуют. Рассчитать необходимый объем реактора смешения для максимального выхода целевого продукта R, степень превращения исходного реагента, селективность и выход по целевому продукту, если объёмный расход составляет 2,4 м 3 /ч.
Задача 3.1-67 По условию задачи 3.1-66 рассчитать необходимый объем реактора вытеснения, степень превращения вещества А, селективность и выход целевого продукта.
3.1-66 (условие) В непрерывном реакторе смешения проводится последовательная реакция типа А → R → S с константами скоростей k1 = 0,5 ч -1 и k 1 = 0,8 ч -1 . Исходная концентрация вещества А равна 5 кмоль/м 3 . Продукты R и S на входе в реактор отсутствуют. Рассчитать необходимый объем реактора смешения для максимального выхода целевого продукта R, степень превращения исходного реагента, селективность и выход по целевому продукту, если объемный расход составляет 2,4 м 3 /ч.
Скачать решение задачи 3.1-67 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 3.1-70 Жидкофазная реакция типа A → 2R имеет константу скорости равную 3,8 ч -1 . Объемный расход исходного вещества с концентрацией 0,8 моль/л составляет 14,5 м 3 /ч.
Рассчитать суточную производительность по продукту R для реактора смешения объемом 4 м3.
Задача 3.2-1 В проточном реакторе идеального смешения проводится обратимая экзотермическая реакция первого порядка.
Показать, что температура, при которой будет достигнута максимальная степень превращения, определяется формулой
Считать, что константы скорости реакции, энергии активации и время пребывания смеси в реакторе заданы.
Скачать решение задачи 3.2-1 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 3.2-2 Процесс, описываемый параллельной реакцией
протекает в диапазоне температур от 573 до 773 К.
При какой температуре необходимо проводить процесс, чтобы обеспечить образование максимального числа молей продукта R в реакторах идеального вытеснения и идеального смешения непрерывного действия, если константы скорости, с -1 , описываются уравнениями k1= 10 15 exp[–20000/(RT)], k2 = 10 14 ехр[–10000/(RT)]?
Задача 3.2-3 Процесс, описываемый параллельной реакцией
Проводиться в реакторе идеального смешения при изотерическом режиме работы.
Определить температуру, при которой должен работать реактор, чтобы на образование 2 моль продукта R образовывался 1 моль продукта S.
Константы скоростей реакции, с -1 , определяются уравнениями: k1=6*10 13 ехр [-37000/(RT)] , k2= 3,7*10 13 ехр [-40000/(RT)] .
Задача 3.2-5 Жидкофазный процесс, описываемый параллельно-последовательной реакцией
осуществляется в проточном реакторе идеального смешения. Константы скорости, с-1, реакции: k1= 10 10 ехр [-64000/(RT)] ; k2 =10 8 ехр [-80000/(RT)] ; k3 = 10 7 exp [-40000/(RT)] .
Определить оптимальную температуру, при которой будет, достигнут максимальный выход продукта R, если требуемая степень превращения исходного вещества составляет 80%.
Задача 3.2-6 В каскаде из трех реакторов равного объема проводится жидко-фазная реакция А = R + Qp при температуре 368 К. Тепловой эффект реакции равен 1,67*10 6 Дж/кг. Константа скорости реакции, с -1 , описывается уравнением k = 4•10 6 ехр (–7900/Т) . Произведение pср= 4,2*10 6 Дж/град правильная размерность (кг/м3•Дж/(кг*град) = Дж/(м3*град)) остается постоянным и не зависит от степени превращения и температуры. Исходная концентрация вещества А в потоке равна 1 кмоль/м 3 , молярная масса вещества А – 100 кг/кмоль, производительность каскада по продукту R — 0,375*10 -3 кмоль/с, требуемая степень превращения вещества А – 0,95. Первый реактор каскада работает в адиабатическом режиме, второй и третий — с отводом теплоты. Температура реакционной смеси падает в трубопроводах между первым и вторым реактором на 3 град, а между вторым и третьим па 5 град. Коэффициент теплопередачи во втором и третьем реакторе от реакционной смеси к охлаждающей воде равен 11000 Вт/(м 2 *К). Температура охлаждающей воды в теплообменниках второго и третьего реакторов составляет 288 К.
Определить: поверхность теплообмена во втором и третьем реакторах каскада; необходимую температуру смеси на входе в первый реактор каскада; объем единичного реактора каскада. Показать, что первый реактор каскада работает в устойчивом режиме.
Задача 3.2-7 Газовая смесь поступает в реактор со скоростью 2,5*10 -3 кмоль/с. Начальная температура смеси – 833 К, давление — 5*10 5 Па, диаметр реактора – 0,2 м. В реакторе адиабатически протекает химическая реакция А + В = R + Qp. Состав исходной смеси в молярных долях, %, следующий: 40 – А, 40 – В и 20 – инертных газов. Теплоемкости исходных реагентов, продуктов реакции и инертных газов соответственно равны 25*10^3, 42*10 3 , 21*10 3 Дж/(кмоль*К). Тепловой эффект реакции при температуре 278 К составляет 53,3*10 6 Дж/кмоль. Зависимость константы скорости от температуры:
Определить необходимую длину реактора для достижения степени превращения по веществу А равной 95 %.
Задача 3.2-8 В проточном реакторе идеального смешения объемом 2 м 3 проводится необратимая экзотермическая реакция с константой скорости, с-1, описываемой уравнением k = 10 12 ехр [-90000/(/R*T)] . Теплоемкость реакционной смеси равна 20790 Дж/(кг*К) и не зависит от температуры и степени превращения. Плотность реакционной смеси остается постоянной и равной 1000 кг/м3.
Исходный реагент с концентрацией 6 кмоль/м 3 подается в реактор со скоростью 5 м 3 /ч. Тепловой эффект реакции равен 96600 Дж/моль. Температура в реакторе не должна превышать 333 К.
Рассчитать, при какой температуре следует подавать исходный раствор, чтобы процесс протекал в адиабатическом режиме.
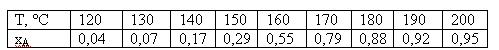
Задача 3.2-9 В реакторе идеального вытеснения, работающем в адиабатическом режиме, протекает необратимая экзотермическая реакция первого порядка.
Определить минимальную температуру, которую необходимо под-держивать на входе в реактор, чтобы обеспечить устойчивый режим работы, если тепловой эффект реакции равен 13500 Дж/моль, а удельная теплоемкость реакционной смеси ср = 145 Дж/(моль-К). Связь степени превращения и температуры представлена следующими данными:
х 0,1 0,25 0,58 0,72 0,88 0,9
Т, К 283 293 303 313 323 333
Задача 3.2-10 В реакторе идеального смешения объемом 0,3 м 3 проводится экзотермическая реакция первого порядка А > R + Qp. Константа скорости реакции, мин -1 , описывается уравнением k = 10 3 ехр[-20000/(RT)]. Тепловой эффект реакции сосавляет 9637 кДж/кмоль. Плотность реакционной массы не зависит от температуры и степени превращения и равна 420 кг/м 3 , удельная теплоемкость раствора — 3,8 кДж/(кг•К). Растворе реагента А подается в реактор с концентрацией 6 кмоль/м 3 в количестве 0,6 м 3 /ч.
Рассчитать, при какой температуре следует подавать исходный раствор компонента А в реактор, работающий в адиабатическом режиме, чтобы температура в нем не превышала 60 °С.
Скачать решение задачи 3.2-10 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 3.2-11 Определить максимальную производительность установки, состоящей из двух реакторов, соединенных последовательно: реактора идеального смешения объемом 0,6 м 3 и реактора идеального вытеснения объемом 0,1 м 3 , при проведении реакции 2A -> R + Qр. Константа скорости реакции, м3/(кмоль-с), описывается уравнением k = 4*10 9 ехр(-8000/T). Концентрация реагента А в исходном потоке равна 0,5 кмоль/м3. Исходная температура потока составляет 20 °С, адиабатический разогрев — 60 °С, требуемая степень превращения — 0,96. Установка работает в адиабатическом режиме.
Задача 3.2-12 В реакторе идеального вытеснения проводится реакция А +В = R + S +Qp в адиабатическом режиме. Концентрации веществ А и В в исходных потоках равны 2,4 кмоль/м3. Общий расход реакционной смеси составляет 1,55•10 -3 м 3 /с, начальная температура потока — 20 °С, температура реакционной смеси на выходе из реактора — 53 °С, Константа скорости реакции описывается уравнением
k = 6,52*10 5 exp(-5,1*10 3 /Т)
Определить объем реактора, необходимый для достижения степени превращения по веществу А равной 0,82
Задача 3.2-13 Определить температуру проведения реакции и степень пре-вращения, которые будут достигнуты, если реакцию A → R + Qp про-водить в адиабатическом режиме в реакторе идеального смешения объемом 0,05 м 3 . Объемный расход реагента А с концентрацией 3 кмоль/м 3 равен 1,75*10 3 м 3 /с, константа скорости реакции, с-1, описывается уравнением k = 10 5 ехр[-45300/(R*T)]. Тепловой эффект реакции составляет 2,8*10 7 Дж/кмоль. Плотность реакционной смеси равна 524 кг/м3, а теплоемкость — 1200 Дж/(кг-К) и не зависят от степени превращения. Температура входящего потока — 325 К.
Задача 3.2-14 В реакторе идеального вытеснения объемом 1,26 м3, работающем в адиабатических условиях, проводится реакция первого порядка 2А = R + Qp, с константой скорости, с -1 , описываемой уравнением k = 10 13 ехр[-1200/T]. В реактор подается поток с концентрацией вещества А 3,2 кмоль/м3 при 325 К. Температура реакционной смеси на выходе из реактора составляет 357 К, тепловой эффект реакции — 2,7*10 7 Дж/кмоль, теплоемкость реакционной смеси — 2,2*10 3 Дж/(кг*К), плотность реакционной смеси — 850 кг/м3. Определить производительность реактора по продукту R.
Задача 3.2-15 Необратимую экзотермическую реакцию А = R + Qp с тепловым эффектом равным 2*10 7 Дж/кмоль проводят в адиабатическом реакторе идеального смешения объемом 10 м 3 . Константа скорости, с -1 , описывается уравнением k = 10 13 ехр(-12000/Т). Плотность раствора не зависит от степени превращения и температуры и равна 850 кг/м 3 . Удельная теплоемкость постоянна и равна 2200 Дж/(кг*К). Раствор с концентрацией реагента А равной 5 кмоль/м 3 подается в реактор в количестве 10 -2 м 3 /с.
Определить температуру проведения реакции и степень превращения, если раствор реагента А продается при: 290; 300; 310 К.
Задача 3.2-16 В реакторе идеального смешения непрерывного действия, работающем в адиабатическом режиме, проводится реакция A + B -> R + S + Qp константой скорости, л/(моль-с), описываемой уравнением k = 5,08*10 5 ехр[-4,23*10 4 /(R*T)], и тепловым эффектом равным 75000 кДж/(моль-А). Концентрации исходных реагентов САО = Сво = 1,2 кмоль/м3. Темлоемкость реакционной смеси постоянна и равна 1,8 кДж/(кг-К). Исходный раствор подается с температурой 20 °С в количестве 12 м 3 /ч. Определить объем реактора для достижения степени превращения
Задача 3.2-18 В реакторе идеального смешения непрерывного действия проводится экзотермическая реакция А -> R + Qр с тепловым эффектом равным 190 кДж/кмоль. Расход реагента А с температурой 15 °С составляет 0,2 кмоль/с, теплоемкость реакционной смеси — 16,7 кДж/(кмоль*К), температура реакционной смеси на выходе из реактора — 49 °С, степень превращения по веществу А — 0,8, средняя разность температур между охлаждающим агентом и реакционной смесью — 10 град, коэффициент теплопередачи равен 419 кДж/(м2*с*К).
Определить количество отводимой или подводимой теплоты и требуемую площадь теплообмена.
Задача 3.2-19 Необратимая экзотермическая реакция А > R + Qp с константой скорости, с-1, описываемой уравнением: k = 2,7•10 8 еxp(-7900/(T), проводится в каскаде из трех реакторов идеального смешения равных по объему 2 м 3 . Тепловой эффект реакции составляет 6,5•10 7 Дж/кмоль А, концентрация исходного реагента — 0,5 кмоль/м 3 . Теплоемкость реакционной смеси равна 2400 Дж/(кг•К), а плотность — 850 кг/м3 и не зависят от температуры. Реакционная смесь подается в реактор с температ (цена 200р) урой 5 °С и скорость 2•10 -3 м 3 /с.
Определить, какое количество теплоты надо подводить или отводить от каждого реактора, если в них поддерживать следующие температуры 15, 25, 35 °С.
Задача 3.2-20 Экзотермическая реакция А → R + Qp проводится в непрерывном реакторе идеального смешения, работающем в адиабатическом режиме. Тепловой эффект реакции равен 149 кДж/моль. Исходная концентрация вещества А составляет 0,25 молярной доли. Теплоемкость реакционной смеси постоянна и равна 2,2 кДж/(моль*К). Требуемая степень превращения вещества А составляет 0,95.
Определить температуру реакционной смеси на входе в реактор, если зависимость хА = f(T) представлена следующими данными:
Отвечает ли полученный результат устойчивому режиму работы реактора идеального смешения?
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Производство этилацетата
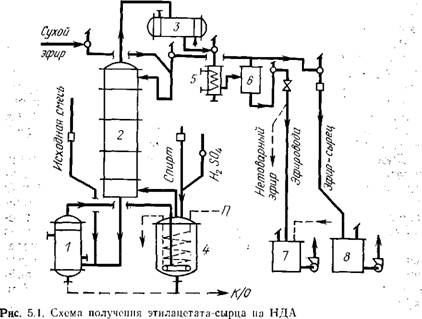
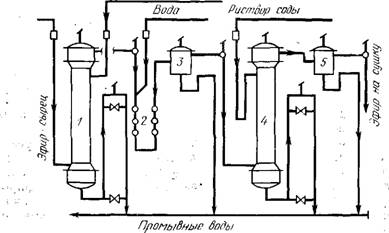
Сырьем для получения этилацетата служат технические сорта синтетической и, частично, лесохимической уксусной кислоты и технический этиловый спирт. Процесс этерификации, облагораживания эфира-сырца и его ректификации ведут непрерывным способом. Этерификационный аппарат (рис. 5.1) состоит из куба-реактора 4 вместимостью 8—16 м3, колонны 2 С 28—30 тарелками, дефлегматора 3, холодильника дистиллята 5, флорентины 6, напорных баков-мерников для кислоты, спирта и катализатора, смесителя, подогревателя-испарителя исходной смеси /, приемников эфироводы 7 и эфира-сырца 8.
Первоначально в куб заливают смесь 92—93 %-ной уксусной кислоты и этилового спирта в молярном соотношении 1 : 0,2 и 2—3 % катализатора — крепкой серной кислоты (считая от 100 %-ной уксусной кислоты). После разогрева аппарата и работы колонны «на себя» в течение 1,5—2 ч для создания в системе некоторого запаса эфира (состояние равновесия) в куб 4 Начинают непрерывно подавать через барботер парожидкост — ную смесь исходных компонентов (смешанных заранее в молярном соотношении 1:1,1). Одновременно с этим начинают отбор дистиллята (через флорентину). Уровень жидкости в реакторе поддерживают постоянным, выравнивая подачу исходной смеси и отбор дистиллята. Массовая доля уксусной кислоты в кубе должна быть не ниже 70—75 %, воды 8—13 %>; давление в нижней части колонны 8—9 кПа; температура вверху колонны 68—72 °С. В реакционной смеси спирта должно быть меньше, чем требуется для образования тройной, нерасслаи — вающейся азеотропной смеси. Если же дистиллят близок к двойной легкорасслаивающейся смеси этилацетат — вода состава 91,5:8,5%) с температурой отгона 70,4 °С, то с этой смесью при определенной величине флегмового числа из реактора уходит почти вся вода, что сдвигает реакцию в сторону эфирообразования. Конденсат, поступающий во флорентину, охлаждается до 20—25 °С. Это улучшает условия расслоения его на эфироводу и эфир-сырец; при этом снижается и растворимость воды в эфире до 3—4 %.
Эфир-сырец с содержанием эфиров не менее 90—93 % и кислотностью не более 0,06 % большей частью возвращается во флегму и частично отбирается в сборник. Количество флегмы зависит от крепости исходной уксусной кислоты: при 80 %-ной кислоте флегмовое число около 7, 90 %-ной —5 и при 95 %-ной — 4. Целесообразно в качестве флегмы подавать обезвоженный этилацетат, а не сырец из флорентины. Это повысит в 1,9 раза производительность этерификатора, которая зависит также от мощности нагревательных элементов и типа тарелок в колонне и составляет обычно 950—1200 л/ч эфира-сырца на 1 м2 сечения колонны.
Процессы этерификации и отгонки эфира и воды из реактора продолжаются непрерывно до накопления в кубе значительного количества смолистых загрязнений. Тогда в аппарат подают спирт или спиртовую фракцию от регенерации эфироводы, чтобы проэтерифицировать остатки кислоты (до содержания не более 2%), отгоняют максимально возможное количество нетоварного эфира, содержащего до 25 % спирта, и останавливают аппарат на чистку. Оборот этерификатора при применении экстракционной загрязненной кислоты составляет 25—40 дней, а при концентрированной и чистой, преимущественно синтетической, до 60—90 дней. В последнем случае исключаются стадии обесцвечивания и промывки, эфир-сырец лишь нейтрализуют и обезвоживают, а также регенерируют небольшое количество эфироводы, содержащей 4—6 % эфиров и 3—7 % спиртов.
Имеется опыт работы НДА для этерификации синтетической уксусной кислоты этиловым спиртом в присутствии катализатора— катионита марки КУ-2 с показателем СОЕ (статическая обменная емкость) до 2 мг-экв Н+ на 1 г сухого вещества. Гранулы катализатора в виде цилиндриков диаметром 8— 12 мм и длиной 12—14 мм в набухшем состоянии загружают в колонну, высота слоя должна быть 2,9 м. Этот слой ограничивают снизу опорными кольцами Рашига, сверху ситчатой тарелкой. В верхней, укрепляющей части колонны имеется 13 кол- пачковых тарелок при общей высоте колонны 7 м. Колонна, как обычно, связана с кубом-кипятильником и конденсатором.
В куб первоначально загружают 6 т уксусной кислоты и после разогрева системы начинают подавать в него исходную смесь кислоты и спирта в молярном соотношении 1:1. Весь дистиллят направляют из конденсатора во флорентину и в качестве флегмы орошают верх колонны сухим этилацетатом. В этом случае вся реакционная вода выводится азеотропной смесью без перегрузки колонны флегмой и производительность НДА повышается.
Показатели процесса: температура верха зоны катализа 85—95 °С: верха колонны 70,2—72 °С; плотность орошения по сечению колонны 2—2,5 м3/(м2-ч) при скорости паров 0,3 м/с; перепад давления между низом и верхом колонны 18—20 кПа
Рис. 5.2. Обесцвечивание, промывка и нейтрализация этилацетата-сырца. ‘Ля Непрерывнодействующем аппарате
При количестве паров 3,5 м3/ч; нагрузка на катализатор по исходной смеси 0,6—0,8 г/(г-ч). Производительность НДА по эфиру-сырцу 600—800 кг/ч с содержанием в нем, %: эфиров 92—94, спирта 1,5—4,5 и воды 3,5—4,5 при кислотности не более 0,1 %.
При работе с синтетическим исходным сырьем срок службы катализатора без регенерации более 6 мес, засмоление поверхностей нагрева в кубе не происходит, коррозия аппаратуры незначительна.
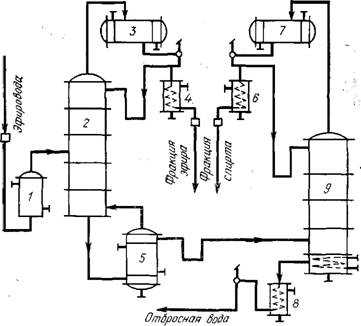
Очистка этилацетата-сырца. При значительном содержании этилформиата (до 4—5%) этилацетат-сырец лучше сначала освободить от легколетучих примесей. Обесцвечивание, промывку и нейтрализацию этилацетата-сырца производят на непрерывнодействующем ступенчатом агрегате, показанном на рис. 5.2. Эфир-сырец с кислотностью до 0,1 % самотеком направляется в низ противоточной колонны 1, на верх которой одновременно поступает заданное количество 3—5%-ного раствора бисульфита натрия, заполняющего колонну на ее высоты в качестве сплошной фазы. Пройдя через этот слой снизу вверх, эфир осветляется, накапливается в верхней части колонны, перетекает через ее верх, обильно промывается водой в каскадных смесительных трубках 2 до полного удаления сернистых соединений. Промытый эфир отстаивается во флорентине 3 и стекает в третью ступень очистки для нейтрализации 5—10 %- ным содовым раствором, подаваемым на верх колонны 4. Далее эмульсия отстаивается во флорентине 5, откуда эфирный
Рис. 5.3. Регенерация эфироводы:
1 — подогреватель; 2 — колонна для отгонки эфира; 3, 7 — дефлегматоры; ‘4. в, S — Холодильники; 5 — каландрия; 9— НДА для отгонки спиртоь
Слой с кислотностью не более 0,006 % поступает на сушку и ректификацию.
Растворы бисульфита из колонны 1 и соды из флорентины 5 Могут быть использованы несколько раз и затем присоединены к другим солевым растворам для извлечения из них эфира и спирта. Накапливающиеся промывные воды вместе с эфиро — водой из флорентины этерификатора или самостоятельно идут на регенерацию в двухколонный НДА (рис. 5.3). Получаемую при 75—80 °С первую фракцию дистиллята, содержащую 60— 68 % эфира и до 25 % спирта, возвращают в эфир-сырец, а вторую (85—90 °С), спиртовую — в куб этерификатора. Отбросная вода должна содержать не более 0,03 % спиртов.
Нейтрализованный этилацетат лучше осушать азеотропный способом в процессе его ректификации на НДА, несмотря на то, что этилацетат увлекает с азеотропной смесью мало воды.
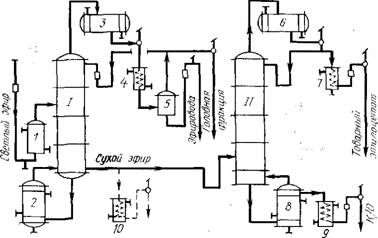
Ректификация этилацетата. Ее ведут на двухколонном НДА (рис. 5.4), отбирая сверху первой, обезвоживающей, колонны 1 с числом тарелок 20 + 20 азеотропные смеси легкокипящих эфиров и воды (в том числе этилформиата), а снизу, при 78— 79 °С — безводный эфир для окончательной очистки от хвостовых примесей во второй колонне II с числом тарелок 10 + 20.
Рис. 5.4. НДА для ректификации этилацетата:
1, 11 — ректификационные колонны; / — подогреватель; 2, 8 — кипятильники; 3, S — дефлегматоры; 4, 7, 10 — холодильники; 5 — флорентина; 9 — холодильник хвостовой фракции; К/О — кубовый остаток
С головной фракцией от колонны I (67—69 °С) отгоняются все легкокипящие примеси. Эта фракция с выходом около 5 % возвращается в эфир-сырец, а при значительном содержании в ней формиатов подлежит отдельной переработке.
Колонна II НДА обеспечивает получение товарного продукта с содержанием в нем эфира не менее 90 или 98%- Температура вверху колонны 11 77—78 °С, внизу 82—90 °С; флегмовое число 4—5. Производительность ректификационных колонн, считая на 1 м2 их сечения, составляет по эфиру — сырцу 2500 л/ч, если из него предварительно удален этилформиат.
При использовании лесохимической уксусной кислоты остаток от второй колонны, содержащий 20—40 % этилпропионата, этилбутират, этилизовалерат и другие вещества, собирают отдельно для повторной переработки и выделения указанных эфиров. Кубовые остатки от переработки фракций высших эфиров или солевых растворов содержат труднолетучие окисленные вещества и соли; после отгонки из них остатков эфиров они спускаются в сточные воды.
Конверсия уксусной кислоты при этерификации не превышает 95—96 %. В эфироводу переходит до 4,5 % эфира и 8— 9 % спирта. Выход сухого эфира от сырца 95 % и товарного 85—90 %. Остальное количество эфира переходит в промежуточные фракции и частично теряется за счет гидролиза водой. Значительны потери и при нейтрализации сырого эфира, кислотность которого до 0,1 %.
Видео:Метод QSAR, QSPRСкачать

Структура, свойства, синтез, использование и риски этилацетата
этилацетат или этилэтаноат (Название IUPAC) является органическим соединением, химическая формула которого CH3COOC2H5. Он состоит из сложного эфира, где спиртовой компонент происходит из этанола, а его карбоновая кислота — из уксусной кислоты..
Это жидкость в нормальных условиях температуры и давления, дающая фруктам приятный аромат. Это свойство идеально гармонирует с тем, что ожидается от эфира; что на самом деле химическая природа этилацетата. По этой причине он находит применение в пищевых продуктах и алкогольных напитках..
На верхнем изображении показана структура скелета этилацетата. Отметьте слева его компонент карбоновой кислоты, а справа компонент спирта. Со структурной точки зрения можно ожидать, что это соединение ведет себя как гибрид уксуса и алкоголя; тем не менее, он обладает собственными свойствами.
Вот где такие гибриды, называемые сложными эфирами, отличаются от других. Этилацетат не может реагировать как кислота и не может дегидратироваться в отсутствие группы ОН. Вместо этого он подвергается основному гидролизу в присутствии сильного основания, такого как гидроксид натрия, NaOH.
Эта реакция гидролиза используется в учебных лабораториях для химических кинетических экспериментов; где реакция, кроме того, имеет второй порядок. Когда происходит гидролиз, практически этилэтаноат возвращается к своим исходным компонентам: кислоте (депротонированной NaOH) и спирту.
В его структурном скелете наблюдается, что атомы водорода преобладают над атомами кислорода. Это влияет на их способность взаимодействовать с неполярными видами, такими как жиры. Он также используется для растворения таких соединений, как смолы, красители и вообще органические твердые вещества..
Несмотря на приятный аромат, длительное воздействие этой жидкости оказывает негативное воздействие (как почти все химические соединения) на организм.
- 1 Структура этилацетата
- 1.1 Отсутствие атомов доноров водорода
- 2 Физические и химические свойства
- 2.1 Имена
- 2.2 Молекулярная формула
- 2.3 Молекулярный вес
- 2.4 Физическое описание
- 2.5 Цвет
- 2.6 Запах
- 2.7 Вкус
- 2.8 Порог запаха
- 2.9 Точка кипения
- 2.10 Точка плавления
- 2.11 Растворимость в воде
- 2.12 Растворимость в органических растворителях
- 2.13 Плотность
- 2.14 Плотность пара
- 2.15 Стабильность
- 2.16 Давление пара
- 2.17 Вязкость
- 2.18 Теплота сгорания
- 2.19 Тепло испарения
- 2.20 Поверхностное натяжение
- 2.21 Показатель преломления
- 2.22 Температура хранения
- 2,23 пКа
- 3 Резюме
- 3.1 Реакция Фишера
- 3.2 Реакция Тищенко
- 3.3 Другие методы
- 4 использования
- 4.1 Растворитель
- 4.2 Искусственные ароматизаторы
- 4.3 Аналитика
- 4.4 Органический синтез
- 4.5 Хроматография
- 4.6 Энтомология
- 5 рисков
- 6 Ссылки
Видео:Химия. 8 класс. Химические реакции в жизнедеятельности живых организмов и человека /07.10.2020/Скачать

Структура этилацетата
На верхнем изображении структура этилацетата показана с моделью сфер и баров. В этой модели выделены атомы кислорода с красными сферами; слева — фракция, полученная из кислоты, а справа — фракция, полученная из спирта (алкоксигруппа, -OR).
Карбонильная группа оценивается связью C = O (двойные столбцы). Структура вокруг этой группы и соседнего кислорода является плоской, потому что происходит делокализация нагрузки путем резонанса между обоими атомами кислорода; факт, который объясняет относительно низкую кислотность α-водорода (такового для группы -CH3, связан с C = O).
Молекула, вращая две свои связи, напрямую способствует взаимодействию с другими молекулами. Наличие двух атомов кислорода и асимметрия в структуре придают ей постоянный дипольный момент; который, в свою очередь, отвечает за свои диполь-дипольные взаимодействия.
Например, электронная плотность больше рядом с двумя атомами кислорода, значительно уменьшаясь в группе -CH3, и постепенно в группе ОЧ2СН3.
Из-за этих взаимодействий молекулы этилацетата образуют жидкость при нормальных условиях, которая имеет значительно более высокую температуру кипения (77ºC).
Отсутствие донорных атомов водородных связей
Если вы внимательно посмотрите на структуру, вы заметите отсутствие атома, способного передавать водородный мостик. Однако атомы кислорода являются такими акцепторами, а этилацетат очень хорошо растворяется в воде и в значительной степени взаимодействует с полярными соединениями и донорами водородных связей (такими как сахара)..
Кроме того, это позволяет превосходно взаимодействовать с этанолом; поэтому его присутствие в алкогольных напитках не удивительно.
С другой стороны, его алкоксигруппа позволяет ему взаимодействовать с некоторыми неполярными соединениями, такими как хлороформ, СН3Cl.
📸 Видео
Что такое технологический процесс? Введение.Скачать

Тема 12. Химическая промышленность (производство резиновых и пластмассовых изделий)Скачать

68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Химия, 9-й класс, Общая характеристика алюминия по его положению в ПСХЭ. Свойства алюминияСкачать

Лабораторная работа 2. ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ ХИМИЧЕСКОГО ПРОЦЕССАСкачать

Вторичное производство | ПромышленностьСкачать

Условия хранения и утилизации химических реактивовСкачать
Технология выплавки стали в кислородных конвертерахСкачать

Эволюция технологий экспонирования в производстве печатных платСкачать

Подготовка к итоговой аттестации по химии посредством образовательных ресурсов и сервисоСкачать

Модели реакторов идеального вытеснения и идеального смешенияСкачать

Канал "Санкт-Петербург" на производстве "БиоВитрум"Скачать

"Химическая посуда и дополнительное оборудование"Скачать

Кислородно конвертерный способ получения сталиСкачать