Реактивы и материалы: хлороформ (или дихлорэтан), медная проволока.
Галогены в составе органических соединений проще всего открываются по Бельштейну – прокаливанием органического вещества с оксидом меди в пламени горелки.
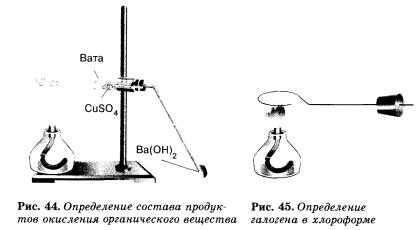
Медную проволоку длиной 10см с петлей на конце прокаливают над пламенем горелки до исчезновения посторонней окраски пламени (признак отсутствия загрязнения медной проволоки). Остывшую петлю, покрывшуюся черным налетом оксида меди, опускают в пробирку с 1-2 каплями хлороформа (или дихлорэтана) и вновь вносят в пламя горелки. Немедленно появляется ярко-зеленая окраска пламени.
При прокаливании кислород оксида меди окисляет углерод и водород органического вещества в диоксид углерода и воду, медь же образует с галогеном летучие соединения, которые и окрашивают пламя горелки в зеленый цвет. Появление зеленого окрашивания указывает на присутствие в органическом соединении галогена.
Химизм процесса: 2СНСl3 + 5СuО → СuСl2 + 4СuСl + 2СО2 + Н2О
Подобную окраску пламени дают помимо хлористых и другие галогеносодержащие органические соединения.
ОПЫТ №2 Получение хлористого этила.
Реактивы и материалы: этиловый спирт, конц. Н2SО4, NаСl(кристал.), газоотводная трубка.
В пробирку помещают 2-3мл заранее приготовленной смеси этилового спирта с концентрированной серной кислотой. Прибавляют 1-2г хлорида натрия. Пробирку закрывают пробкой с небольшой газоотводной трубкой, укрепляют наклонно в штативе и осторожно нагревают над пламенем горелки. Если поднести через некоторое время к отверстию газоотводной трубки зажженную лучину, то наблюдается горение образовавшегося хлористого этила с характерным колечком зеленого цвета по краю газоотводной трубки. Реакция образования хлористого этила протекает по следующей схеме:
Раздел II Кислородсодержащие соединения
Тема 9. Спирты
Задания для самостоятельной работы
Задание 1. Общая характеристика и свойства спиртов.
1. Дать определение спиртов. Привести их общую формулу.
2. Как классифицируются спирты в зависимости от количества спиртовых групп, от строения радикала и места расположения групп в углеродном скелете. Привести примеры.
3. Написать структурные формулы спиртов и указать первичные, вторичные, третичные спирты: этанол, 1-пропанол, 2-пропанол, 3-метил-1-пентанол, 3,3-диметил-2-пентанол, 3-метил-1-бутанол.
Задание 2. Способы получения и свойства спиртов.
1. Получить спирты: 2-метил-2-бутанол, 3,3-диметил-2-бутанол. Гидратацией соответствующих алкенов, щелочным гидролизом соответствующих галогенпроизводных.
2. Из пропаналя, муравьиного альдегида, бутанона и реактива Гриньяра (бромистого этилмагния) получить первичный, вторичный и третичный спирты.
3. Для спирта 3-метил-2-бутанола написать уравнения реакций
— с пропановой кислотой
— с Nа металлическим
4. Написать уравнения реакций для изопропилового спирта:
5. Написать уравнения реакций этерификации изопропилового спирта и муравьиной кислоты; пропилового спирта и уксусной кислоты.
6. Осуществить превращения, назвать продукты:
а) СН3-СН2-СН2-ОН 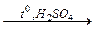



б) СН3-СН2-ОН + Nа → А 
→ А 
в) СН3-СН2-СН2-Сl 



7. Написать химическую реакцию взаимодействия глицерина с гидроксидом меди и с избытком уксусной кислоты:
Видео:Получение ХЛОРОФОРМАСкачать

Практическая работа № 3. «Обнаружение галогенов (проба Бейльштейна)»
Просмотр содержимого документа
«Практическая работа № 3. «Обнаружение галогенов (проба Бейльштейна)»»
Практическая работа № 3.
«Обнаружение галогенов (проба Бейльштейна)»
научить определять хлор в органических соединениях;
познакомить с качественными реакциями непредельных углеводородов.
Реактивы: медная проволока, хлороформ, оксид меди (II)
Посуда и оборудование: лабораторный штатив, штатив для пробирок, пробирки, пробка с газоотводной трубкой, спиртовка, спички.
Опыт № 1 Обнаружение галогенов (проба Бейльштейна)
Галогены можно обнаружить при помощи реакции окрашивания пламени, предложенную русским химиком Ф. Ф. Бейльштейном.
Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в небольшую пробку (рис. 45).
Держа за пробку, прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди (ІІ), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки.
Видео:Проба БейльштейнаСкачать

Проба бейльштейна уравнение реакции с хлороформом
Проба Бейльштейна (реакция Бейльштейна)
Проба Бейльштейна (реакция Бейльштейна) — качественная реакция на галогены (хлор, бром, иод) в органических соединениях. Провести данный эксперимент очень просто. На конце тонкой медной проволоки делают петлю и прокаливают ее в окислительном пламени горелки, пока она не перестанет окрашивать пламя в зеленый цвет. Проволоку охлаждают, петельку смачивают или посыпают испытуемым веществом и снова вносят в пламя. В случае присутствия в пробе галогена пламя окрашивается в зеленый (или сине-зеленый) цвет.
При действии на медь кислорода образуется оксид, который дает при взаимодействии с органическими веществами, содержащими галоген, летучие галогениды меди (I) — CuCl, CuBr и CuI. Данные соединения окрашивают пламя в зеленый (или сине-зеленый) цвет. Фторид меди (I) CuF в этих условиях нелетуч, поэтому фторпроизводные органических веществ не дают зеленой окраски пламени.
В реакцию Бейльштейна вступают все классы органических соединений, содержащих хлор, бром и иод. Мы использовали четыреххлористый углерод. Если у вас нет четыреххлористого углерода, можно взять другие вещества, например, хлороформ или поливинилхлорид (ПВХ).
Некоторые органические соединения, не содержащие галоген, также способны давать положительную пробу Бейльштейна (т.е. пламя окрашивается в зеленый цвет при отсутствии в органическом веществе галогена). В качестве примеров можно привести оксихинолин и тиомочевину. Более подробно об этом можно узнать в книге Ф. Файгль Капельный анализ органических веществ (1962) , С. 109-111 .
Читателям, которые интересуются демонстрационными опытами по органической химии, рекомендуем книги: С.А. Зонис, С.М. Мазуров Лабораторно-лекционные опыты и демонстрационные материалы по органической химии (1961) и Г. Рупе Лекционные опыты по органической химии (1935)
Перейдем к экспериментам.
Медную проволочку выдержали в пламени газовой горелки (работающей на смеси пропан-бутан — воздух). Когда зеленоватая окраска пламени исчезла, проволочку вынули из пламени, опустили в четыреххлористый углерод и снова внесли в пламя. Пламя горелки окрасилось в изумрудно-зеленый цвет. Процедуру повторили несколько раз. Имейте в виду, что в условиях опыта возможно образование опасного фосгена COCl2, пары хлорорганических соединений также могут быть весьма токсичны.
После проведения опыта на дне колбочки с CCl4 образовался белый осадок. Вероятно это хлорид меди (I) CuCl (идентификация не проводилась). Можно предположить, что образованию осадка CuCl способствовало то обстоятельство, что проволочку опускали в жидкость еще горячей (так делать не следует).
Несколько комментариев по поводу фотографий и видео. В некоторых случаях мы забыли сделать на конце проволочки петельку, что уменьшило время окрашивания пламени. Камера значительно искажает цветопередачу и светопередачу: на самом деле пламя горелки выглядело зеленым, а на фотографиях и видео оно часто белое.
Зажжем газовую горелку фото |
Проба Бейльштейна |
Данный метод был предложен Фридрихом Конрадом (Федором Федоровичем) Бейльштейном в 1872 г (нередко фамилию ученого пишут как «Бельштейн», что не совсем верно). Ф.К. Бейльштейн получил мировую известность благодаря составлению и изданию «Справочника по органической химии» («Handbuch der organischen Chemie»). Целью справочника Бейльштейна было собрать и систематизировать информацию по всем известным на то время органическим соединениям. Данный справочник высоко ценится химиками всего мира и продолжил выходить после смерти его создателя: по мере бурного развития органической химии появлялись все новые тома. В разговорной речи справочник называют просто «Бейльштейн». Первые тома справочника Бейльштейна были изданы на немецком (начиная с 1881 г), более поздние — на английском. Для работы над новыми томами справочника во Франкфурте-на-Майне (Германия) в 1951 г был создан специальный Институт Бейльштейна. Значительно позднее справочник Бейльштейна превратился в электронную базу, что расширило его доступность и значительно облегчило пользование. Более подробно о жизни и деятельности Ф.К. Бейльштейна можно узнать из книг Волков В.А., Вонский Е.В., Кузнецова Г.И. Выдающиеся химики мира (1991) и Манолов К. Великие химики |
| Ф.К. Бейльштейн Рассказ о том, как благодаря справочнику Бейльштейна было раскрыто убийство: 🔥 ВидеоПолучение ХЛОРОФОРМА (загрязненного). Реакция ГИПОХЛОРИТА НАТРИЯ и АЦЕТОНА. Опыты по химииСкачать  Окислительно-восстановительные реакции с участием органических веществ. Лекция 2Скачать  Реально ли так быстро работает хлороформ? #shorts #химия #ЕГЭ2023Скачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Получение хлороформа часть 1Скачать  25. Схема реакции и химическое уравнениеСкачать  Окислительно восстановительные реакции | Химия 8 класс #52 | ИнфоурокСкачать  Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Окислительно восстановительные реакции. Электролиз | Химия 11 класс #19 | ИнфоурокСкачать  метод полуреакций для составления ОВРСкачать  Окислительно-восстановительные реакции в органической химии. Метод электронного баланса.Скачать  Окислительно-восстановительные реакции с участием органических веществ. Лекция 1Скачать  Реакция термокольцепреципитации (реакция Асколи)Скачать  Окислительно-восстановительные реакции в щелочноной среде. Упрощенный подход.Скачать  Окислительно-восстановительные реакции. 3 часть. 9 класс.Скачать  Лабораторный опыт № 3. Качественная реакция на сульфат-ионы.Скачать  Окислительно-восстановительные реакции. Метод электронного баланса. ЕГЭСкачать  Лабораторная работа №4. Окислительно-восстановительные реакции. Основные окислители и восстановителиСкачать  | |