Химическим равновесием называется такое состояние обратимой химической реакции
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия:
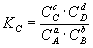
где Ci – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли Xi компонентов:
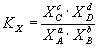
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления Pi компонентов:
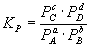
Константа равновесия связана с rG o химической реакции:
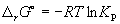
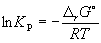
Изменение rG или rF в химической реакции при заданных (не обязательно равновесных) парциальных давлениях Pi или концентрациях Ci компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа):
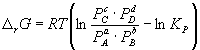
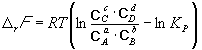
Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа)
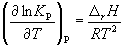
и изохоры химической реакции (изохоры Вант-Гоффа)
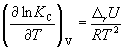
Интегрирование уравнения (9.9) в предположении, что rH реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
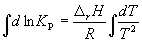
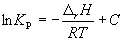
где C – константа интегрирования. Таким образом, зависимость ln KP от 1/Т должна быть линейной, а наклон прямой равен – rH /R.
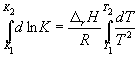
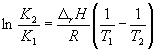
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать rH реакции. Соответственно, зная rH реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
Пример 9-1. Рассчитать константу равновесия для реакции
при 500 K. fG o для CO(г) и CH3OH(г) при 500 К равны –155.41 кДж . моль –1 и –134.20 кДж . моль –1 соответственно.
Решение. G o реакции:
rG o = fG o (CH3OH) – fG o (CO) = –134.20 – (–155.41) = 21.21 кДж . моль –1 .
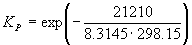
Пример 9-2. Константа равновесия реакции
равна KP = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N2 и H2, чтобы 10% N2 превратилось в NH3? Газы считать идеальными.
Решение. Пусть прореагировало моль N2. Тогда
| N2(г) | + | 3H2(г) | = | 2NH3(г) |
| Исходное количество | 1 | 1 | ||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2 ) | |
| Равновесная мольная доля: | 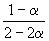 | 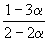 | 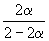 |
Следовательно, KX = 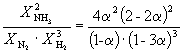
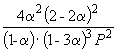
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 =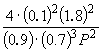
Пример 9-3. Константа равновесия реакции
при 500 K равна KP = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H2 и 1 моль инертного газа (N2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H2(г) | = | CH3OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N2 = 4–2 моль | ||||
| Равновесная мольная доля | 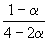 | 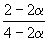 | 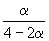 | ||
Следовательно, KX = 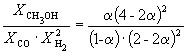
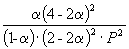
Таким образом, 6.09 10 –3 = 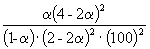
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: 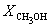
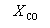
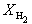
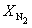
Пример 9-4. Для реакции
при 298 К KP = 6.0 10 5 , а fH o (NH3) = –46.1 кДж . моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
rH o = 2 fH o (NH3) = –92.2 кДж . моль –1 .
Согласно уравнению (9.14), 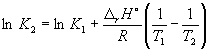
= ln (6.0 10 5 ) + 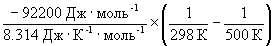
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
Указание: во всех задачах считать газы идеальными.
- При 1273 К и общем давлении 30 атм в равновесной смеси
содержится 17% (по объему) CO2. Сколько процентов CO2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO2?
При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
Константа равновесия реакции
при 500 o C равна Kp = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H2O, нагрели до этой температуры. Рассчитать мольную долю H2O в равновесной смеси.
Константа равновесия реакции
при 25 o C равна Kp = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N2O4 при этой температуре.
Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I2, нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
при 250 o C rG o = –2508 Дж . моль –1 . При каком общем давлении степень превращения PCl5 в PCl3 и Cl2 при 250 o C составит 30%?
константа равновесия KP = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
Сосуд объемом 1 л, содержащий 0.341 моль PCl5 и 0.233 моль N2, нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
Константа равновесия реакции
при 500 K равна KP = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H2 взяты в соотношении 1: 2.
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T; б) повышение P; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H2 при P = const?
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать rG o для реакции. При каком общем давлении парциальное давление Cl2 будет равно 0.10 бар?
Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H2 и 1 части N2, чтобы получить равновесную смесь, содержащую 10% NH3 по объему при 400 o C. Константа равновесия для реакции
при 400 o C равна K = 1.60 10 –4 .
При 250 o C и общем давлении 1 атм PCl5 диссоциирован на 80% по реакции
Чему будет равна степень диссоциации PCl5, если в систему добавить N2, чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
При 2000 o C для реакции
Kp = 2.5 10 –3 . В равновесной смеси N2, O2, NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N2 и 16% O2. Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К.
При 420 o C давление газов равно 5.16 10 4 Па, а при 450 o C 10.8 10 4 Па. Рассчитать константы равновесия при этих температурах и энтальпию диссоциации на моль HgO.
получены следующие данные по зависимости константы равновесия от температуры:
3.98 10 –4
1.41 10 –2
1.86 10 –1
Определить стандартную энтальпию реакции в этом температурном интервале.
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Рассчитать rG o , rH o и rS o реакции при 400 К.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
- Химическое равновесие. Принцип Ле Шателье
- Понятие химического равновесия
- Признаки химического равновесия
- Принцип Ле Шателье
- Влияние температуры на химическое равновесие
- Влияние давления на химическое равновесие
- Влияние концентрации на химическое равновесие
- Константа химического равновесия
- Примеры решения задач
- Задачи для самостоятельного решения
- ХИМИЧЕСКОЕ РАВНОВЕСИЕ. КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ
- Определение констант равновесия химических реакций и расчет химического равновесия
- Федеральное агентство по образованию
- ГОУ ВПО «Уральский государственный технический университет — УПИ»
- Решение
- 📽️ Видео
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать

Химическое равновесие. Принцип Ле Шателье
Материалы портала onx.distant.ru
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 2ч. 10 класс.Скачать

Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
Видео:Задача химическое равновесие. РАВНОВЕСНЫЕ КОНЦЕНТРАЦИИ и Кр.Скачать

Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 4ч. 10 класс.Скачать

Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Константа химического равновесия
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Видео:Задания на константу равновесия по учебнику ЕреминаСкачать
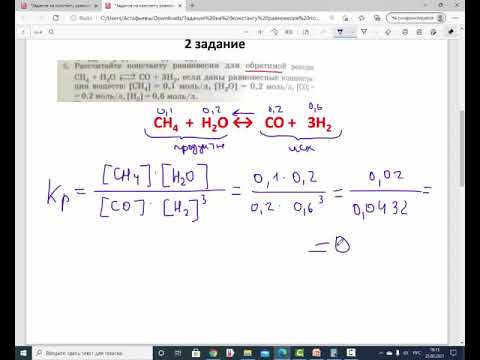
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
Вещество
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
ΔG298 о = 2·(- 16,71) кДж = -33,42·10 3 Дж.
lnK = 33,42·10 3 /(8,314× 298) = 13,489. K = 7,21× 10 5 .
Задача 3. Определите равновесную концентрацию HI в системе
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔН о Т » ΔН о 298, а ΔS о T » ΔS о 298.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
ΔН о 298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 10 3 Дж;
ΔS о 298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Видео:Химическое равновесие. Закон действующих масс.Скачать

Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
равна 3,4·10 -5 . Вычислите Δ G о 500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

ХИМИЧЕСКОЕ РАВНОВЕСИЕ. КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ
Пример 1. Вычислить изменение энергии Гиббса ΔG в реакции димеризации диоксида азота 2NО2(г)= N2O4(г) при стандартной температуре 298 К, 273 К и 373 К. Сделать вывод о направлении процесса. Определить константы равновесия реакции димеризации диоксида азота при выше указанных температурах. Определить температуру, при которой Δ G = 0. Сделайте вывод о направлении этой реакции выше и ниже этой температуры. Термодинамические характеристики компонентов:
В-во кДж/моль Дж/моль*K
Решение. Для обратимого процесса:
где PA, PB, PC, PD — равновесные парциальные давления газообразных компонентов А,В,С,D a, b, c, d — стехиометрические коэффициенты.
где CA, CB, CC, CD — равновесные концентрации веществ А,В,С,D a, b, c, d — стехиометрические коэффициенты.
По формуле (1.4.1) для системы 2NO2⇄ N2O4 имеем
Kр =PN2O4/P 2 NO2
При стандартной температуре 298 K изменение энтальпии ( ΔH o реакции) определим по формуле (1.2.2)
Изменение энтропии (1.3.5)
ΔS o реакции = S°298 N2O4 — 2S°298 NO2 =303,8-2* ( 240 ,2 )=-176 Дж/моль*К
Пользуясь принципом Ле-Шателье, который говорит о том, что при изменении условий, при которых обратимая реакция находится в состоянии равновесия, равновесие сместится в сторонy процесса ослабевающего изменения, предскажем направление смещения равновесия. Значение ΔΗ о отрицательно, следовательно реакция образования экзотермическая (идет c выделением тепла) и при понижении температуры равновесие должно смещаться вправо, при повышении температуры — влево. Кроме того, по фopмyлe (1.3.6), зная, что ΔH 0 характеризует невозможность самопроизвольного процесса (см. пример 4 разд. 1.3). Следовательно, в нашем случае при понижении температуры будет предпочтительнее образование N2О4 (равновесие смещается вправо), а при увеличении температуры предпочтительнее образование NO2 (равновесие смещается влево). Качественные выводы подтвердим расчетами
Значение энергии Гиббса для заданных температур рассчитаем по формуле (1.3.7):
ΔG o 298=ΔH o -TΔS o =-57400-298*(-176)=-4952Дж.,
ΔG o 373=-57400-373*(-176)= 7129 Дж.
Отрицательное значение ΔG o 298 говорит о смещении равновесия реакции вправо, а более высокое отрицательное значение ΔG o 273 свидетельствует о том, что при снижении температуры от (298 до 273 К) равновесие смещается вправо.
Положительное значение ΔG o 373 указывает на изменение направления самопроизвольного процесса. При этой температуре предпочтительнее становится обратная реакция (смещение равновесия влево).
Константы равновесия Кp и энергию Гиббса ΔG o связывает формула
где Кp — константа равновесия процесса; R — газовая постоянная; T — абсолютная температура. По формуле (1.4.3) имеем:
значение К298 и K273 > 1 показывает на смещение равновесия вправо (сравни с (1.4.1)) и тем больше, чем выше значение константы равновесия. K373 o реакции =0 отвечает константа равновесия,
Рассчитаем температуру Т , соответствующую этой константе по формуле (1.3.7):
ΔG°=ΔΗ°-TΔS o ; O=ΔH o -TΔS o ;
Вывод. При температуре 326,19 K прямая и обратная реакции протекают c одинаковой вероятностью, Kр=1. С понижением температуры равновесие будет смещаться вправо с повышением влево.
Пример 2. Константа равновесия Кр реакции синтеза NH3 по реакции N2+3H2==2NH3 при 623 K равна 2,32*10 -13 . Вычислить Кс при той же температуре.
Решение. Связь Кр и Кс осуществляется по формуле
Δn= n2— n1 =2-4= -2, где n1и n2 количество молей peaгентов и продуктов. Следовательно,
Ответ. К = 0,624*10 -5 .
Пример 2. Упругость диссоциации карбоната кальция при 1154 К равна 80380 Па, а при 1164 K — 91177 Па. Рассчитать, при какой температуре упругость диссоциации карбоната кальция будет равна 101325 Па.
Kp=PCO2
Следовательно, при каждой температуре (Т1 — 1154 K; Τ =1164 К* Τ = X) константы равновесия будут соответствовать давлению:
Зависимость константы равновесия от температуры показывает уравнение Аррениуса
где Кp — константа равновесия; Τ — температура, К; ΔΗ — тепловой эффект реакции; R — газовая постоянная.
Определим сначала ΔΗ (по 1.4.6)
Далее определяем T3
T3=1172 K
Ответ. При Т=1172К упругость диссоциации карбоната кальция будет равна 101325 Па.
56. Константа диссоциации уксусной кислоты при 298 К равна 1,75*10 -5 . Чему равно изменение энергии Гиббса диссоциации уксусной кислоты?
57. Найти значение энергии Гиббса (ΔG o 298) и константы равновесия K298 для реакции BaSО4(кр) → Ba 2+ (р) + SО 2- 4(p).
Для расчета использовать следующие данные:
Вещество S о 298 Дж/моль*К ΔH o 298кДж/моль 2^ 2^
58. Найти константу равновесия при 473 К для реакции гидратации этилена
С2Н4(г) + H2O(г)=С2Н5ОН(г).
Свойства реагентов взять в табл. 3. Зависимостью ΔS и ΔH от температуры пренебречь.
59. Считая, что ΔH o 298 и ΔS о 298реакции 4HCl+O2 ⇄ 2Н2О + 2Сl2 не зависят от температуры, найти температуру, при которой
Кр =1, а ΔG o = О.
60. Пользуясь табличными данными, вычислить константы равновесия следующих реакций при 298 К и при 1000 К:
c) N2 + 3H2 ⇄ 2NH3.
Изменениями ΔH o и S о от температуры пренебречь.
61. Для некоторой самопроизвольно протекающей реакции Δ S o следующих процессов:
63. В каком из следующих случаев реакция возможна при любых температурах: а) ΔН° 0; б) Δ Н° 0, ΔS°> 0 ?
64. В каком из следующих случаев реакция неосуществима при любых температурах: а) ΔН°> 0, ΔS°> 0; б) Δ Н°>0, ΔS° |TΔS°|; б)| ΔН°| > |TΔS°| ?
66. Какими воздействиями на систему можно сместить равновесие систем:
67. В каком направлении произойдет смещение равновесия при повышении температуры в системах:
2) 2СО ⇄ СО2 + С; ΔН°=-171 кДж;
68. В каком направлении сместится равновесие при повышении давления в системах:
69. Как повлияет на равновесие следующих реакций:
а) повышение температуры,
б) повышение давления?
70. Используя справочные данные, найти приближенное значение температуры, при которой константа равновесия реакции образования водяного газа
С(гр) + Н2О(г) ⇄ СО(г) + Н2(г)
равна 1. Зависимостью ΔH o и S о от температуры пренебречь.
71. Константа равновесия Кр реакции СО+Сl2 ⇄ СОCl2 при 600 о С равна 1,67*10 -6 . Вычислять Кс реакции при данной температуре.
72. Упругость диссоциации карбоната магния при 1000 К равна 42189 Па, а при 1020 К — 80313 Па. Определить тепловой эффект реакции MgCО3 ⇄ МgО+СO2 и температуру, при которой упругость диссоциации карбоната магния станет равной 1 Па.
73. Для реакции S02+1/2О2⇄SO3 константа равновесия Кр при 900 К равна 2,058·10 -2 . Вычислить Кс для данной реакции при указанной температуре.
74. Определить константу равновесия KT2 при T2=1069 K для реакции 2СО ⇄ С + О2 , если при T1 = 1000 K KT1=8,1*10 -8 , а ΔH=-109,5 кДж/моль.
75. Для реакции CO(г) + H2O(г) ⇄ СО2(г) + Н2(г) определить Кр при 398 К, если при 298 К константа равновесия этой реакции равна 1*10 5 . Для температуры 298 К рассчитайте изменение энергии Гиббса (ΔG°).
Дата добавления: 2017-08-01 ; просмотров: 10584 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Условия смещения химического равновесия. 9 класс.Скачать

Определение констант равновесия химических реакций и расчет химического равновесия
Видео:Химическое равновесие / Решение задач на химическое равновесиеСкачать

Федеральное агентство по образованию
Видео:Химическое равновесие. Константа равновесия. Обратимость реакций.Скачать

ГОУ ВПО «Уральский государственный технический университет — УПИ»
Определение констант равновесия химических
реакций и расчет химического равновесия
Методическое пособие для лабораторной работы № 4
для студентов дневной формы обучения
Научный редактор, к. х.н., доцент
Определение констант равновесия химических реакций и расчет химического равновесия: методические указания для лабораторной работы № 4 по курсу физической химии / сост. — Екатеринбург: ГОУ ВПО УГТУ-УПИ, 20с.
Методические указания предназначены для дополнительной углубленной проработки материала по химическому равновесию в рамках расчетно-аналитической лабораторной работы. Содержат 15 вариантов индивидуальных заданий, что способствует выполнению поставленной цели.
Библиогр.: 5 назв. Рис. Табл.
© ГОУ ВПО «Уральский государственный
технический университет – УПИ», 2007
Данная работа, хотя и проводится в рамках лабораторного практикума, относится к расчетно-аналитическим и заключается в освоении теоретического материала и решении ряда задач по теме курса физической химии «Химическое равновесие».
Необходимость ее проведения вызвана сложностью данной темы с одной стороны и недостаточным количеством учебного времени отводимого на ее проработку с другой.
Основная часть темы «Химическое равновесие»: вывод закона химического равновесия, рассмотрение уравнения изобары и изотермы химической реакции и т. д. излагается в лекциях и изучается на практических занятиях (поэтому в данной работе этот материал не приведен). В этом пособии подробно рассмотрен раздел темы, касающийся экспериментального определения констант равновесия и определения равновесного состава системы с протекающей в ней химической реакцией.
Итак, выполнение студентами данной работы позволит решить следующие задачи:
1) познакомиться с методами определения и вычисления констант равновесия химических реакций;
2) научиться рассчитывать равновесный состав смеси, исходя из самых различных экспериментальных данных.
1. ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ О СПОСОБАХ
ОПРЕДЕЛЕНИЯ КОНСТАНТ РАВНОВЕСИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Остановимся кратко на основных понятиях, используемых далее. Константой равновесия химической реакции называется величина

где 
Уравнение (1) – определительное уравнение для константы равновесия химической реакции. Нужно отметить, что константа равновесия химической реакции является безразмерной величиной.
Закон химического равновесия записывается следующим образом

где 



Экспериментальное определение констант равновесия – достаточно трудная задача. Прежде всего, необходимо быть уверенным, что при данной температуре равновесие достигнуто, т. е. состав реакционной смеси соответствует равновесному состоянию – состоянию с минимумом энергии Гиббса, нулевым сродством реакции и равенством скоростей прямой и обратной реакций. При равновесии будут постоянными давление, температура и состав реакционной смеси.
На первый взгляд кажется, что состав равновесной смеси можно определить, используя методы количественного анализа с характерными химическими реакциями. Однако введение постороннего реагента, который связывает один из компонентов химического процесса, смещает (т. е. изменяет) состояние равновесия системы. Этот метод можно использовать только в случае, если скорость реакции достаточно мала. Именно поэтому очень часто при изучении равновесия используют также различные физические методы для определения состава системы.
1.1 Химические методы
Различают статические химические методы и динамические химические методы. Рассмотрим конкретные примеры, приведенные в [1].
1.1.1 Статические методы.
Статические методы заключаются в том, что реакционная смесь помещается в реактор при постоянной температуре и затем по достижении равновесия определяется состав системы. Исследуемая реакция должна быть достаточно медленной, чтобы введение постороннего реактива практически не нарушало состояния равновесия. Чтобы замедлить процесс, можно достаточно быстро охладить реакционную колбу. Классическим примером подобного исследования является реакция между йодом и водородом
H2(г) + I2(г) = 2HI (г) (3)
Лемойн помещал в стеклянные баллоны либо смесь йода с водородом, либо йодистый водород. При 200 оС реакция практически не идет; при 265 оС продолжительность установления равновесия составляет несколько месяцев; при 350 оС равновесие устанавливается в течение нескольких дней; при 440 оС — в течение нескольких часов. В этой связи для исследования этого процесса был выбран температурный интервал 300 – 400 оС. Анализ системы проводился следующим образом. Реакционный баллон быстро охлаждался опусканием в воду, затем открывался кран и йодистый водород растворялся в воде. Титрованием определялось количество йодоводородной кислоты. При каждой температуре эксперимент проводился до тех пор, пока концентрация не достигнет постоянного значения, что свидетельствует об установлении в системе химического равновесия.
1.1.2 Динамические методы.
Динамические методы состоят в том, что газовая смесь непрерывно циркулирует, затем ее быстро охлаждают для последующего анализа. Эти методы наиболее хорошо применимы для достаточно быстрых реакций. Ускоряют реакции, как правило, либо осуществляя их при повышенных температурах, либо вводя в систему катализатор. Динамический метод применялся, в частности, при анализе следующих газовых реакций:
2H2 + O2 ⇄ 2H2O. (4)
2CO + O2 ⇄ 2CO2. (5)
1.2 Физические методы
Эти методы основаны, главным образом, на измерение давления или плотности массы реакционной смеси, хотя можно использовать и другие свойства системы.
1.2.1 Измерение давления
Каждая реакция, которая сопровождается изменением числа молей газообразных реагентов, сопровождается изменением давления при постоянном объеме. Если газы близки к идеальным, то давление прямо пропорционально общему числу молей газообразных реагентов.
В качестве иллюстрации рассмотрим следующую газовую реакцию, записанную из расчета на одну молекулу исходного вещества



в начальный момент 
при равновесии 
где 
Общее число молей компонентов в момент равновесия

где 
Обозначим давление в начальный момент, когда диссоциации еще нет 


Между этими давлениями имеются соотношения:




Константа равновесия, выраженная в p-шкале, будет иметь вид

Следовательно, измерив равновесное давление, по формуле (13) можно определить степень диссоциации, а затем по формуле (14) рассчитать и константу равновесия.
1.2.2 Измерение плотности массы
Каждая реакция, которая сопровождается изменением числа молей газообразных участников процесса, характеризуется изменением плотности массы при постоянном давлении.
Например, для реакции (8) справедливо

где 



1.2.3 Прямое измерение парциального давления
Наиболее прямым способом определения константы равновесия химической реакции является измерение парциальных давлений каждого участника процесса. В общем случае этот метод весьма сложно применить на практике, чаще всего его используют только при анализе газовых смесей, содержащих водород. В этом случае используют свойство металлов платиновой группы быть проницаемыми для водорода при высоких температурах. Предварительно нагретую газовую смесь пропускают при постоянной температуре через баллон 1, который содержит пустой иридиевый резервуар 2, соединенный с манометром 3 (рис.1). Водород является единственным газом, способным проходить через стенки иридиевого резервуара.
Таким образом, остается измерить общее давление газовой смеси и парциальное давление водорода, чтобы вычислить константу равновесия реакции. Этот метод позволил Ловенштейну и Вартенбергу (1906) изучить диссоциацию воды, HCl, HBr, HI и H2S, а также реакцию типа:


1.2.4 Оптические методы
Существуют методы исследования равновесия, основанные на измерении адсорбции, которые особенно эффективны в случае окрашенных газов. Можно также определять состав газовой бинарной смеси, измеряя показатель преломления (рефрактометрически). Например, Чадрон (1921) изучил восстановление оксидов металлов оксидом углерода, измеряя рефрактометрически состав газовой смеси оксида и диоксида углерода.
1.2.5 Измерение теплопроводности
Этот метод был использован при изучении реакций диссоциации в газовой фазе, например
Предположим, что смесь N2O4 и NO2 помещена в сосуд, правая стенка которого имеет температуру Т2, а левая Т1, причем Т2>Т1 (рис.2). Диссоциация N2O4 в большей степени будет в той части сосуда, которая имеет более высокую температуру. Следовательно, концентрация NO2 в правой части сосуда будет больше, чем в левой, и будет наблюдаться диффузия молекул NO2 справа налево и N2O4 слева направо. Однако, достигая правой части реакционного сосуда, молекулы N2O4 вновь диссоциируют с поглощением энергии в форме теплоты, а молекулы NO2, достигая левой части сосуда, димеризуются с выделением энергии в форме теплоты. То есть возникает суперпозиция обычной теплопроводности и теплопроводности, связанной с протеканием реакции диссоциации. Эта задача решается количественно и позволяет определить состав равновесной смеси.
1.2.6 Измерение электродвижущей силы (ЭДС) гальванического элемента
Измерение ЭДС гальванических элементов является простым и точным методом вычисления термодинамических функций химических реакций. Необходимо только 1) составить такой гальванический элемент, чтобы итоговая реакция в нем совпадала бы с исследуемой, константу равновесия которой нужно определить; 2) измерить ЭДС гальванического элемента в термодинамически равновесном процессе. Для этого нужно, чтобы соответствующий токообразующий процесс совершался бесконечно медленно, то есть, чтобы элемент работал при бесконечно малой силе тока, именно поэтому для измерения ЭДС гальванического элемента используется компенсационный метод, который основан на том, чтобы исследуемый гальванический элемент включался последовательно против внешней разности потенциалов, и последняя подбиралась таким образом, чтобы ток в цепи отсутствовал. Величина ЭДС, измеренная компенсационным методом, соответствует термодинамически равновесному процессу, протекающему в элементе и полезная работа процесса максимальная и равна убыли энергии Гиббса


при p, T=const, где F –число Фарадея = 96500 Кл/моль, n – наименьшее общее кратное числа электронов, участвующих в электродных реакциях, Ео – стандартная ЭДС, В.
Величина константы равновесия найдется из соотношения (21)

2. ПРИМЕР ЛАБОРАТОРНОЙ РАБОТЫ ПО ОПРЕДЕЛЕИНЮ ВЕЛИЧИНЫ КОНСТАНТЫ РАВНОВЕСИЯ
В практикумах по физической химии часто встречается лабораторная работа, касающаяся изучения реакции диссоциации карбонатов металлов. Приведем краткое содержание подобной работы.
Цель работы – определение константы равновесия и расчет основных термодинамических величин реакции разложения карбоната.
Карбонат кальция 

при этом образуется газообразный оксид углерода (IV), твердый оксид кальция и остается какая-то часть непродиссоциированного карбоната кальция.
Константа равновесия реакции (22) запишется как:

где 
Согласно [2] активность идеального газа (а значит и активность углекислого газа, если принять его за идеальный газ) может быть найдена как 



Если давление измерять в атмосферах, то 


Равновесное давление двуокиси углерода 
То есть константа равновесия реакции диссоциации карбоната кальция будет численно равна упругости диссоциации карбоната, если последняя выражена в атмосферах. Таким образом, определив экспериментально упругость диссоциации карбоната кальция, можно определить величину константы равновесия данной реакции.
Для определения упругости диссоциации карбоната кальция используется статический метод. Суть его заключается в непосредственном измерении при данной температуре давления углекислого газа в установке.
Аппаратура. Основными узлами установки являются: реакционный сосуд (1), выполненный из жаропрочного материала и помещенный в электропечь (2); ртутный манометр (3), герметично связанный с реакционным сосудом и через кран (4) с ручным вакуумным насосом (5). Температура в печи поддерживается при помощи регулятора (6), контроль температуры ведется при помощи термопары (7) и вольтметра (8). В реакционный сосуд помещено некоторое количество исследуемого порошкообразного вещества (9) (карбонаты металлов).

Рис.3. Установка для определения упругости диссоциации
карбонатов металлов [3].
3. ОПРЕДЕЛЕНИЕ КОНСТАНТ РАВНОВЕСИЯ
БЕЗ ПРОВЕДЕНИЯ ЭКСПЕРИМЕНТА
3.1 Вычисление константы равновесия химической реакции по
величине стандартной мольной функции Гиббса реакции
Этот метод вообще не предусматривает эксперимента. Если известны стандартные мольные энтальпия и энтропия реакции при данной температуре, то по соответствующим уравнениям можно вычислить стандартную мольную функцию Гиббса исследуемой реакции при искомой температуре, а через нее величину константы равновесия.

Если значения стандартных мольных энтропии и энтальпии при данной температуре неизвестны, то можно воспользоваться методом Темкина и Шварцмана, то есть по величине стандартных мольных энтальпии и энтропии при температуре 298 К и значениям коэффициентов температурной зависимости мольной теплоемкости реакции, рассчитать стандартную мольную энергию Гиббса реакции при любой температуре.

где
3.2 Метод комбинирования равновесий
Этот метод используется в практической химической термодинамике. Например, экспериментально при одной и той же температуре были найдены константы равновесия двух реакций
1. СH3OH(г) + CO ⇄ HCOOCH3(г) 
2. H2 + 0,5 HCOOCH3(г) ⇄ CH3OH(г) 
Константу равновесия реакции синтеза метанола
3. 2H2 + CO ⇄ CH3OH(г) 
можно найти, комбинируя константы 


3.3 Вычисление константы равновесия химической реакции при некоторой температуре по известным значениям констант равновесия этой же реакции при двух других температурах
Этот способ вычисления основан на решении уравнения изобары химической реакции (изобары Вант-Гоффа)

где 



По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать стандартную мольную энтальпию реакции, а, зная ее и константу равновесия при одной температуре, можно рассчитать константу равновесия при любой другой температуре.
4. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Найти константу равновесия синтеза аммиака y N2 + H2 ⇄ NH3 если равновесная мольная доля аммиака равна 0,4 при 1 атм и 600К. Исходная смесь — стехиометрическая, продукта в исходной смеси нет.
Дано: Реакция y N2 + H2 ⇄ NH3, 1 атм, 600 К. 




Из условия задачи нам известно стехиометрическое уравнение, а также то, что в начальный момент времени число молей азота равно стехиометрическому, то есть 0,5 моль (
Запишем закон химического равновесия для данной химической реакции
Запишем реакцию, под символами элементов укажем начальные и равновесные количества молей веществ


Общее число молей всех участников реакции в системе в момент равновесия

Выразим равновесную мольную долю аммиака через глубину реакции, а затем, наоборот, через известную мольную долю аммиака (обозначим ее просто N) выразим равновесные мольные доли всех участников



Решение прямой задачи химического равновесия – это вычисление равновесного состава системы, в которой протекает данная реакция (несколько реакций). Очевидно, что основой решения является закон химического равновесия. Необходимо лишь выразить все входящие в этот закон переменные через какую-либо одну: например через глубину химической реакции, через степень диссоциации или через какую-либо равновесную мольную долю. Выбирать, какую именно переменную удобно использовать, лучше исходя из конкретных условий задачи.
Константа равновесия газовой реакции синтеза иодистого водорода
H2 + I2 ⇄ 2HI при температуре 600 К и выражении давления в атмосферах, равна Kr = 45,7 . Найти равновесную глубину этой реакции и равновесный выход продукта при данной температуре и давлении 1 атм, если в начальный момент времени количества исходных веществ соответствуют стехиометрическим, а продуктов реакции в начальный момент нет.
Дано: Возможна реакция: H2+I2= 2HI. 600 К, 1 атм. Kr = 45,7 . 




Видео:ФИЗХА 10 класс | Химическое равновесие | Олимпиадные задачи по химииСкачать

Решение
Запишем саму реакцию, а под символами элементов числа молей каждого участника в начальный момент и в момент установившегося равновесия по формуле (4)


Общее число молей всех участников реакции в момент равновесия равно

Равновесные мольные доли и парциальные давления всех участников реакции, выразим через единую переменную – глубину химической реакции


Закон действующих масс или закон химического равновесия

Решение этого уравнения позволит определить равновесную глубину химической реакции и равновесную мольную долю йодистого водорода

Условие ее отличается от задачи 2 только тем, что начальные количества молей водорода и иода равны, соответственно 3 и 2 моль. Рассчитать мольный состав равновесной смеси.
Дано: Возможна реакция: H2+I2= 2HI. 600 К, 1 атм. Kr = 45,7 .





Объектом изучения является такая же реакция, как и в задаче 2. Различие лишь в начальном составе смеси. Решение будет похожим на решение предыдущей задачи.


Общее число молей всех участников реакции в момент равновесия равно

Равновесные мольные доли и парциальные давления всех участников реакции, выраженные через единую переменную – глубину химической реакции
Подстановка парциальных давлений в закон химического равновесия дает:

Одним из способов решения таких уравнений является графический. Мы сами, исходя из соображений о возможных величинах глубины химической реакции задаем несколько значений 








Зная глубину химической реакции, нетрудно выразить и необходимые равновесные мольные доли. 
Для проведения работы нужно выполнить следующие задания
1. Описать способ экспериментального определения упругости двуокиси углерода при изучении реакции диссоциации СaCO3⇄CaO+CO2
(варианты 1 – 15, табл.3);
2. Записать закон химического равновесия для изучаемой реакции; определить значения констант равновесия реакции диссоциации карбоната кальция по экспериментальным данным (табл.3) при разных температурахть задачи из раздела В (согласно указанному варианту)ить задания 1-3, п;
3. Записать определительное выражение для константы равновесия и вычислить теоретически константу равновесия изучаемой реакции при последней указанной в таблице температуре.
1. Подготовить ответ на вопрос 1 (варианты 1-15, табл. 4)
2. Решить задачи 2 и 3.
Справочные данные, необходимые для выполнения работы
Величина 
📽️ Видео
Гетерогенные равновесияСкачать

Химическое равновесие. 10 класс.Скачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Задача на Константу равновесия (Кр) с дискриминантом. Химия. Олимпиада + ВУЗСкачать

Влияние концентрации на скорость химических реакций. 10 класс.Скачать









