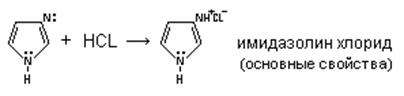
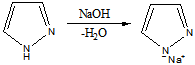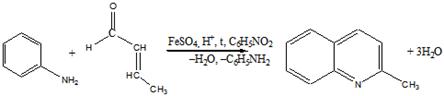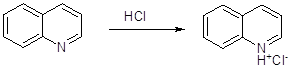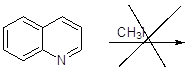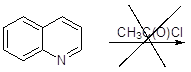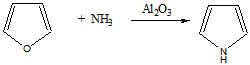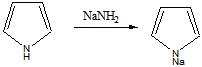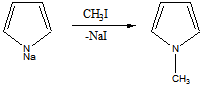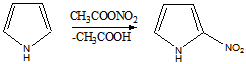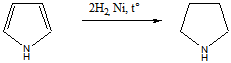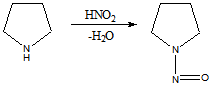Таким образом,имидазол представляет собой амфотерное соединение. В такого типа соединениях атом водорода становится подвижным и в результате могут образовываться таутомерные формы прототропного характера.
Поэтому для приведенных выше соединений используют обозначения
4-/5/-метилимидазол, это значит, что метильная группа в одном таутомере занимает положение 4, а в другом 5. Кроме того, за счет водородных связей в данных соединениях могут образовываться ассоциаты.

Ароматические свойства гетероциклов проявляются и в способности этих соединений вступать предпочтительно в реакции электрофильного замещения. При этом у пятичленных гетероциклов по сравнению с шестичленными данное свойство проявляется в большей степени. Объясняется такой факт тем, что перераспределение электронной плотности в пятичленных гетероциклах происходит с повышением нуклеофильности атомов углерода и особенно в положении 2 или 5. Если же заняты эти места, то заместитель направляется к 3-му или 4-му атому углерода. При этом более активными в данной реакции являются пиррол и фуран. Тиофен же менее реакционноспособен. Имидазол и пиразол также вступают в реакции электрофильного замещения, но менее активно по сравнению с моногетероциклами. Заместители атакуют в пиразоле и имидазоле положение 4.
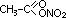
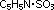
Интересно ведет себя в данных реакциях тиофен, занимая промежуточное положение по реакционной способности между бензолом и фураном. Ацидофобность он не проявляет, поэтому нитруется азотной кислотой, а сульфируется концентрированной серной кислотой, а также комплексом ангидрида с пиридином.
Пиразол и имидазол более устойчивы к действию кислот, поэтому они нитруются и сульфируются соответствующими кислотами в положение 4 или 5.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

На примере пиразола покажите строение пиррольного и пиридинового атомов азота. С помощью химических реакций докажите амфотерный характер пиразола
2 На примере пиразола покажите строение пиррольного и пиридинового атомов азота. С помощью химических реакций докажите амфотерный характер пиразола
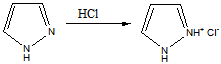
Атом азота в положении 1 (пиррольный атом) sp3-гибридизован, имеет неподеленную электронную пару и способен участвовать в образовании сопряженной ароматической системы, вследствие чего на этом атоме, при отрыве протона, возникающий отрицательный заряд распределяется по всей системе. Пиридиновый атом азота в положении 2 имеет sp2-гибридизацию и неподеленную электронную пару, которая не участвует в образовании ароматической системы (ее образует двойная связь), что обуславливает его основность.
Реакция с основанием:
Реакция с кислотой:
3 Получите синтезом Скраупа хинолин. Покажите, какое соединение получится, если синтез Скраупа проводить не с акриловым альдегидом, а с бутен-2-алем. Напишите для хинолина схемы реакций с НС1, СН3I, СН3С(O)Сl, полученные продукты назовите
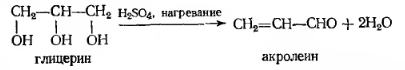
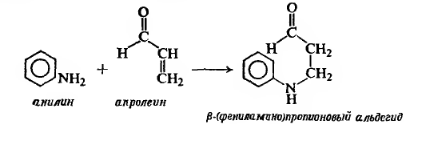
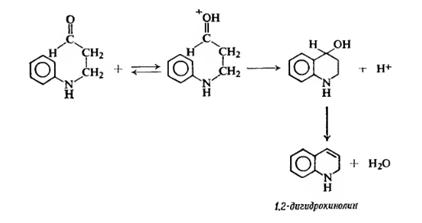
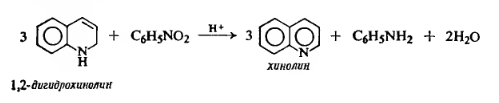
Синтез Скраупа представлен ниже:
Аналогичная реакция, только с участием бутен-2-аля:
Реакции хинолина с:
Продукт: N-хлорид хинолина
Реакции не происходит
Реакции не происходит
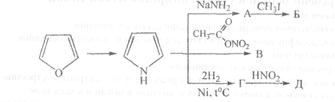
4 Осуществите превращения, все продукты назовите
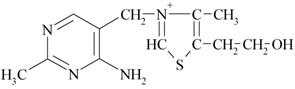
5 Напишите структурные формулу тиамина (витамина В1), назовите гетероциклические системы, входящие в его структуру. Укажите значение тиамина
Структурная формула тиамина:
В его структуру входят такие гетероциклические системы, как пиримидил и тиазол.
В природе тиамин синтезируется растениями и многими микроорганизмами. Животные и человек не могут синтезировать тиамин и получают его вместе с пищей. В тиамине нуждаются все животные за исключением жвачных.
Всасываясь из кишечника, тиамин фосфорилируется и превращается в тиаминпирофосфат.
Тиаминпирофосфат (ТПФ) — активная форма тиамина — является коферментом пируватдекабоксилазного и α-кетоглутаратдекарбоксилазного комплексов, а также транскетолазы. Первые два фермента участвуют в метаболизме углеводов, транскетолаза функционирует в пентозофосфатном пути, участвуя в переносе гликоальдегидного радикала между кето- и альдосахарами. ТПФ синтезируется ферментом тиаминпирофосфокиназой, главным образом в печени и в ткани мозга. Реакция требует присутствия свободного тиамина, ионов Mg2+ и АТФ. Также ТПФ выступает коферментом дегидрогеназы γ-оксиглутаровой кислоты и пируватдекарбоксилазы клеток дрожжей.
Другими производными тиамина являются:
Тиаминтрифосфат, обнаружен у бактерий, грибов, растений и животных, у E. coli играет роль сигнальной молекулы при ответе на аминокислотное голодание.
Аденозинтиаминдифосфат — накапливается у E.coli в результате углеродного голодания.
Аденозинтиаминтрифосфат — присутствует в небольших количествах в печени позвоночных, функция его неизвестна.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

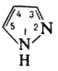
Строение пиразола и имидазола
Пиразол и имидазол относятся к ароматическим соединениям. Атом азота, имеющий протон, предоставляет свою Неподеленную электронную плотность(НПЭ) в ароматический секстет. Этот атом азота называетсяпиррольным. Второй атом азота, его называют пиридиновым, отдает только один р-ē, его НПЭ расположена на sp 2 -гибридных орбиталях и обуславливает осно́вные свойства обоих гетероциклов.
Прототропная таутомерия производных пиразола и имидазола
Нумерация в циклах производится от пиррольного атома азота.
Реакционная способность
1. Кислотно-осно́вные свойства
Имидазол и пиразол являются амфотерными соединениями, проявляя осно́вные и NH-кислотные свойства. Из-за взаимного акцепторного влияния атомов азота, расположенных рядом, основность пиразола на четыре порядка меньше основности имидазола.
2. Реакции электрофильного замещения, SEAr
Реакции электрофильного замещения, SEAr протекают с трудом в жестких условиях Реакции идут преимущественно в положение 4 для пиразола и положение 5(4) для имидазола.
Примеры реакций
Пятичленные гетероциклы с двумя гетероатомами. Пиразолон и его таутомерия. Лекарственные средства на основе пиразолона-5: антипирин, амидопирин, анальгин. Производные имидазола: гистидин, гистамин, бензимидазол, дибазол. Тиазолидин.
Строение и синтез лекарственных средств на основе пиразолона-3
Таутомерия
Антипирин, амидопирин, анальгин оказывают общее действие на организм человека в качестве жаропонижающих и обезболивающих средств, бутадион применяют в качестве анальгетика при болях в суставах.
Синтез антипирина и амидопирина
Синтез анальгина
Имидазол.Этот гетероцикл является структурным фрагментом белковой аминокислоты гистидина и продукта ее декарбоксилирования — биогенного амина гистамина.
Имидазол, конденсированный с бензольным кольцом — бензимидазол— входит в состав ряда природных веществ, в частности витамина В12, а также вазодилатирующего средства дибазола(2-бен- зилбензимидазола).
Пиразол.Производные пиразола в природе не обнаружены. Наиболее известным производным пиразола являетсяпиразолон,одна из изомерных форм которого приведена ниже. На основе пиразолона созданы анальгетические средства —анальгин, бутадиони др.
Тиазол.В цикле тиазола содержатся два разных гетероатома. Структура тиазола встречается в составе важных биологически активных веществ — тиамина(витамина В1) и ряде сульфаниламидных препаратов, например, противомикробного средства фталазола.
Цикл полностью гидрированного тиазола — тиазолидин— является структурным фрагментом пенициллиновых антибиотиков
53.Азины. Строение, номенклатура. Ароматические представители: пиридин, хинолин, изохинолин. Оснóвные свойства. Реакции электрофильного замещения (нитрование, сульфирование, галогенирование).
Пиридин, хинолин, изохинолин
Образуя названия производных пиридина и его бензологов, используют нумерацию цикла. В случае пиридина используют также буквы греческого алфавита. Некоторые производные имеют тривиальные названия.
Азины— гетероциклические соединения, содержащие в шестичленном цикле, наряду с атомами углерода, не менее двух других атомов, из которых, по крайней мере, один — атом азота [1] .Азины обладают основным характером и дают соли с кислотами.
Для большинства гетероциклических соединений применяются тривиальные названия. При нумерации положений в кольце гетероатом обычно получает меньший номер.
Иногда для обозначения атомов используют греческие буквы. Если в конденсированных системах гетероатом не находится рядом с местом конденсации циклов, нумерация начинается с ближайшего к месту конденсации атома, при этом гетероатом приобретает наименьший номер.
Наличие у атома азота пиридина и его бензологов свободной пары электронов, не участвующей в сопряженной системе, обусловливает их основные и нуклеофильные свойства.
Пиридин и хинолин являются слабыми основаниями и с сильными кислотами образуют соли пиридиния и хинолиния.
Сульфирование хинолина приводит к 8-хинолинсульфокислоте, при щелочном плавлении которой
При нитровании изохинолина образуется смесь 5-нитро- и 8-нитроизохинолинов в соотношении 9:1.
N-оксидная группа, как и в случае пиридин-N-оксида, существенно модифицирует реакционную способность хинолинового и изохинолинового ядер, приводя к тому, что реакции электрофильного замещения протекают в более мягких условиях, причем в случае хинолина нитрование идет по положению 4, а в случае изохинолина в тех же условиях – по положениям 5 и 8 (соотношение продуктов 9:1). Это различие связано, по-видимому, с тем, что в случае изохинолин-N-оксида реагирует его протонированная форма, в отличие от хинолин-N-оксида.
Реакции электрофильного замещения
Пиридин
Реакции электрофильного замещения в пиридине идут с большим трудом, что По реакционной способности к электрофильному замещению пиридин напоминает нитробензол. Замещение идет по положению 3.
Несмотря на то, что в резонансной стабилизации промежуточного катиона при электрофильной атаке как при замещении по положению 3, так и по положениям 2 и 4, участвует одинаковое число мезомерных структур, в последних двух случаях катионы с положительным зарядом на иминном атоме азота крайне невыгодны.
Пиридин нитруется, сульфируется и галогенируются в очень жестких условиях. Только процессы галогенирования и сульфирования идут с удовлетворительными выходами. Алкилирование и ацилирование в кольцо провести не удается.
Реакции нуклеофильного замещения
Реакции нуклеофильного замещения для пиридиниевого цикла наиболее характерны.. Нуклеофильное замещение протекает по механизму присоединения-отщепления (SNAr). Наиболее активированными являются положения 2 и 4. При атаке нуклеофила по этим положениям образуются наиболее стабильные анионные интермедиаты, в которых атом азота участвует в делокализации отрицательного заряда.
В хинолине к нуклеофильному замещению также активированы положения 2 и 4.
Под действием таких сильных нуклеофилов, как амиды металлов и металлоорганические соединения, в пиридине и хинолине возможно замещение гидрид-иона. Аминирование пиридина и хинолина амидами металлов носит название реакции Чичибабина. Процесс проводят путем нагревания реагентов в инертном растворителе. Механизм реакции – присоединение –отщепление.
Аналогично реагирует хинолин с образованием 2-аминохинолина.
При действии на пиридин и хинолин фениллития водород в положении 2 замещается на фенильную группу.
Подобно пиридину, хинолин и изохинолин реагируют с нуклеофильными реагентами, в частности, вступают в реакцию Чичибабина с образованием 2-аминохинолина и 1-аминоизохинолина соответственно. Присоединение металлоорганических реагентов к хинолину происходит в очень жестких условиях. Как и в случае пиридина, превращение хинолина и изохинолина в N-оксиды значительно облегчает взаимодействие с нуклеофилами. Активны в реакциях нуклеофильного присоединения и алкилхинолиниевые и -изохинолиниевые соли.
Для пиридина характерны реакции ароматического нуклеофильного замещения, протекающие преимущественно по орто-пара положениям кольца.
54.Пиридин. Нуклеофильные свойства пиридина. Гомологи пиридина: α-, β- и γ-пиколины; их окисление.
Пиридин C5H5N — простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота:
Химические свойства пиридина определяются наличием ароматической системы и основного атома азота.
Основные и нуклеофильные свойства.
Пиридин проявляет слабые основные свойства (=5,23) за счет неподеленной пары электронов азота и с кислотами образует соли пиридиния.
Атом азота пиридина проявляет также нуклеофильные свойства и алкилируется алкилгалогенидами с образованием солей алкилпиридиния.
Соли алкилпиридиния легко взаимодействуют с нуклеофильными реагентами, в том числе с комплексными гидридами металлов (NaBH4), с образованием продуктов присоединения.
Пиколинами называют монометильные производные пиридина. По химическим свойствам пиколины сходны с пиридином. Они образуют соли с сильными кислотами и алкилгалогенидами, окисляются до N-оксидов, восстанавливаются до производных пиперидина, аналогично метил производным бензола окисляются a-пиколин до пиколиновой, b-пиколин до никотиновой и g-пиколин до изоникотиновой кислоты.
Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:
Никотиновая кислота и ее амид — важные лекарственные препараты.
🎬 Видео
8 класс. Составление уравнений химических реакций.Скачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Химия | Молекулярные и ионные уравненияСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Составление уравнений химических реакций. 2 часть. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Составление уравнений реакций. 1 часть. 10 класс.Скачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 2 ч. 9 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 3 ч. 9 класс.Скачать