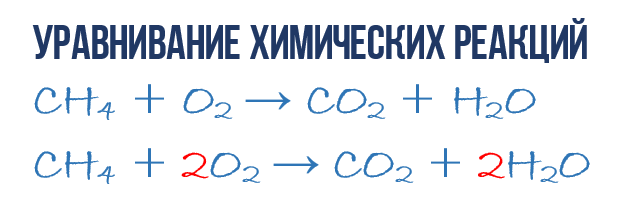Рассмотрим следующее полное уравнение: Fe(TB.) + Си804(водн.) FeSO4 (водн.) + Си(тв.)
Это уравнение описывает всю реакционную систему в целом. Однако рассматриваемую реакцию можно также представить в упрощенном виде при помощи ионного уравнения:
Fe (тв.) + Cu2 + (водн.) = Fe2 + (водн.) + Cu (тв.)
Это уравнение не включает сведений о сульфат-ионах SO2.-, которые не указаны в нем потому, что они не принимают участия в рассматриваемой реакции. Такие ионы называют ионами-наблюдателями.
Реакция между железом и медью (II) является примером окислительно-восстановительных реакций (см. гл. 10). Ее можно условно разделить на две реакции, одна из которых описывает восстановление, а другая-окисление, протекающие одновременно в общей реакции:
Восстановление Cu2+ (водн.) + 2е- = Сu(тв.)
Окисление Fe (тв.) = Fe2 + (водн.) + 2е-
Эти два уравнения называются уравнениями полуреакций. Они особенно часто используются в электрохимии для описания процессов, протекающих на электродах
Интерпретация химических уравнений
Рассмотрим следующее простое стехиометрическое уравнение: H2 (г.) + Br2 (г.) = 2HBr (г.)
Его можно интерпретировать двумя способами. Во-первых, согласно этому уравнению, один моль молекул водорода H2 реагирует с одним молем молекул брома Br2, образуя два моля молекул бромоводорода HBr. Такое истолкование химического уравнения иногда называют его молярной интерпретацией.
Однако можно истолковать данное уравнение и так, что в результирующей реакции (см. ниже) одна молекула водорода H2 реагирует с одной молекулой брома Br2, образуя две молекулы бромоводорода HBr. Подобное истолкование химического уравнения иногда называют его молекулярной интерпретацией.
И молярная, и молекулярная интерпретации одинаково правомочны. Однако было бы совершенно неправильно заключить на основании уравнения рассматриваемой реакции, что одна молекула водорода H2 сталкивается с одной молекулой брома Br2, образуя две молекулы бромоводорода НВг. Дело в том, что данная реакция, как и большинство других, осуществляется в несколько последовательных стадий. Совокупность всех этих стадий принято называть механизмом реакции (см. гл. 9). В рассматриваемом нами примере реакция включает следующие стадии:
Таким образом, рассматриваемая реакция в действительности представляет собой цепную реакцию, в которой участвуют интермедиаты (промежуточные реагенты), называемые радикалами (см. гл. 9). Механизм рассматриваемой реакции включает еще и другие стадии и побочные реакции. Таким образом, стехиометрическое уравнение указывает только результирующую реакцию. Оно не дает сведений о механизме реакции.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Приведите различные интерпретации химического уравнения
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Приведите примеры реакций, протекающих без изменения элементного состава простых веществ.
Превращение аллотропных модификацый углерода: C (графит) ⇄ C (алмаз)
Превращение аллотропных модификаций форфора: P (белый) ⇄ P (красный)
Превращение аллотропных модификаций олова: Sn (белый) ⇄ Sn (серое)
Как называются такие вещества? Аллотропными модификациями.
Задание 2
Приведите примеры реакций, протекающих без изменения качественного, но с изменением количественного состава простых веществ. Аллотропное видоизменение кислорода: 3O2 ⇄ 2O3
Задание 3
Приведите примеры реакций, протекающих без изменения качественного и с изменением количественного состава сложных веществ.
Реакция гидрирования этилена: C2H4 + H2 t, кат. ⟶ C2H6
Пирролиз метана: CH4 t ⟶ C + 2H2
CH4 t ⟶ C2H2 + 2H2
Реакция окисления оксида серы (IV) кислородом до оксида серы (VI): 2SO2 + O2 ⇄ 2SO 3
Задание 4
Как классифицируют реакции по числу и составу реагентов и продуктов? Реакции соединения, разложения, замещения и обмена.
Реакции соединения ― реакции, в результате которых из двух и более веществ образуется одно сложное вещество.
Реакции разложения ― реакции, в результате которых из одного сложного вещества образуется два или несколько новых веществ.
Реакции замещения ― реакции, в результате которых атомы простого вещества замещают атомы другого элемента в сложном веществе. Реакции обмена ― реакции, в результате которых два сложных вещества обмениваются своими составными частями.
Задание 5
Что такое реакции разложения? Реакции разложения ― реакции, в результате которых из одного сложного вещества образуется два или несколько новых веществ.
С каким тепловым эффектом они протекают? Реакции разложения относятся, как правило, к эндотермическим реакциям.
Задание 6
Запишите термохимическое уравнение реакции горения оксида углерода (II), если известно, что при сгорании 112 л этого газа (н.у.) выделяется 141,5 кДж теплоты. Химическое уравнение: 2СO + О2 = 2СО2
По условию задачи с 112 л СO выделяется 141,5 кДж теплоты,
по химическому уравнению с 44,8 л (2 моль) СO ― х кДж теплоты.
х= 44,8 л ● 141,5 кДж : 112 л=56,6 кДж
Запишем термохимическое уравнение:
2СO (г) + О2 (г) = 2CO2 (г) + 56,6 кДж
Задание 7
Рассчитайте теплоту (кДж), полученную при горении 5,6 л ацетилена (н.у.) согласно термохимическому уравнению реакции:
2C2H2 + 5O2 ⟶ 4CO2↑ + 2H2O + 2610 кДж
По химическому уравнению с 44,8 л (2 моль) С2H2 выделяется 2610 кДж теплоты,
по условию задачи с 5,6 л С 2H2 ― х кДж теплоты.
х=5,6 л ● 2610 кДж : 44,8 л=326,25 кДж
Ответ: Q=326,25 кДж
Задание 8
На примере реакций соединения или разложения покажите относительность их разделения на экзо- или эндотермические процессы. Рассмотрим реакцию. N2 + 3H2 ⇄ 2NH3 + Q
Прямая реакция является реакцией соединения, и протекает с выделением энергии, поэтому относится к экзотермическим реакциям. Обратная реакция является реакцией разложения и протекает с поглощением энергии, поэтому относится к эндотермическим реакциям.
Рассмотрим реакцию. N2 + O2 ⇄ 2NO — Q
Прямая реакция является реакцией соединения, и протекает с поглощение энергии, поэтому относится к эндотермическим реакциям. Обратная реакция является реакцией разложения и протекает с выделением энергии, поэтому относится к экзотермическим реакциям.
📸 Видео
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Химическое равновесие. Задание №22 | Химия ЕГЭ 2022 | УмскулСкачать

Составление уравнений химических реакций. 2 часть. 8 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

ЧТО ТАКОЕ уравнение химической реакции? Все намного проще чем ты думал! #shorts #yotubeshortsСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Задание №8. Химические свойства | Химия ОГЭ 2023 | УмскулСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

8 класс. Составление уравнений химических реакций.Скачать