- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Орг. в-ва, которые подвергаются гидролизу. § 17-18, вопрос 9. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г.
- Гидролиз
- Обратимый гидролиз солей
- Необратимый гидролиз
- Факторы, влияющие на степень гидролиза:
- Реакции гидролиза органических веществ и минеральных солей
- 💥 Видео
Видео:Гидролиз солей. 9 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Гидролиз органических веществ. 11 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7073c0094bea97a9 • Your IP : 85.95.179.80 • Performance & security by Cloudflare
Видео:Классификация реакций в органической химииСкачать

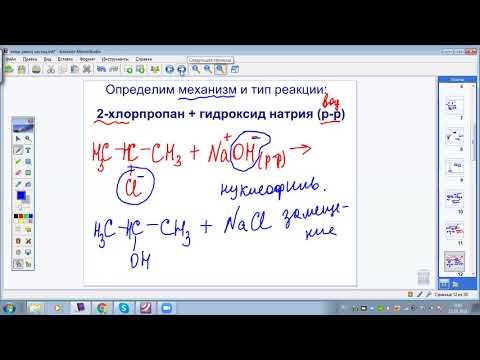
Орг. в-ва, которые подвергаются гидролизу. § 17-18, вопрос 9. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г.
Хай, кто знает правильный ответ?
Приведите примеры органических веществ, которые подвергаются гидролизу.
Привет) проходили уже
Примерами органических веществ, подвергающихся гидролизу, являются бромметан, сахароза, метиловый эфир муравьиной кислоты.
CH3Br + HOH ⇄ CH3OH + HBr
C12H22O11 + HOH ⇄ 2C6H12O6
HCOOCH3 + HOH ⇄ HCOOH + CH3OH
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Видео:Видеоурок по химии "Типы химических реакций в органической химии"Скачать

Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой , гидролизуются ПО АНИОНУ .
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH — . Водородный показатель такого раствора рН>7 .
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой , гидролизуются ПО КАТИОНУ . Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
или в молекулярной форме:
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н + . Водородный показатель такого раствора рН .
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой , гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ .
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7 . Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой , в водных растворах НЕ ИДЕТ .
Сведем вышеописанную информацию в общую таблицу:
Видео:механизмы реакций в органической химииСкачать
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
- Некоторые соли необратимо гидролизуются с образованием оксосолей :
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза .
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Видео:Состав и структура органических веществ. Изомерия. 1 часть. 10 класс.Скачать

Реакции гидролиза органических веществ и минеральных солей
Вопрос 1.
Примерами органических веществ, подвергающихся гидролизу, являются сахароза, бромметан, метиловый эфир муравьиной кислоты:
а) гидролиз сахарозы протекает в присутствии серной кислоты и при нагревании с образованием глюкозы и фруктозы:
б) гидролиз бромметана протекает в присутствии едкого калия, при этом образуется метиловый спирт и бромоводород:
в) при гидролизе метилового эфира муравьиной кислоты образуется муравьиная кислота и метиловый спирт:
Вопрос 2.
Гидролизу подвергаются соли, образованные сильным основанием и слабой кислотой, слабым основанием и сильной кислотой, слабым основанием и слабой кислотой. Водные растворы солей при этом могут иметь щелочную, кислую и нейтральную среды, соответственно.
Вопрос 3.
Гидролизу по катиону подвергаются соли слабого основания и сильной кислоты:
Вопрос 4.
Гидролиз по аниону подвергаются соли сильного основания и слабой кислоты: CaS, Na2SO3, K(HCOO):
Вопрос 5.
а) SrCl2 – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу.
г) BaBr2 – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу. Реакция среды будет нейтральная, pH = 7, лакмус — фиолетовый.
з) NaJ – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу. Реакция среды будет нейтральная, pH = 7, лакмус — фиолетовый.
и) KNO3 – соль сильного основания и сильной кислоты, поэтому не подвергается гидролизу. Реакция среды будет нейтральная, pH = 7, лакмус — фиолетовый.
Вопрос 6.
Фенолфталеин окрашивает щелочные растворы в малиновый цвет. Окраска растворов при добавлении фенолфталеина изменится (станет малиновой) при добавлении его к растворам солей, образованных сильным основанием и слабой кислотой.
По условию задания это соли K2SO3 и NaCN.
Вопрос 7.
При гидролизе соли ZnCl2 в растворе образовалось небольшое количество соляной кислоты, которая прореагировала с металлическим цинком с образованием пузырьков газа водорода: Zn + 2HCl ↔ ZnCl2 H2↑
Вопрос 8.
Гидролизу и по катиону и по аниону подвергаются соли образованные слабой кислотой и слабым основанием. По условию задания это
соль (NH4)2SO3.
Вопрос 9.
Уравнение реакции имеет вид:
3NaH2COH3 + AlH2(SOH4)H3 + 3HH2O ↔ 2Al(OH)H3↓ + 3COH2↑ + 3NaH2SOH4
Вопрос 10.
Расположение солей в порядке возрастания кислотности среды их водных растворов:
Na2CO3, Na(CH3COO), Na(CH2ClCOO), NaNO3, NH4Cl.
Растворы солей Na2CO3, Na(CH3COO), Na(CH2ClCOO) имеют щелочную среду, поэтому они располагаются вначале; т.к. являются солями сильного основания NaOH и слабых кислот H2CO3, CH3COOH, CH2ClCOOH. Эти соли гидролизуются по аниону и поэтому образуют в растворах избыток ионов OH – , которые и придают раствору щелочную среду. H2CO3 — самая слабая из всех кислот, те. среда Na2CO3 — самая щелочная, то он находится первым в ряду, СН3СООН более сильная кислота, СН2СIСООН еще более сильная, среды Na(CH3COO) и Na(CH2ClCOO) менее щелочные, поэтому они располагаются следующими. NaNO3 – соль сильного основания (NaOH) и сильной кислоты (HNO3) имеет нейтральную среду, т.к. гидролизу не подвергается. NH4Cl — соль слабого основания (NH4OH) и сильной кислоты (HCl) гидролизуется по катиону с образованием избытка ионов водорода H + , что и придаёт раствору соли слабокислую среду.
Вопрос 11.
FeCl3 – соль слабого основания (Fe(OH)3 и сильной кислоты (HCl) гидролизуется по катиону с образованием избытка ионов водорода H + , что придаёт раствору соли слабокислую среду. При добавлении к раствору щёлочи NaOH или H2O уменьшится концентрация H + , что будет вести к усилению гидролиза соли. Равновесие реакции будет смещаться вправо.
Добавление к раствору FeCl3 растворов HCl и ZnCl2, и металлического Zn ,будет вести к увеличению концентрации ионов водорода, что будет вести к ослаблению гидролиза.
Вопрос 12.
K2S – соль сильного основания и слабой кислоты гидролизуется по аниону с образованием ионов OH – , что придаёт раствору соли щелочную среду:
K2S + 2H2O ↔ 2KOH + H2S
Поэтому для подавления гидролиза нужно понизить кислотность, ввести дополнительно ионы OH – ,например, раствор KOH. Можно уменьшить концентрацию самой соли K2S, а также понизить температуру.
💥 Видео
Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

Классификация органических соединений | Химия ЕГЭ 10 класс | УмскулСкачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Гидролиз солей. 10 класс.Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Классификация органических веществ. 1 часть. 10 класс.Скачать

Электронные эффекты заместителейСкачать

ЛЕКЦИЯ 1.2. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ. КИСЛОТНОСТЬ-ОСНОВНОСТЬСкачать
Особенности органических веществ. 9 класс.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Реакции присоединения и полимеризации в органике | Химия ЕГЭ | УмскулСкачать













