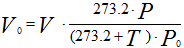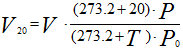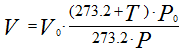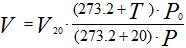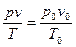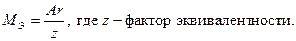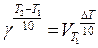Для сравнения объемных количеств газа их приводят к нормальным и стандартным условиям. Нормальными условиями принято считать температуру 0°С и давление 760 мм рт.ст. (101,325 Па). ГОСТы на топливные газы принято утверждать при температуре +20°С и 760 мм рт. ст., то эти условия принято считать стандартными.
Пересчет параметров, характеризующих состояние газа, на нормальные или стандартные условия производится согласно приводимым ниже формулам.
Приведение газа к нормальным условиям осуществляется по следующему уравнению:
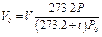
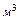
Аналогично для приведения газа к стандартным условиям пользуются соотношением
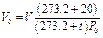
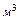
где Vo — объем газа при нормальных условиях (P0;T0); V — объем газа при давлении Р и температуре t°С; Р — давление газа в момент измерения объема газа V при температуре t°С (Т = 273,2 + t); Ро — нормальное давление газа, т.е. давление 760 мм рт. ст; 273,2 — нормальная температура, т.е. T0; V20 — объем газа при стандартных условиях: температуре T = 273,2 + 20 = 293,2 и давлении Ро.
Иногда приходится газ, находящийся при нормальных и стандартных условиях, приводить к заданным условиям температуры и давления. Приведенные выше соотношения примут следующий вид:
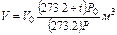
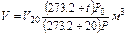
При приведении объема влажного газа к нормальным условиям необходимо внести поправку на величину давления водяных паров при температуре t°С; величину давления водяных паров рпар берут из табл. 17. В таком случае приведенные выше формулы примут следующий вид:
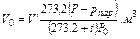
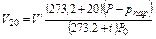
где V’ — объем влажного газа при данных условиях Р и t 0 С; pпар — упругость (давление) водяных паров при температуре t 0 С.
Видео:Приведение объема газа к нормальным условиямСкачать

Приведение газа к нормальным условиям осуществляется по следующему уравнению
Нормальными условиями принято считать давление газа P0 =101.325 кПа и его температуру T0 =0 ºС или T0 =273.2 К.
ГОСТы на топливные газы принято утверждать при температуре T20 =+20 ºС и P0 101.325 кПа (760 мм рт.ст.), в связи с этим эти условия называют стандартными.
Нормальные и стандартные условия введены для сравнения объёмных количеств различных газов.
Приведение газа к нормальным условиям осуществляется по следующему уравнению:
Рисунок 252. (1)
Аналогично для приведения газа к стандартным условиям:
Рисунок 253. (2)
Иногда приходится газ, находящийся при нормальных и стандартных условиях, приводить к заданным условиям температуры и давления. Приведенные выше соотношения примут следующий вид:
Рисунок 254. (3)
Рисунок 255. (4)
V0 — объём газа при нормальных условиях ( P0 , T0 ), м 3 ;
V — объём газа при давлении P и температуре Т °С, м 3 ;
P0 – нормальное давление газа, P0 =101.325 кПа = 0.101325 МПа, (760 мм рт.ст.);
273.2 – нормальная температура, то есть T0 , К;
V20 — объём газа при стандартных условиях (температуре T20 =273.2+20=293.2 и давлении P0 ), м 3 .
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Пример 1. Приведение объема газа к нормальным условиям.
Какой объем (н.у.) займут 0,4·10 -3 м3 газа, находящиеся при 50 0 С и давлении 0,954·10 5 Па?
Решение. Для приведения объема газа к нормальным условиям пользуются общей формулой, объединяющей законы Бойля-Мариотта и Гей-Люссака:
Объем газа (н.у.) равен 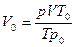
Пример 2. Определение средней молекулярной массы смеси газов по относительной плотности.
Вычислите среднюю молекулярную массу смеси газов, состоящей на 80% из метана и 20% кислорода (по объему), используя значения относительной плотности этих газов по водороду.
Решение. Часто вычисления производят по правилу смешения, которое заключается в том, что отношение объемов газов в двухкомпонентной газовой смеси обратно пропорционально разностям между плотностью смеси и плотностями газов, составляющих эту смесь. Обозначим относительную плотность газов через 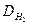
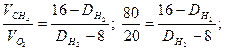
Плотность этой газовой смеси по водороду равна 9,6. средняя молекулярная масса газовой смеси 
Пример 3. Определение давления газовой смеси.
В сосуде объемом 0,05 м 3 при 25 0 С содержится смесь из 0,020 м 3 этилена под давлением 83950 Па и 0,015 м 3 метана под давлением 95940 Па. Найдите общее давление газов в сосуде.
Решение. Сначала определяем парциальное давление каждого из газов:

Общее давление газовой смеси равно сумме парциальных давлений ее компонентов:
Пример 4. Вычисление химических эквивалентов.
На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода, измеренного при (н.у.). Вычислить молярные массы металла и оксида. Чему равна относительная масса металла?
Решение. По закону эквивалентов массы веществ m1 и m2, вступающих в реакцию, пропорциональны молярным массам их эквивалентов


Если одно из веществ находится в газообразном состоянии, то как правило, его количество измеряется в объемных единицах (см 3 , л, м 3 ).
Формулу (2) преобразуем относительно объема водорода:
Находим молярную массу эквивалента металла (г/моль):
По закону эквивалентов:
Относительную атомную массу металла определяем из соотношения:
Варианты задач по теме 1.2
1. В 2,48г оксида одновалентного металла содержит 1,84г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла.
2. 3,04г некоторого металла вытесняют 0,252г водорода, 26,965г серебра и 15,885г меди из соединений этих металлов. Вычислите эквивалентные массы указанных металлов.
3. Оксид металла содержит 28,57% кислорода, а его фторид 48,72% фтора. Вычислите эквивалентные массы металла и фтора.
4. Напишите уравнение реакций гидроксида железа (III) с соляной кислотой при которой образуются: а) хлорид дигидроксожелеза (III), б) хлорид гидроксожелеза (III), в) хлорид железа (III). Вычислите эквивалент и молярную массу эквивалента гидроксида железа в этих реакциях.
5. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия, б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и молярные массы эквивалентов.
6. Вещество содержит 38% серы и мышьяк. Эквивалентная масса серы 16,0 г/моль. Вычислите молярную массу эквивалента и валентность мышьяка, составьте формулу данного сульфида.
7. Избытком соляной кислоты подействовали на растворы: а) гидрокарбоната кальция, б) хлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с НCI, определите их эквиваленты и молярные массы эквивалентов.
8. При окислении 16,74г двухвалентного металла образовалось 21,54г оксида. Вычислите молярные массы эквивалентов металла и его оксида.
9. При взаимодействии 3,24 трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу металла.
10. На нейтрализацию 0,943г фосфористой кислоты израсходовано 1,291 г КОН. Вычислите основность кислоты и молярную массу эквивалента
11. Соединение металла с галогеном содержит 64,5% галогена, оксид того же металла содержит 15,4% кислорода. Определите галоген.
12. Вычислите молярную массу эквивалента оксида углерода (IV) в реакциях образования с раствором КОН: а) КНСО3 , б) К2СО3 .
13. На нейтрализацию 2,3г основания израсходовано 2,14г НСl. Вычислить молярную массу эквивалента основания.
14. В каком количестве NаОН содержится столько же эквивалентов, сколько в 140г КОН?
15. В каком количестве Ва(ОН)х8Н2О содержится столько же эквивалентов, сколько в156г Аl(OH)3 ?
16. 0.376г алюминия при взаимодействии с кислотой вытеснили 0,468 л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99г/моль
17. Серная и ортофосфорная кислоты имеют одинаковую молярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
18. 1,6г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить молярную массу эквивалента цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль?
19. Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
20. При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,4г соли. Вычислить молярную массу эквивалента вещества и образовавшейся соли.
21. При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема СО2 и один объем N2 . Найти молекулярную формулу газа.
22. Найти молекулярную формулу соединения бора с водородом, если масса 1 л этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2%.
23. При пропускании над катализатором смеси, состоящей из 10 моль оксида серы(IV) и 15 моль кислорода, образовалось 8 моль оксида серы (VI). Сколько моль диоксида серы и кислорода не вступило в реакцию?
24. При пропускании водяного пара над раскаленным углем получается водяной газ, состоящий из равных объемов СО и водорода. Какой объем водяного газа (н.у.) может быть получен из 3 кг угля?
25. Через раствор, содержащий 7,4 г гидроксида кальция, пропустили 3,36л диоксида углерода (н.у.). Найти массу вещества, образовавшегося в результате реакции.
26. Рассчитать массу кристаллогидрата Cu(NO3)2х3Н2О, полученного растворением 10г меди в азотной кислоте и последующим выпариванием раствора.
27. В одном из двух закрытых баллонов одинаковыми объемами находится кислород, в другом — азот. Массы обоих газов одинаковы. Температура обоих газов 27 0 С. В каком баллоне давление больше и во сколько раз? До какой температуры следует нагреть содержимое одного баллона, чтобы давление внутри него достигло давления в другом баллоне?
28. В закрытом баллоне находится 160 г кислорода под давлением 121,6 кПа при 12 С. Вычислить массу диоксида углерода в таком же объеме, если он находится под давлением 202,6 кПа и при 37 С.
29. Сколько литров кислорода при 21 С и 104,5 кПа выделится при разложении 490 г КС1О3 ?
30. 1 г металла соединяется с массой хлора, занимающей 336 мл при 37 0 С и 98 кПа. Вычислить молярную массу эквивалента металла.
Химическая кинетика
Теоретические пояснения
Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени. Её размерность моль 

Зависимость скорости реакции от концентрации выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции Н2(г) + I2 (г) 
закон действующих масс может быть записан V = kCH 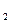
где V — скорость химической реакции; k — константа скорости; CH 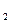
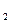




Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
где 


Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания.
Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается.
🎬 Видео
Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Уравнение состояния идеального газаСкачать

Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Давление газаСкачать
Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

Связь между давлением, объёмом и температурой газаСкачать

Газовые Законы и Правила. Уравнение Менделеева-Клапейрона. Пример расчета объема газа при Р атм.Скачать

Физика 10 класс : Объединенный газовый законСкачать

Химия 8 класс (Урок№9 - Относительная плотность газов. Объёмные отношения газов.)Скачать

Физика. 10 класс. Уравнение состояния идеального газа /23.11.2020/Скачать

10 класс урок №39 Уравнение состояния идеального газаСкачать

Объемные отношения газов при химических реакциях. 8 класс.Скачать

Связь между давлением и объёмом газаСкачать

Работа газа при изменении его объема.Скачать

Как понять что вещество выпадает в осадок или образуется газСкачать

Работа, совершаемая газом при расширении. Работа при изменении объёма газаСкачать

Закон идеальных газов. Практическая часть - решение задачи. 9 класс.Скачать