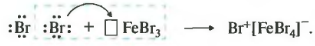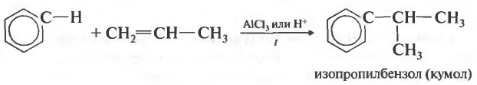Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
- Химические свойства аренов
- 1. Реакции присоединения
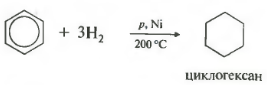
- 1.1. Гидрирование
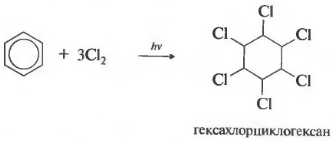
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
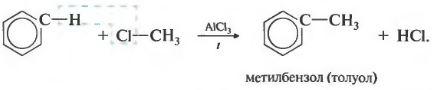
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- Химические свойства
- 1. Реакции замещения в бензольном кольце
- 2. Реакции присоединения к бензолу
- 3. Замещение в боковой цепи гомологов бензола
- 4. Окисление гомологов бензола
- Бензол и его гомологи
- 🔍 Видео
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
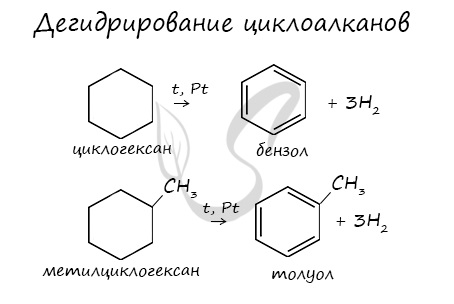
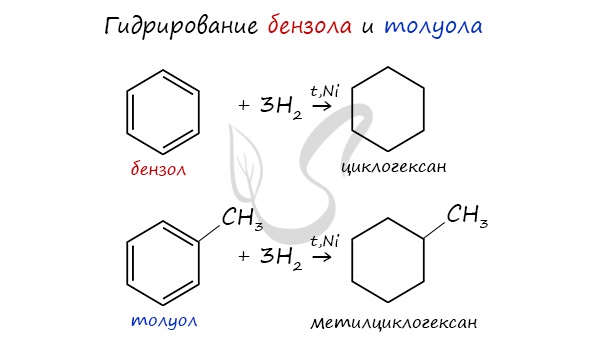
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
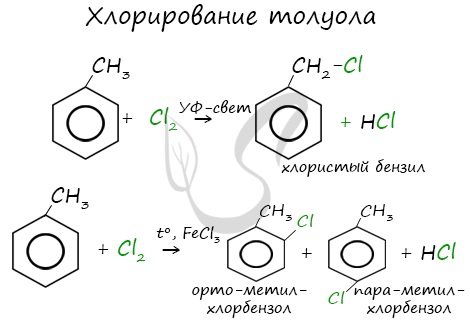
1.2. Хлорирование аренов
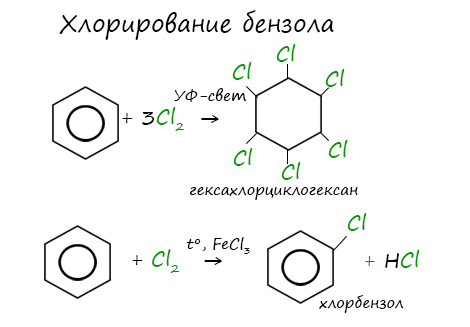
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
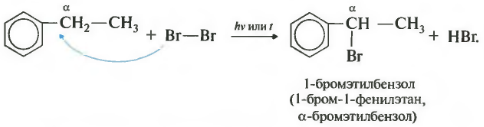
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
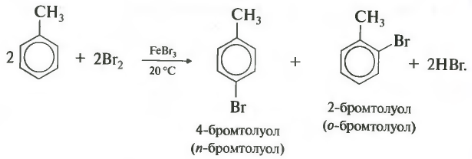
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
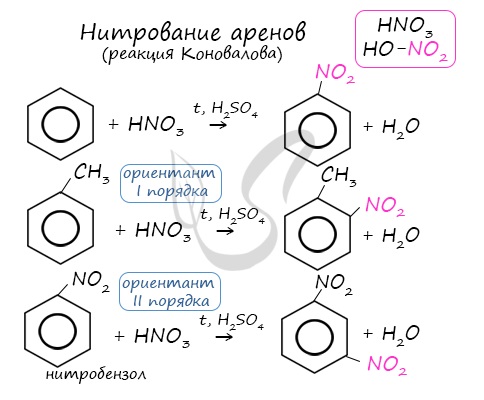
2.2. Нитрование
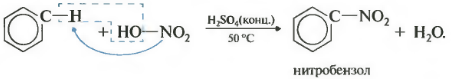
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
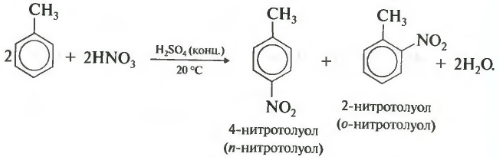
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
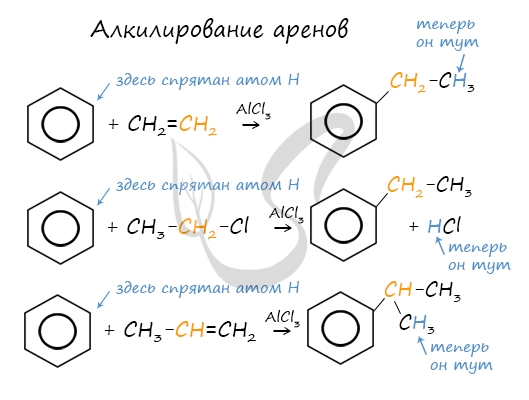
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:Получение бензола и его гомологов. 2 часть. 11 класс.Скачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
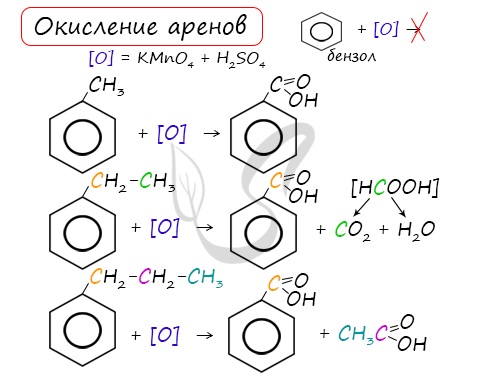
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
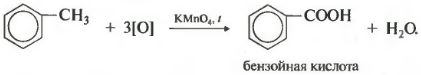
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
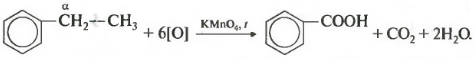
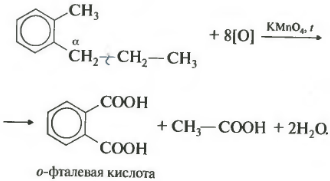
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

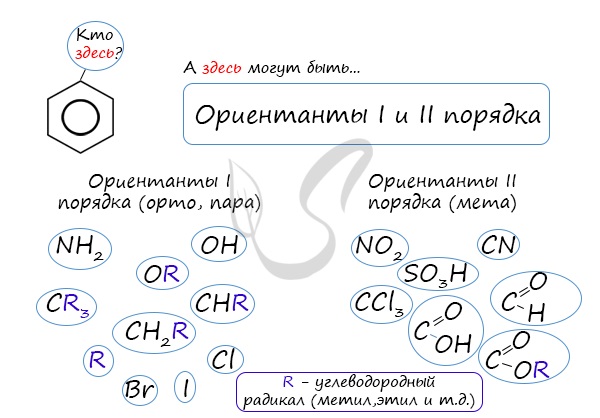
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

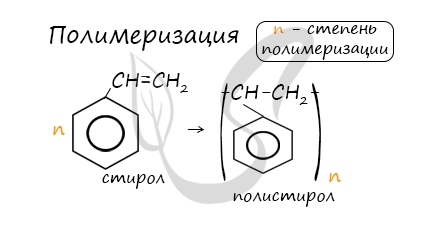
5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Химические свойства
- Строение, номенклатура, изомерия
- Способы получения
- Химические свойства
1. Реакции замещения в бензольном кольце
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах, но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.
Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.
Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство алкилирование бензола галогеналканами.
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.
Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
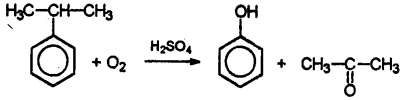
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
Видео:Получение бензола и его гомологов. 1 часть. 11 класс.Скачать

Бензол и его гомологи
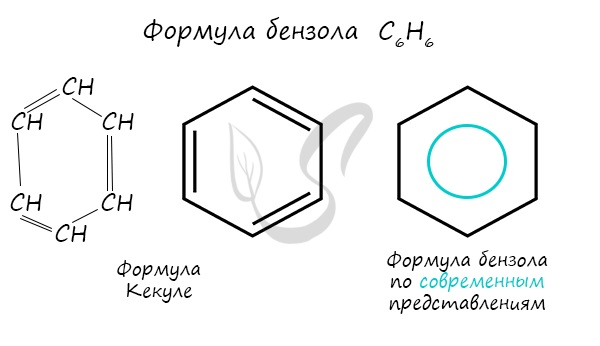
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол — 120°.
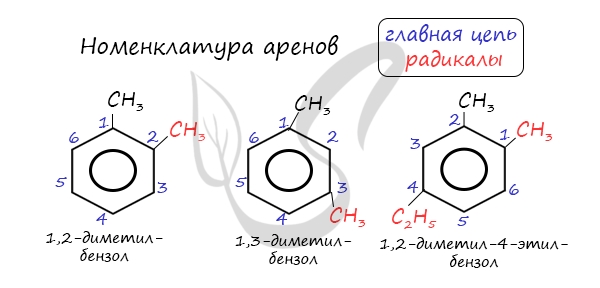
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
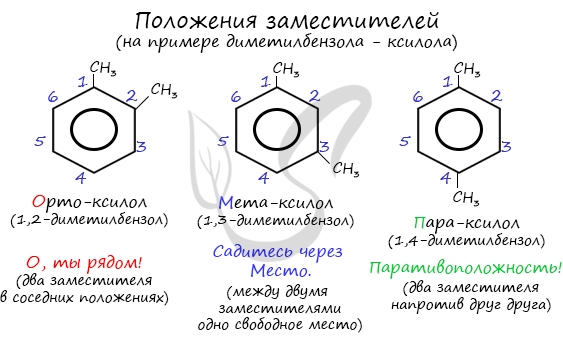
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
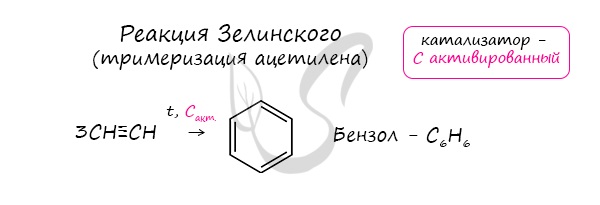
- Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.
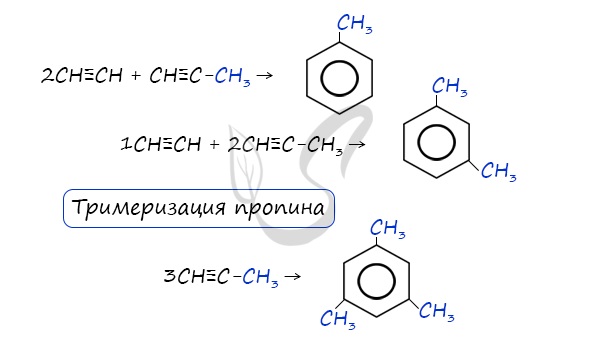
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
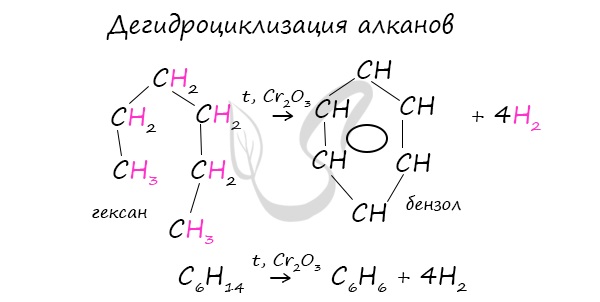
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
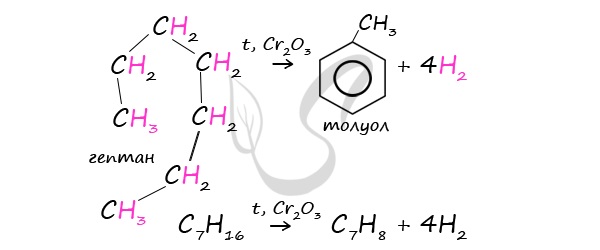
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
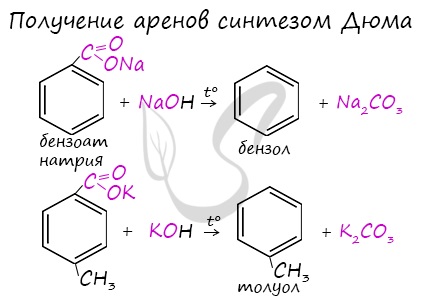
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
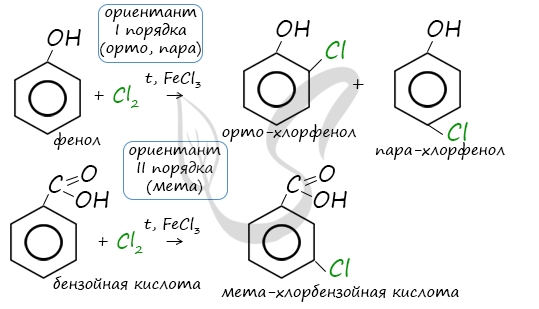
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
🔍 Видео
10 класс § 37 "Химические свойства бензола и его гомологов".Скачать

Химия 10 класс (Урок№4 - Арены (ароматические углеводороды).)Скачать

Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

3.3. Алкины: Химические свойстваСкачать

Химические свойства бензола и его гомологов. 2 часть. 11 класс.Скачать

ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Несколько заместителейСкачать

Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать

Химические свойства бензола и его гомологов. 3 часть. 11 класс.Скачать

Ароматические соединения бензольного ряда. Ориентанты 1-го и 2-го рода.Скачать

Бензол и его гомологиСкачать