- Реакции ионного обмена — это один из видов химических реакций. Правила, условия протекания и примеры
- Понятие о реакции
- Особенности взаимодействий
- Условия протекания
- Варианты классификации реакций
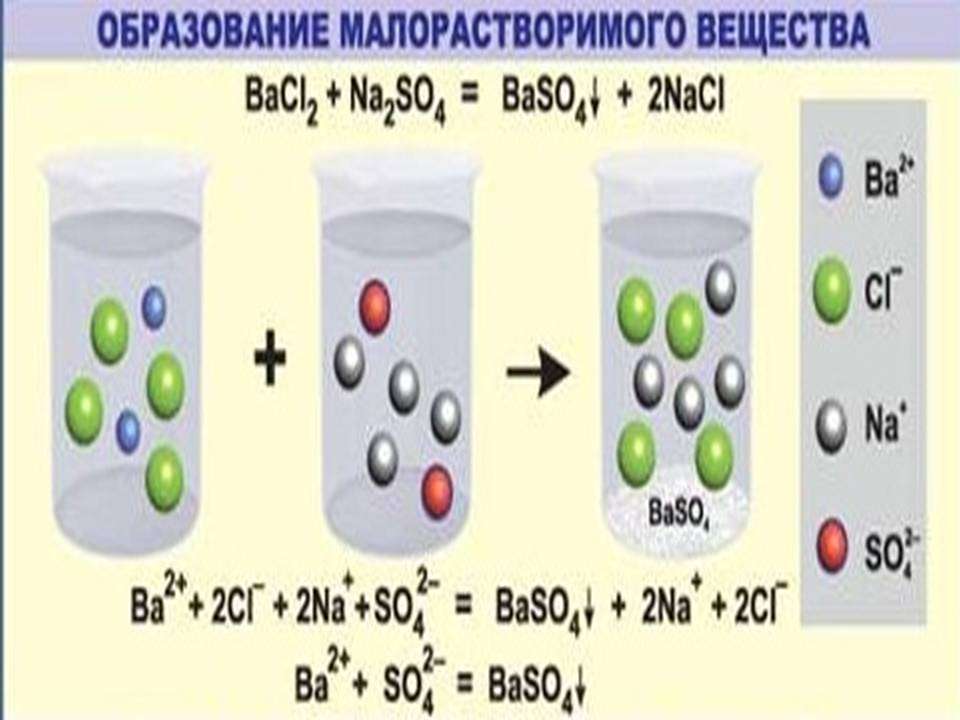
- Пример ионных уравнений, сопровождающихся выпадением осадка
- Пример процесса с образованием газа
- Получение малодиссоциируемого соединения
- Заключение
- Практикум по химии Химический практикум в школе В предложенном материале представлены методические разработки практических работ для 9-го класса: “Решение экспериментальных задач по теме “Азот и фосфор”, “Определение минеральных удобрений”, а также лабораторных опытов по теме “Реакции обмена между растворами электролитов”. Реакции обмена между растворами электролитов Методическая разработка состоит из трех частей: теория, практикум, контроль. В теоретической части приведены некоторые примеры молекулярных, полных и сокращенных ионных уравнений химических реакций, протекающих с образованием осадка, малодиссоциирующего вещества, выделением газа. В практической части даны задания и рекомендации для учащихся по выполнению лабораторных опытов. Контроль состоит из тестовых заданий с выбором правильного ответа. 1. Реакции, идущие с образованием осадка. а) При взаимодействии сульфата меди(II) с гидроксидом натрия образуется голубой осадок гидроксида меди(II). Молекулярное уравнение химической реакции: Полное и сокращенное ионные уравнения реакций: Cu 2+ + + 2Na + + 2OH – = Cu(OH)2 + 2Na + + , Cu 2+ + 2OH – = Cu(OH)2. б) При взаимодействии хлорида бария с сульфатом натрия выпадает белый молочный осадок сульфата бария. Молекулярное уравнение химической реакции: BaCl2 + Na2SO4 = 2NaCl + BaSO4. Полное и сокращенное ионные уравнения реакций: Ba 2+ + 2Cl – + 2Na + + = 2Na + + 2Cl – + BaSO4, Ba 2+ + = BaSO4. 2. Реакции, идущие с выделением газа. При взаимодействии карбоната или гидрокарбоната натрия (пищевая сода) с соляной или другой растворимой кислотой наблюдается вскипание, или интенсивное выделение пузырьков газа. Это выделяется углекислый газ СО2, вызывающий помутнение прозрачного раствора известковой воды (гидроксида кальция). Известковая вода мутнеет, т.к. образуется нерастворимый карбонат кальция. Молекулярные уравнения химических реакций: а) Na2CO3 + 2HCl = 2NaCl + H2O + CO2; б) NaHCO3 + HCl = NaCl + CO2 + H2O; Ca(OH)2 + CO2 = CaCO3 + H2O. Полные и сокращенные ионные уравнения реакций: а) 2Na + + + 2H + + 2Cl – = 2Na + + 2Cl – + CO2 + H2O, + 2H + = CO2 + H2O; б) Na + + + H + + Cl – = Na + + Cl – + CO2 + H2O, + H + = CO2 + H2O. 3. Реакции, идущие с образованием малодиссоциирующего вещества. При взаимодействии гидроксида натрия или калия с соляной кислотой или другими растворимыми кислотами в присутствии индикатора фенолфталеина раствор щелочи обесцвечивается, в результате реакции нейтрализации образуется малодиссоциирующее вещество H2O. Молекулярные уравнения химических реакций: а) NaOH + HCl = NaCl + H2O; Полные и сокращенные ионные уравнения реакций: а) Na + + OH – + H + + Cl – = Na + + Cl – + H2O, б) 2Na + + 2OH – + 2H + + = 2Na + + + 2H2O, в) 3K + + 3OH – +3H + + = 3K + + + 3H2O, 1. Реакции обмена между растворами электролитов, идущие с образованием осадка. а) Провести реакцию между растворами сульфата меди(II) и гидроксида натрия. Написать молекулярное, полное и сокращенное ионные уравнения химических реакций, отметить признаки химической реакции. б) Провести реакцию между растворами хлорида бария и сульфата натрия. Написать молекулярное, полное и сокращенное ионные уравнения химических реакций, отметить признаки химической реакции. 2. Реакции, идущие с выделением газа. Провести реакции между растворами карбоната натрия или гидрокарбоната натрия (пищевая сода) с соляной или другой растворимой кислотой. Выделяющийся газ (используя газоотводную трубку) пропустить через прозрачную известковую воду, налитую в другую пробирку, до ее помутнения. Написать молекулярные, полные и сокращенные ионные уравнения химических реакций, отметить признаки этих реакций. 3. Реакции, идущие с образованием малодиссоциирующего вещества. Провести реакции нейтрализации между щелочью (NaOH или KOH) и кислотой (HCl, HNO3 или H2SO4), предварительно поместив в раствор щелочи фенолфталеин. Отметить наблюдения и написать молекулярные, полные и сокращенные ионные уравнения химических реакций. Признаки, сопутствующие данным реакциям, можно выбрать из следующего перечня: 1) выделение пузырьков газа; 2) выпадение осадка; 3) появление запаха; 4) растворение осадка; 5) выделение тепла; 6) изменение цвета раствора. 1. Ионное уравнение реакции, в которой образуется голубой осадок, – это: а) Cu 2+ + 2OH – = Cu(OH)2; б) СuO + 2H + = Cu 2+ + H2O; в) Fe 3+ + 3OH – = Fe(OH)3; г) Al 3+ + 3OH – = Al(OH)3. 2. Ионное уравнение реакции, в которой выделяется углекислый газ, – это: а) CaCO3 + CO2 + H2O = Ca 2+ + ; г) 2H + + 2OH – = 2H2O. 3. Ионное уравнение реакции, в которой образуется малодиссоциирующее вещество, – это: а) Ag + + Cl – = AgCl; в) Zn + 2H + = Zn 2+ + H2; г) Fe 3+ + 3OH – = Fe(OH)3. 4. Ионное уравнение реакции, в которой образуется белый осадок, – это: а) Cu 2+ + 2OH – = Cu(OH)2; б) СuO + 2H + = Cu 2+ + H2O; в) Fe 3+ + 3OH – = Fe(OH)3; 5. Молекулярное уравнение, которое соответствует сокращенному ионному уравнению реакции 3OH – + 3H + = 3H2O, – это: а) NaOH + HCl = NaCl + H2O; 6. Молекулярное уравнение, которое соответствует сокращенному ионному уравнению реакции H + + = H2O + CO2, – Ответы. 1-а; 2-в; 3-б; 4-г; 5-в; 6-в. Решение экспериментальных задач по теме “Азот и фосфор” Учащиеся при изучении нового материала по теме “Азот и фосфор” выполняют ряд опытов, касающихся получения аммиака, определения нитратов, фосфатов, солей аммония, приобретают определенные навыки и умения. В данной методической разработке приведены шесть заданий. Для выполнения практической работы достаточно трех заданий: одно – на получение вещества, два – по распознаванию веществ. При выполнении практической работы учащимся можно предложить задания в форме, которая облегчит им оформление отчета (см. задания 1, 2). (Ответы приведены для учителя.) Получите аммиак и опытным путем докажите его наличие. а) Получение аммиака. Смесь равных по объему порций твердого хлорида аммония и порошка гидроксида кальция нагрейте в пробирке с газоотводной трубкой. При этом будет выделяться аммиак, который надо собрать в другую сухую пробирку, расположенную отверстием …. (почему?). Написать уравнение реакции получения аммиака. б) Определение аммиака. Можно определить по запаху ………… (название вещества), а также по изменению цвета лакмуса или фенолфталеина. При растворении аммиака в воде образуется ……. (название основания), поэтому лакмусовая бумажка .……. (указать цвет), а бесцветный фенолфталеин становится …………. (указать цвет). Вместо точек вставить слова по смыслу. Написать уравнение реакции. * Аммиаком пахнет имеющийся в домашней аптечке нашатырный спирт – водный раствор аммиака. – Прим. ред. Получите нитрат меди двумя различными способами, имея в наличии следующие вещества: концентрированную азотную кислоту, медную стружку, сульфат меди(II), гидроксид натрия. Напишите уравнения химических реакций в молекулярном виде, отметьте изменения. В 1-м способе для окислительно-восстановительной реакции напишите уравнения электронного баланса, определите окислитель и восстановитель. Во 2-м способе напишите сокращенные ионные уравнения реакций. 1-й с п о с о б. Медь + азотная кислота. Слегка нагреваем содержимое пробирки. Бесцветный раствор становится ….. (указать цвет), т.к. образуется ….. (название вещества); выделяется газ …….. цвета с неприятным запахом, это – ……. (название вещества). 2-й с п о с о б. При взаимодействии сульфата меди(II) с гидроксидом натрия получается осадок ….. цвета, это – …… (название вещества). К нему приливаем азотную кислоту до полного растворения осадка . (название осадка). Образуется прозрачный голубой раствор …… (название соли). Докажите опытным путем, что в состав сульфата аммония входят ионы NH4 + и SO 2- 4. Отметьте наблюдения, напишите молекулярные и сокращенные ионные уравнения реакций. Как опытным путем определить нахождение растворов ортофосфата натрия, хлорида натрия, нитрата натрия в пробирках № 1, № 2, № 3? Отметьте наблюдения, напишите молекулярные и сокращенные ионные уравнения реакций. Имея вещества: азотную кислоту, медную стружку или проволоку, универсальную индикаторную бумагу или метилоранж, докажите опытным путем состав азотной кислоты. Напишите уравнение диссоциации азотной кислоты; молекулярное уравнение для реакции меди с концентрированной азотной кислотой и уравнения электронного баланса, определите окислитель и восстановитель. Получите раствор нитрата меди разными способами, имея вещества: азотную кислоту, оксид меди, основной карбонат меди или карбонат гидроксомеди(II). Напишите молекулярные, полные и сокращенные ионные уравнения химических реакций. Отметьте признаки химических реакций. 1. Укажите уравнение реакции, где выпадает желтый осадок. 2. Ионное уравнение реакции, в которой образуется белый творожистый осадок, – это: 3. Для доказательства наличия нитрат-иона в нитратах надо взять: а) соляную кислоту и цинк; б) серную кислоту и хлорид натрия; в) серную кислоту и медь. 4. Реактивом на хлорид-ион является: а) медь и серная кислота; б) нитрат серебра; 5. В уравнении реакции, схема которой HNO3 + Cu —> Cu(NO3)2 + NO2 + H2O, перед окислителем надо поставить коэффициент: 6. Основная и кислая соли соответствуют парам: Ответы. 1-а; 2-б; 3-в; 4-б; 5-б; 6-в. Определение минеральных удобрений Методическая разработка этой практической работы состоит из трех частей: теория, практикум, контроль. В теоретической части даны общие сведения по качественному определению катионов и анионов, входящих в состав минеральных удобрений. В практикуме приведены примеры семи минеральных удобрений с описанием их характерных признаков, а также даны уравнения качественных реакций. В тексте вместо точек и знака вопроса надо вставить подходящие по смыслу ответы. Для выполнения практической работы по усмотрению учителя достаточно взять четыре удобрения. Контроль знаний учащихся состоит из тестовых заданий по определению формул удобрений, которые даны в этой практической работе. 1. Реактивом на хлорид-ион является нитрат серебра. Реакция идет с образованием белого творожистого осадка: Ag + + Cl – = AgCl. 2. Ион аммония можно обнаружить с помощью щелочи. При нагревании раствора соли аммония с раствором щелочи выделяется аммиак, который имеет резкий характерный запах: NH + 4+ OH – = NH3 + H2O. Можно также для определения иона аммония воспользоваться смоченной водой красной лакмусовой бумажкой, универсальной индикаторной или фенолфталеиновой полоской бумаги. Бумажку надо подержать над парами, выделяющимися из пробирки. Красный лакмус синеет, универсальный индикатор становится фиолетовым, а фенолфталеин малиновым. 3. Для определения нитрат-ионов к раствору соли добавляют стружку или кусочки меди, затем приливают концентрированную серную кислоту и нагревают. Через некоторое время начинает выделяться газ бурого цвета с неприятным запахом. Выделение бурого газа NO2 указывает на присутствие ионов . NaNO3 + H2SO4 NaHSO4 + HNO3, 4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O. 4. Реактивом на фосфат-ион является нитрат серебра. При его добавлении к раствору фосфата выпадает желтый осадок фосфата серебра: 3Ag + + PO 3- 4= Ag3PO4. 5. Реактивом на сульфат-ион является хлорид бария. Выпадает белый молочный осадок сульфата бария, нерастворимый в уксусной кислоте: Ba 2+ + SO 2- 4= BaSO4. 1. Сильвинит (NaCl•KCl ), розовые кристаллы, растворимость в воде хорошая. Пламя окрашивается в желтый цвет. При рассмотрении пламени через синее стекло заметно фиолетовое окрашивание. С …….. (название реактива) дает белый осадок …… (название соли). 2. Нитрат аммония NH4NO3, или …….. (название удобрения), белые кристаллы, хорошо растворимые в воде. С серной кислотой и медью выделяется бурый газ …. (название вещества). С раствором ……. (название реактива) при нагревании ощущается запах аммиака, его пары окрашивают красный лакмус в ……. цвет. NH4NO3 + H2SO4 NH4HSO4 + HNO3, NH4NO3 + ? —> NH3 + H2O + NaNO3. 3. Нитрат калия (KNO3), или …… (название удобрения), с H2SO4 и ……… (название вещества) дает бурый газ. Пламя окрашивается в фиолетовый цвет. KNO3 + H2SO4 KHSO4 + HNO3, 4. Хлорид аммония NH4Cl c раствором ……. (название реактива) при нагревании образует аммиак, его пары окрашивают красный лакмус в синий цвет. С …… (название аниона реактива) серебра дает белый творожистый осадок …… (название осадка). NH4Cl + ? = NH4NO3 + AgCl, NH4Cl + ? = NH3 + H2O + NaCl. 5. Сульфат аммония (NH4)2SO4 c раствором щелочи при нагревании образует аммиак, его пары окрашивают красный лакмус в синий цвет. С …….. (название реактива) дает белый молочный осадок ……. (название осадка). (NH4)2SO4 + 2NaOH = 2NH3 + 2H2O + ? , 6. Нитрат натрия NaNO3, или …… (название удобрения), белые кристаллы, растворимость в воде хорошая, с H2SO4 и Cu дает бурый газ. Пламя окрашивается в желтый цвет. NaNO3 + H2SO4 NaHSO4 + ? , 7. Дигидрофосфат кальция Ca(H2PO4)2, или …… (название удобрения), серый мелкозернистый порошок или гранулы, плохо растворяется в воде, с ….. (название реактива) дает ….. (указать цвет) осадок ……… (название вещества) AgН2PO4. 1. Розовые кристаллы, хорошо растворимы в воде, окрашивают пламя в желтый цвет; при взаимодействии с AgNO3 выпадает белый осадок – это: 2. Кристаллы хорошо растворимы в воде; в реакции с H2SO4 и медью выделяется бурый газ, с раствором щелочи при нагревании дает аммиак, пары которого окрашивают красный лакмус в синий цвет, – это: 3. Светлые кристаллы, хорошо растворимы в воде; при взаимодействии с H2SO4 и Cu выделяется бурый газ; пламя окрашивает в фиолетовый цвет – это: 4. Кристаллы хорошо растворимы в воде; с нитратом серебра дает белый осадок, c щелочью при нагревании дает аммиак, пары которого окрашивают красный лакмус в синий цвет, – это: 5. Светлые кристаллы, хорошо растворимы в воде; с BaCl2 дает белый молочный осадок, c щелочью дает аммиак, пары которого окрашивают красный лакмус в синий цвет, – это: 6. Светлые кристаллы, хорошо растворимые в воде; при взаимодействии с H2SO4 и Cu дает бурый газ, пламя окрашивает в желтый цвет – это: 7. Серый мелкозернистый порошок или гранулы, растворимость в воде плохая, с раствором нитрата серебра дает желтый осадок – это:
- 📽️ Видео
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На уроке будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакции ионного обмена — это один из видов химических реакций. Правила, условия протекания и примеры
Реакции ионного обмена — это процессы, которые протекают между сложными веществами. Они должны сопровождаться появлением определенного результата: выпадением осадка, выделением газообразного соединения, образованием мало диссоциируемого вещества (например, воды).
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Понятие о реакции
Курс органической химии рассматривает взаимодействия между соединениями, которые необходимы для жизнедеятельности человека и животных: белками, жирами, углеводами. Химическими принято называть такие процессы, которые протекают между веществами с получением иных соединений, отличающихся от исходных по свойствам и составу.

Реакции ионного обмена — это типичный пример химических процессов, так как они сопровождаются изменением окраски, появлением газа, выпадением осадка.
Реагентами именуют исходные соединения, а продуктами – конечные соединения.
Движущей силой процесса является природа реагентов, особенности продуктов, концентрация реагирующих компонентов, температура, давление.

Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Особенности взаимодействий
Реакции ионного обмена — это взаимодействие между веществами, взятыми в растворах. Как любые иные процессы химической природы, они протекают с выделением либо поглощением тепла, изменением окраски, агрегатного состояния.
В переводе с латинского языка «реакция» означает «ответное действие, отпор».
Именно поэтому реакции ионного обмена — это ответ одних веществ на атаку других.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Условия протекания
Среди тех факторов, которые необходимы для химического взаимодействия, выделяют:
- реагирующие соединения должны соприкасаться в максимальной степени;
- в некоторых случаях требуется повышение температуры;
- часть взаимодействий возможна только при воздействии электричества либо ультрафиолетового излучения.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Варианты классификации реакций
Сложно все процессы, сопровождающиеся изменением состава и свойств соединений, объединить в одну классификацию.
По возможности протекания процессов в прямом и обратном направлении неорганические и органические процессы делят на две группы.
Необратимо протекает реакция ионного обмена между растворами растворимых соединений в том случае, когда между ними образуется нерастворимый продукт. Это применяется в аналитической химии для качественного определения катионов (анионов) в смеси растворов.
К примеру, для обнаружения катионов бария (Ba2+) используют раствор, содержащий сульфат анион (SO4 2-).
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Пример ионных уравнений, сопровождающихся выпадением осадка
Как правильно составить уравнение процессов, характерных для этого случая? Рассмотрим на примере этой реакции ионного обмена сокращенные ионные уравнения. Данный вопрос входит в курс школьной программы, поэтому заслуживает пристального рассмотрения.
Первым этапом является написание процесса в молекулярном виде.
Чтобы понять, действительно ли необратимо протекает реакция ионного обмена между растворами этих веществ, потребуется таблица растворимости кислот, солей, оснований. Одним из продуктов является сульфат бария (средняя соль), которая является нерастворимым соединением. Следовательно, процесс действительно необратим, сопровождается выпадением осадка.
Вторым этапом является запись полного ионного уравнения. Каждое из исходных соединений, продуктов взаимодействия записывается в виде катионов и анионов.
Ba2++ 2Cl-+2Na+ +SO42-=BaSO4+2Na+ + 2Cl-
В левой и правой частях данного уравнения положительные и отрицательные ионы, которые не связаны в осадок, малодиссоциируемое или газообразное соединение. После их сокращения получаем вариант краткого ионного уравнения.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Пример процесса с образованием газа
Когда еще могут протекать реакции ионного обмена? Примеры с решением, предполагающим образование газообразного вещества, приведем для карбоната. Качественным реактивом на анион CO32- является взаимодействие с катионов водорода. Итогом процесса является образование углекислого газа.
Представим взаимодействие в молекулярном и ионном виде.
Продуктами реакции является углекислый газ и вода, которые не распадаются на ионы. Представим взаимодействие в полном ионном виде.
После сокращения ионов, повторяющихся в левой и правой частях, получаем следующий вид данного процесса:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Получение малодиссоциируемого соединения
Какими еще признаками могут сопровождаться реакции ионного обмена? Примеры с решением приведем для классического процесса нейтрализации между раствором щелочи и кислоты.
Взаимодействие раствора соляной кислоты с гидроксидом натрия сопровождается образованием воды (малодиссоциируемого соединения). Проверить полноту протекания процесса можно с помощью индикатора. Если первоначально к щелочи добавить спиртовой раствор фенолфталеина, по мере добавления к нему соляной кислоты окраска будет исчезать (идет нейтрализация).
В молекулярном виде процесс выглядит следующим образом:
Краткое ионное уравнение отражает процесс нейтрализации:
Видео:Как понять что вещество выпадает в осадок или образуется газСкачать

Заключение
В отличие от других разновидностей химических процессов, ионный обмен происходит только между растворами сложных соединений. Также среди обязательных условий, которые связаны с подобными процессами, отметим их необратимость. В тех случаях, когда среди продуктов есть малодиссоциируемое соединение, газообразное вещество, осадок, то можно говорить о полноте протекания процесса.
Если в случае замещения у соединений меняются степени окисления, то в случае ионного обмена валентное состояние атомов не меняется. Такие процессы протекают между сложными веществами: солями, кислотами, основаниями, оксидами.
Частным случаем таких взаимодействий является нейтрализация между щелочью и кислотой. Они подчиняются законам химического равновесия, идут в том направлении, где одно из соединений удаляют из реакционной сферы в летучем, газообразном виде, или как малодиссоциируемое вещество.
Химическая реакция является сложным процессом, который предполагает превращение одних веществ в другие, которые отличаются от исходных по строению, составу. Только при наличии одного из трех признаков, перечисленных выше, можно вести речь о полноте протекания взаимодействия.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Практикум по химии
 |
| Ответы. 1-а; 2-в; 3-б; 4-г; 5-в; 6-в. |
Решение экспериментальных задач по теме “Азот и фосфор”
Учащиеся при изучении нового материала по теме “Азот и фосфор” выполняют ряд опытов, касающихся получения аммиака, определения нитратов, фосфатов, солей аммония, приобретают определенные навыки и умения. В данной методической разработке приведены шесть заданий. Для выполнения практической работы достаточно трех заданий: одно – на получение вещества, два – по распознаванию веществ. При выполнении практической работы учащимся можно предложить задания в форме, которая облегчит им оформление отчета (см. задания 1, 2). (Ответы приведены для учителя.)
Получите аммиак и опытным путем докажите его наличие.
а) Получение аммиака.
Смесь равных по объему порций твердого хлорида аммония и порошка гидроксида кальция нагрейте в пробирке с газоотводной трубкой. При этом будет выделяться аммиак, который надо собрать в другую сухую пробирку, расположенную отверстием …. (почему?).
Написать уравнение реакции получения аммиака.
б) Определение аммиака.
Можно определить по запаху ………… (название вещества), а также по изменению цвета лакмуса или фенолфталеина. При растворении аммиака в воде образуется ……. (название основания), поэтому лакмусовая бумажка .……. (указать цвет), а бесцветный фенолфталеин становится …………. (указать цвет).
Вместо точек вставить слова по смыслу. Написать уравнение реакции.

* Аммиаком пахнет имеющийся в домашней аптечке нашатырный спирт – водный раствор аммиака. – Прим. ред.
Получите нитрат меди двумя различными способами, имея в наличии следующие вещества: концентрированную азотную кислоту, медную стружку, сульфат меди(II), гидроксид натрия. Напишите уравнения химических реакций в молекулярном виде, отметьте изменения. В 1-м способе для окислительно-восстановительной реакции напишите уравнения электронного баланса, определите окислитель и восстановитель. Во 2-м способе напишите сокращенные ионные уравнения реакций.
1-й с п о с о б. Медь + азотная кислота. Слегка нагреваем содержимое пробирки. Бесцветный раствор становится ….. (указать цвет), т.к. образуется ….. (название вещества); выделяется газ …….. цвета с неприятным запахом, это – ……. (название вещества).
2-й с п о с о б. При взаимодействии сульфата меди(II) с гидроксидом натрия получается осадок ….. цвета, это – …… (название вещества). К нему приливаем азотную кислоту до полного растворения осадка . (название осадка). Образуется прозрачный голубой раствор …… (название соли).

Докажите опытным путем, что в состав сульфата аммония входят ионы NH4 + и SO 2- 4. Отметьте наблюдения, напишите молекулярные и сокращенные ионные уравнения реакций.

Как опытным путем определить нахождение растворов ортофосфата натрия, хлорида натрия, нитрата натрия в пробирках № 1, № 2, № 3? Отметьте наблюдения, напишите молекулярные и сокращенные ионные уравнения реакций.
Имея вещества: азотную кислоту, медную стружку или проволоку, универсальную индикаторную бумагу или метилоранж, докажите опытным путем состав азотной кислоты. Напишите уравнение диссоциации азотной кислоты; молекулярное уравнение для реакции меди с концентрированной азотной кислотой и уравнения электронного баланса, определите окислитель и восстановитель.
Получите раствор нитрата меди разными способами, имея вещества: азотную кислоту, оксид меди, основной карбонат меди или карбонат гидроксомеди(II). Напишите молекулярные, полные и сокращенные ионные уравнения химических реакций. Отметьте признаки химических реакций.

1. Укажите уравнение реакции, где выпадает желтый осадок.
2. Ионное уравнение реакции, в которой образуется белый творожистый осадок, – это:
3. Для доказательства наличия нитрат-иона в нитратах надо взять:
а) соляную кислоту и цинк;
б) серную кислоту и хлорид натрия;
в) серную кислоту и медь.
4. Реактивом на хлорид-ион является:
а) медь и серная кислота;
б) нитрат серебра;
5. В уравнении реакции, схема которой
HNO3 + Cu —> Cu(NO3)2 + NO2 
перед окислителем надо поставить коэффициент:
6. Основная и кислая соли соответствуют парам:
Ответы. 1-а; 2-б; 3-в; 4-б; 5-б; 6-в.
Определение минеральных удобрений
Методическая разработка этой практической работы состоит из трех частей: теория, практикум, контроль. В теоретической части даны общие сведения по качественному определению катионов и анионов, входящих в состав минеральных удобрений. В практикуме приведены примеры семи минеральных удобрений с описанием их характерных признаков, а также даны уравнения качественных реакций. В тексте вместо точек и знака вопроса надо вставить подходящие по смыслу ответы. Для выполнения практической работы по усмотрению учителя достаточно взять четыре удобрения. Контроль знаний учащихся состоит из тестовых заданий по определению формул удобрений, которые даны в этой практической работе.
1. Реактивом на хлорид-ион является нитрат серебра. Реакция идет с образованием белого творожистого осадка:
Ag + + Cl – = AgCl
2. Ион аммония можно обнаружить с помощью щелочи. При нагревании раствора соли аммония с раствором щелочи выделяется аммиак, который имеет резкий характерный запах:
NH + 4+ OH – = NH3 
Можно также для определения иона аммония воспользоваться смоченной водой красной лакмусовой бумажкой, универсальной индикаторной или фенолфталеиновой полоской бумаги. Бумажку надо подержать над парами, выделяющимися из пробирки. Красный лакмус синеет, универсальный индикатор становится фиолетовым, а фенолфталеин малиновым.
3. Для определения нитрат-ионов к раствору соли добавляют стружку или кусочки меди, затем приливают концентрированную серную кислоту и нагревают. Через некоторое время начинает выделяться газ бурого цвета с неприятным запахом. Выделение бурого газа NO2 указывает на присутствие ионов .
NaNO3 + H2SO4 
4HNO3 + Cu = Cu(NO3)2 + 2NO2 
4. Реактивом на фосфат-ион является нитрат серебра. При его добавлении к раствору фосфата выпадает желтый осадок фосфата серебра:
3Ag + + PO 3- 4= Ag3PO4
5. Реактивом на сульфат-ион является хлорид бария. Выпадает белый молочный осадок сульфата бария, нерастворимый в уксусной кислоте:
Ba 2+ + SO 2- 4= BaSO4
1. Сильвинит (NaCl•KCl ), розовые кристаллы, растворимость в воде хорошая. Пламя окрашивается в желтый цвет. При рассмотрении пламени через синее стекло заметно фиолетовое окрашивание. С …….. (название реактива) дает белый осадок …… (название соли).
2. Нитрат аммония NH4NO3, или …….. (название удобрения), белые кристаллы, хорошо растворимые в воде. С серной кислотой и медью выделяется бурый газ …. (название вещества). С раствором ……. (название реактива) при нагревании ощущается запах аммиака, его пары окрашивают красный лакмус в ……. цвет.
NH4NO3 + H2SO4 
NH4NO3 + ? —> NH3 
3. Нитрат калия (KNO3), или …… (название удобрения), с H2SO4 и ……… (название вещества) дает бурый газ. Пламя окрашивается в фиолетовый цвет.
KNO3 + H2SO4 
4. Хлорид аммония NH4Cl c раствором ……. (название реактива) при нагревании образует аммиак, его пары окрашивают красный лакмус в синий цвет. С …… (название аниона реактива) серебра дает белый творожистый осадок …… (название осадка).
NH4Cl + ? = NH4NO3 + AgCl
NH4Cl + ? = NH3 
5. Сульфат аммония (NH4)2SO4 c раствором щелочи при нагревании образует аммиак, его пары окрашивают красный лакмус в синий цвет. С …….. (название реактива) дает белый молочный осадок ……. (название осадка).
(NH4)2SO4 + 2NaOH = 2NH3 
6. Нитрат натрия NaNO3, или …… (название удобрения), белые кристаллы, растворимость в воде хорошая, с H2SO4 и Cu дает бурый газ. Пламя окрашивается в желтый цвет.
NaNO3 + H2SO4 
7. Дигидрофосфат кальция Ca(H2PO4)2, или …… (название удобрения), серый мелкозернистый порошок или гранулы, плохо растворяется в воде, с ….. (название реактива) дает ….. (указать цвет) осадок ……… (название вещества) AgН2PO4.
1. Розовые кристаллы, хорошо растворимы в воде, окрашивают пламя в желтый цвет; при взаимодействии с AgNO3 выпадает белый осадок – это:
2. Кристаллы хорошо растворимы в воде; в реакции с H2SO4 и медью выделяется бурый газ, с раствором щелочи при нагревании дает аммиак, пары которого окрашивают красный лакмус в синий цвет, – это:
3. Светлые кристаллы, хорошо растворимы в воде; при взаимодействии с H2SO4 и Cu выделяется бурый газ; пламя окрашивает в фиолетовый цвет – это:
4. Кристаллы хорошо растворимы в воде; с нитратом серебра дает белый осадок, c щелочью при нагревании дает аммиак, пары которого окрашивают красный лакмус в синий цвет, – это:
5. Светлые кристаллы, хорошо растворимы в воде; с BaCl2 дает белый молочный осадок, c щелочью дает аммиак, пары которого окрашивают красный лакмус в синий цвет, – это:
6. Светлые кристаллы, хорошо растворимые в воде; при взаимодействии с H2SO4 и Cu дает бурый газ, пламя окрашивает в желтый цвет – это:
7. Серый мелкозернистый порошок или гранулы, растворимость в воде плохая, с раствором нитрата серебра дает желтый осадок – это:
📽️ Видео
ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать

8 класс. Составление уравнений химических реакций.Скачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Химия | Молекулярные и ионные уравненияСкачать

Опыты по химии. Признаки химических реакцийСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать





 + 2Na + + 2OH – = Cu(OH)2
+ 2Na + + 2OH – = Cu(OH)2  + 2H + + 2Cl – = 2Na + + 2Cl – + CO2
+ 2H + + 2Cl – = 2Na + + 2Cl – + CO2  + H + + Cl – = Na + + Cl – + CO2
+ H + + Cl – = Na + + Cl – + CO2  = 3K + +
= 3K + + 







