Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
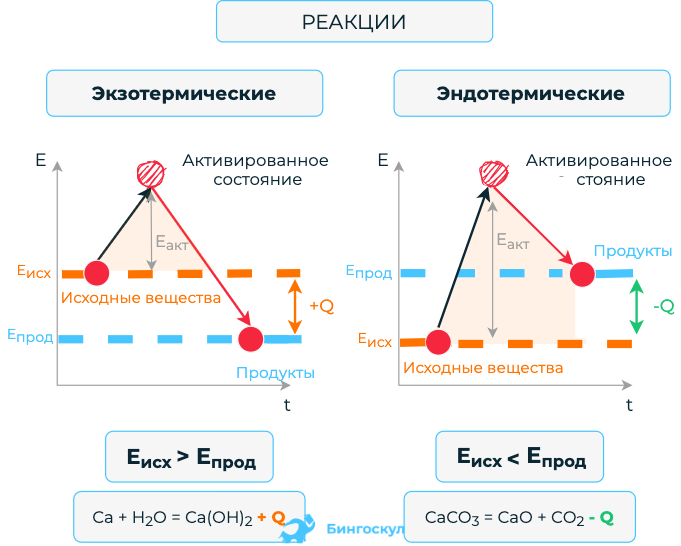
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
- Расчеты теплового эффекта реакции
- Решение:
- Расчёты по термохимическим уравнениям
- Пример 1
- Решение
- Пример 2
- Решение
- Карточка по теме: «Тепловой эффект реакции». Химия – 11 класс.
- Просмотр содержимого документа «Карточка по теме: «Тепловой эффект реакции». Химия – 11 класс.»
- Тепловой эффект химической реакции. Термохимическое уравнение
- Содержание:
- Тепловой эффект химической реакции
- Термохимическое уравнение
- Расчеты по термохимическим уравнениям
- Примеры задач
- Закон Гесса
- 🔍 Видео
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
Решая которое, находим, что:
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Видео:Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Карточка по теме: «Тепловой эффект реакции». Химия – 11 класс.
Карточка с набором задачи для определения теплового эффекта реакции.
Просмотр содержимого документа
«Карточка по теме: «Тепловой эффект реакции». Химия – 11 класс.»
Карточка по теме: «Тепловой эффект реакции». Химия – 11 класс.
1. Определите количество теплоты, необходимое для разложения карбоната кальция в соответствии с термохимическим уравнением:
CaCO3 = CaO + CO2 – 177 кДж, если в результате выделилось 44,8 л (н.у.) углекислого газа.
2. В результате реакции, термохимическое уравнение которой: 3Fe + 2O2 = Fe3O4 + 1200 кДж, выделилось 600 кДж теплоты. Найдите массу (в граммах) окисленного железа.
3. Определите объем метана (в литрах н.у.), при сгорании которого в соответствии с термохимическим уравнением: CH4 + 2O2 = CO2 + 2H2O + 892 кДж, выделится 297,3 кДж теплоты.
4. Определите количество теплоты, которое выделится при образовании 120 г оксида магния, в результате реакции горения магния, с помощью термохимического уравнения: 2Mg + O2 = 2MgO + 1204 кДж
5. В результате реакции, термохимическое уравнение которой: 2C2H2 + 5O2 = 4CO2 + 2H2O + 2610 кДж, выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена.
6. Определите количество теплоты, которая выделится при образовании 90 г воды в соответствии с термохимическим уравнением: CH4 + 2O2 = CO2 + 2H2O + 892 кДж
7. Теплота сгорания серы равна 297 кДж. Определите массу сгоревшей серы, если при этом выделилось 1336,5 кДж теплоты.
8. Теплота сгорания этана равна 1560 кДж. Какое количество тепла выделится при сгорании 2000 л этана.
9. В результате реакции, термохимическое уравнение которой: SO3 + H2O = H2SO4 + 88 кДж, выделилось 264 кДж теплоты. Вычислите массу, образовавшейся при этом серной кислоты.
10. По термохимическому уравнению реакции: Н2 + СI2 = 2HCl + 184 кДж определите, сколько теплоты выделится при сгорании 4 граммов водорода в хлоре. ( Ответ: 368 кДж)
11. При сжигании 48 граммов метана выделилось 2676 кДж теплоты. Найдите тепловой эффект реакции . Уравнение реакции: СН4 + 2О2 = СО2 + 2Н2О + Q ( Ответ: 892 кДж)
12. При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с термохимическим уравнением: C6H12O6 + 6O2 = 6CO2 + 6H2O + Q выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Ответ: 2800 кДж)
Видео:Молярная масса. 8 класс.Скачать

Тепловой эффект химической реакции. Термохимическое уравнение
Содержание:
Когда исходные вещества начинают реагировать друг с другом, то происходит взаимодействие молекул между собой. При этом выделяется большое количество энергии, после образования окончательных продуктов. Во время разрушения кристаллической решетки, поглощается тепло. Оно имеет разные формы: энергию, свет, фотоны, звук.
Видео:Опыты по химии. Обнаружение глюкозы в виноградном соке и медеСкачать

Тепловой эффект химической реакции
Тепловой эффект – это количества тепла или энергии, которое выделилось или поглотилось во время химической реакции, относительно 1 моль вещества. В химии тепловой эффект обозначают символом Q, измеряют в ккал/моль или кДж/моль. Согласно определению выделяют два типа процессов:
- Экзотермические реакции – протекают с выделением тепла, процесс происходит быстро, в конце реакции записывается, как +Q.
- Эндотермические реакции – протекают с поглощением тепла. Чтобы получить конечный продукт, реагенты нагревают. Процессы занимают много времени. В конце реакции обозначаются, как –Q.
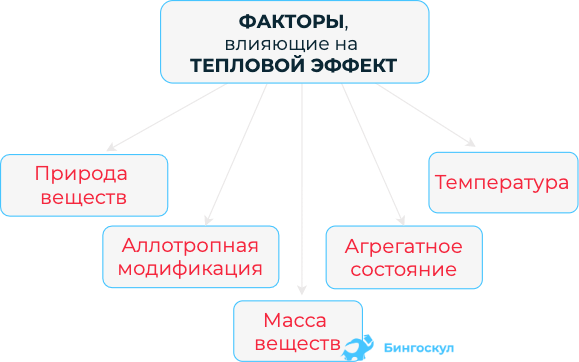
Чем больше прореагирует химического вещества, тем больше выделиться энергии. Следовательно, тепловой эффект зависит от химического вещества в моль вступившего в реакцию.
Экзотермическая реакция
- Выделяется тепло
- H2+Cl2=2HCl+Q
- Поглощается тепло
- N2+O2=2NO-Q
По энергии ионизации реагенты в эндотермической реакции находятся выше оси нулевой энергии, т.е. скорость прямой реакции выше, чем обратной и наоборот, в эндотермических реакциях – скорость обратной реакции выше, чем прямой.
Видео:ГЛЮКОЗА цикло-оксо-формыСкачать

Термохимическое уравнение
Химические уравнения, в которых отображается тепловой эффект называются термохимическими. При записи в скобках обязательно указывают агрегатное состояние вещества: твердое, жидкое, газообразное и другое. Коэффициенты прописываются в условии: дробные или цельные числа.
При расчете учитывают температуру и давление, при которых протекает процесс. Если в условиях задачи не прописаны значения, то их принимают как стандартные: температура 278К, а давление 110,3 кПа.
В конце записи химического уравнения записывают значение Q0, которое берут в справочнике, отдельно для каждого вещества. Энергия представлена в кДж в стандартных условиях. Применяется для расчета по формулам.
Видео:Задачи на ИЗБЫТОК и НЕДОСТАТОК | Самое простое объяснениеСкачать

Расчеты по термохимическим уравнениям
Термохимические уравнения записываются в готовом виде с коэффициентами, представленной энергией. Целью задачи обычно стоит выяснить массу прореагировавшего вещества или выяснить потраченную энергию до десятых.
Для правильного расчета необходимо знать правила составления пропорции и формулу для расчета химического количества вещества в 1 моле.
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Примеры задач
Задача 1
45 г глюкозы (С6Н12О6) подвергли обработке избытком кислорода, в результате чего выделилось 700 кДж энергии. Выясните значение теплового эффекта? Реакция протекала по следующей формуле:
Найдем химическое количество глюкозы:
Получается, что при взаимодействии 0,25 моль вещества образуется 700 кДж энергии. Тепловой эффект приравнивают к значению 1 моль. Следовательно, составим пропорцию:
0,25 моль – 700 кДж
Q = (1* 700) : 0,25 = 700 : 0,25 = 2800 кДж
Задача 2
Представлено термохимическое уравнение, в процессе которого выделилось 3330 кДж энергии, образовалось 68 г Al2O3.Рассчитайте какое количества тепла выделилось, уравнение имеет следующий вид:
Найдем химическое количество оксида алюминия(III):
Исходя из исходного уравнения, для получения 4 моль оксида алюминия(III) расходуется 3330 кДж энергии, для того, чтобы выяснить, сколько выделяется тепла для 68 г, нужно составить пропорцию:
4 моль – 3330 кДж
0,667 моль – Q кДж
Q = (0,667 * 3330) : 4 = 2,221 : 4 = 555 кДж;
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Закон Гесса
В 1840 году русский ученый описал закон термохимии, который до сих пор используется. Его называют законом Гесса:
- Тепловой эффект зависит от агрегатного состояния начальных и конечных продуктов, промежуточные стадии, не влияют.
Это правило помогает узнать тепловой эффект промежуточных стадий. Он будет равен разнице между начальным и конечным значением. По сумме переходных реакций выясняют общий тепловой эффект.
Тепловой эффект химических реакций
Количество теплоты, которые выделяется или поглощается в результате реакции, называют тепловым эффектом данной реакции.
- обычно обозначают Q
Qp = Qкон. — Qисх.
🔍 Видео
Закон сохранения массы веществ. 8 класс.Скачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Количество вещества. Моль. Число Авогадро. 8 класс.Скачать

Определение массовых долей элементов в соединениях. 8 класс.Скачать

САМЫЙ ПОДРОБНЫЙ РАЗБОР Варианта №1 из сборника Добротина | ЕГЭ по химии 2024 | Екатерина СтрогановаСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Глюкоза строение, свойства, применение | Химия 10 класс #38 | ИнфоурокСкачать

Моносахариды. Глюкоза. 11 класс.Скачать

Свойства глюкозы. 11 класс.Скачать