Химия | 10 — 11 классы
Какое количество теплоты выделится при образовании 2 моль этанола согласно термохимическому уравнению : C2H4 (г) + H2O(ж)↔ C2H5OH (ж) ∆H = — 44 кДж ?
C2H4(г) + 302(г) = 2Co2(г) + 2H20(г) + 1400кДж
Из этой реакции видно, что при сгорании 1 моля этилена выделяется 1400кДж энергии,
теперьнам надо рассчитать какое количество молей у нас есть,
этилен — это газ, а значит при н.
У. моль этилена занимает 22.
V (пишется так как будто сверху ветер подул налево.
Краешки верхние слегка загнуты налево)
1400кДж * 9 моль = 12600 кДж теплоты
Ответ : 12600 кДж теплоты
- Термохимическое уравнение реакции горения этилена : С2Н4 + 3О2→ 2СО2 + 2Н2О + 1400 кДж?
- При образовании 1 моль хлороводорода из простых веществ выделяется 92 кДж теплоты?
- При сгорании фосфора в количестве 1 моль образуется 746 кДж теплоты?
- Помогите пожалуйста?
- Дано термохимическое уравнение синтеза аммиака N2 + 3H2 — — — 2NH3 + 92 кдж рассчитайте сколько теплоты выделится при образовании 10 моль?
- Составьте термохимическое уравнение реакции горения СО, если при сгорании 0, 4 моль его выделилось 113, 76 кДж теплоты?
- Сколько моль кислорода вступило в реакцию, если согласно термохимическому уравнению горения водорода 2Н2 + О2 = 2Н2О + 572 кДж, выделилось 1144 кДж теплоты?
- Определите количество теплоты, которое выделится при образовании 150 г К2O в результате реакции горения калия, с помощью термохимического уравнения?
- Определите массу угля, вступившего в реакцию, термохимическое уравнение которойC + O2 = CO2 + 404 кДж, если при этом выделилось теплоты 1608 кДж / моль?
- Составьте термохимическое уравнение образования воды (жидкой) из простых веществ, если известно, что при образовании 1 моля во — ды выделяется 286 кДж теплоты?
- При получении 2 моль этанола согласно термохимическому уравнению c2h4 h2o 44 кдж выделяется
- Тренировочный вариант №2 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года
- 🎥 Видео
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Термохимическое уравнение реакции горения этилена : С2Н4 + 3О2→ 2СО2 + 2Н2О + 1400 кДж?
Термохимическое уравнение реакции горения этилена : С2Н4 + 3О2→ 2СО2 + 2Н2О + 1400 кДж.
Какое количество теплоты выделится, если в реакцию вступило 1 моль кислорода?
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

При образовании 1 моль хлороводорода из простых веществ выделяется 92 кДж теплоты?
При образовании 1 моль хлороводорода из простых веществ выделяется 92 кДж теплоты.
Составить термохимическое уравнение.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

При сгорании фосфора в количестве 1 моль образуется 746 кДж теплоты?
При сгорании фосфора в количестве 1 моль образуется 746 кДж теплоты.
Запишите термохимическое уравнение /.
Видео:Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Помогите пожалуйста?
Согласно термохимическому уравнению реакции CH4 + 2O2 = CO2 + 2H2O + 802 кДж определите количество теплоты, выделившейся при сжигании 24 г метана.
2. По термохимическому уравнению H2 + Cl2 = 2HCl + 184, 36 кДж рассчитайте, какой объем затрачен на образование хлороводорода (при н.
У. ), если при этом выделилось 921, 8 кДж теплоты.
Желательно с пояснением, если можно).
Видео:Окисление этанола оксидом меди (II). Опыт 3Скачать

Дано термохимическое уравнение синтеза аммиака N2 + 3H2 — — — 2NH3 + 92 кдж рассчитайте сколько теплоты выделится при образовании 10 моль?
Дано термохимическое уравнение синтеза аммиака N2 + 3H2 — — — 2NH3 + 92 кдж рассчитайте сколько теплоты выделится при образовании 10 моль.
Видео:Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

Составьте термохимическое уравнение реакции горения СО, если при сгорании 0, 4 моль его выделилось 113, 76 кДж теплоты?
Составьте термохимическое уравнение реакции горения СО, если при сгорании 0, 4 моль его выделилось 113, 76 кДж теплоты.
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Сколько моль кислорода вступило в реакцию, если согласно термохимическому уравнению горения водорода 2Н2 + О2 = 2Н2О + 572 кДж, выделилось 1144 кДж теплоты?
Сколько моль кислорода вступило в реакцию, если согласно термохимическому уравнению горения водорода 2Н2 + О2 = 2Н2О + 572 кДж, выделилось 1144 кДж теплоты?
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Определите количество теплоты, которое выделится при образовании 150 г К2O в результате реакции горения калия, с помощью термохимического уравнения?
Определите количество теплоты, которое выделится при образовании 150 г К2O в результате реакции горения калия, с помощью термохимического уравнения.
4 К + O2 = 2К2O + 1803 кДж 2.
В результате горения 48 г метана выделилось 2406 кДж теплоты.
Составьте термохимическое уравнение этой реакции.
Видео:Физика 8 кл(2019г)Пер §10 Упр 9 № 2 . Какое количество теплоты выделяется при полном сгорании древесСкачать
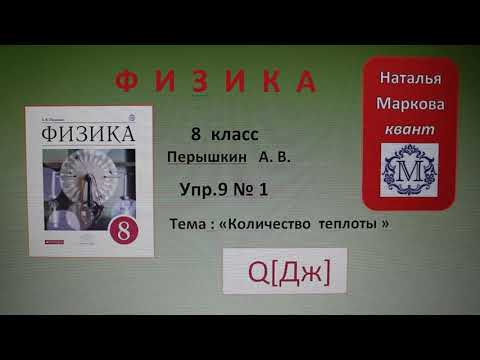
Определите массу угля, вступившего в реакцию, термохимическое уравнение которойC + O2 = CO2 + 404 кДж, если при этом выделилось теплоты 1608 кДж / моль?
Определите массу угля, вступившего в реакцию, термохимическое уравнение которойC + O2 = CO2 + 404 кДж, если при этом выделилось теплоты 1608 кДж / моль.
Видео:Гибридизация - смысл. Разбор 10 молекул:CH4, NH3, H2O, C2H4, BCl3, SO2, SO3, BeCl2, CO2, C2H2.Скачать

Составьте термохимическое уравнение образования воды (жидкой) из простых веществ, если известно, что при образовании 1 моля во — ды выделяется 286 кДж теплоты?
Составьте термохимическое уравнение образования воды (жидкой) из простых веществ, если известно, что при образовании 1 моля во — ды выделяется 286 кДж теплоты.
Вы открыли страницу вопроса Какое количество теплоты выделится при образовании 2 моль этанола согласно термохимическому уравнению : C2H4 (г) + H2O(ж)↔ C2H5OH (ж) ∆H = — 44 кДж ?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 10 — 11 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
Кислород Электроотрицательность идет сверху вниз. Элементы в одной группе.
Кислород : ) Большая электроотрицательность , чем у кислорода , только у фтора Ответ 1.
Сначала подождать пока глина осядет, потом магнитом убрать железные опилки, древесные опилки всплывут и их можно будет убрать или профильтровать а потом просто слить воду и глина останется(если нет то опять профильтровать).
Решение смотри на фото.
1) 1200 × 0. 12 = 144 г (K3PO4) 12% = 144г 82% = х = 984г (воды) 984г Х в н. У. H2O(ж) — — >H2O(г) 18 22. 4 Х = 1224, 53 л 2) 3Cu(CH3COO)2 + 2K3PO4 = Cu3(PO4)2 + 6CH3COOK 3 + 2 + 1 + 6 = 12.
А) 2 — метилбутан б) 3 — метилгексан в) 2, 3 — диметилбутан г) 5 — метил — 4 — этилгептан д) 2, 2, 3, 4 — тетраметилпентан е) 3, 3, 4, 5 — тетраметилгексан.
Поскольку натрий находится в 3 периоде, то у него будет 3 электронных слоя. Они будут заполнены соответственно )2)8)1. Оформляя графическую формулу, можно заметить, что на 3s уровне остаётся один неспаренный электрон. Оформим электронную формулу .
1)Задача на фотографии 2) Это название относится к Ca(OH)2. 3) 2 — ая фотография, на ней решение смотри. 4) Дано : w (NaF) = 10% w (MgCl2) = 10% m (MgF2) = 6, 2 г Найти : m (NaF) и m (MgCl2) — ? Решение : MgCl2 + 2NaF — MgF2 + 2NaCl M (MgF2) = 24 ..
H2S — ковалентная полярная Cu — металлическая LiCl2 — ионная O2 — ковалентная неполярная.
Дано : Q = 33520кдж — — — — — — — — — — — — — — — — m(C) — ? Xg 33520кдж C + O2 — — >CO2 + 402. 24 кдж Mr(C) = 12 (при сгорании 1 моль углерода выделяется Q = 402. 24кдж) m(1 моль С) = 12г 12 г — 402, 24 кдж хг — 33520 кдж х = 12 * 33520 / 402, 24..
Видео:Разложение гидроксида меди II (Cu(OH)2 = CuO + H2O)Скачать

При получении 2 моль этанола согласно термохимическому уравнению c2h4 h2o 44 кдж выделяется
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Приведите примеры реакций, протекающих без изменения элементного состава простых веществ.
Превращение аллотропных модификацый углерода: C (графит) ⇄ C (алмаз)
Превращение аллотропных модификаций форфора: P (белый) ⇄ P (красный)
Превращение аллотропных модификаций олова: Sn (белый) ⇄ Sn (серое)
Как называются такие вещества? Аллотропными модификациями.
Задание 2
Приведите примеры реакций, протекающих без изменения качественного, но с изменением количественного состава простых веществ. Аллотропное видоизменение кислорода: 3O2 ⇄ 2O3
Задание 3
Приведите примеры реакций, протекающих без изменения качественного и с изменением количественного состава сложных веществ.
Реакция гидрирования этилена: C2H4 + H2 t, кат. ⟶ C2H6
Пирролиз метана: CH4 t ⟶ C + 2H2
CH4 t ⟶ C2H2 + 2H2
Реакция окисления оксида серы (IV) кислородом до оксида серы (VI): 2SO2 + O2 ⇄ 2SO 3
Задание 4
Как классифицируют реакции по числу и составу реагентов и продуктов? Реакции соединения, разложения, замещения и обмена.
Реакции соединения ― реакции, в результате которых из двух и более веществ образуется одно сложное вещество.
Реакции разложения ― реакции, в результате которых из одного сложного вещества образуется два или несколько новых веществ.
Реакции замещения ― реакции, в результате которых атомы простого вещества замещают атомы другого элемента в сложном веществе. Реакции обмена ― реакции, в результате которых два сложных вещества обмениваются своими составными частями.
Задание 5
Что такое реакции разложения? Реакции разложения ― реакции, в результате которых из одного сложного вещества образуется два или несколько новых веществ.
С каким тепловым эффектом они протекают? Реакции разложения относятся, как правило, к эндотермическим реакциям.
Задание 6
Запишите термохимическое уравнение реакции горения оксида углерода (II), если известно, что при сгорании 112 л этого газа (н.у.) выделяется 141,5 кДж теплоты. Химическое уравнение: 2СO + О2 = 2СО2
По условию задачи с 112 л СO выделяется 141,5 кДж теплоты,
по химическому уравнению с 44,8 л (2 моль) СO ― х кДж теплоты.
х= 44,8 л ● 141,5 кДж : 112 л=56,6 кДж
Запишем термохимическое уравнение:
2СO (г) + О2 (г) = 2CO2 (г) + 56,6 кДж
Задание 7
Рассчитайте теплоту (кДж), полученную при горении 5,6 л ацетилена (н.у.) согласно термохимическому уравнению реакции:
2C2H2 + 5O2 ⟶ 4CO2↑ + 2H2O + 2610 кДж
По химическому уравнению с 44,8 л (2 моль) С2H2 выделяется 2610 кДж теплоты,
по условию задачи с 5,6 л С 2H2 ― х кДж теплоты.
х=5,6 л ● 2610 кДж : 44,8 л=326,25 кДж
Ответ: Q=326,25 кДж
Задание 8
На примере реакций соединения или разложения покажите относительность их разделения на экзо- или эндотермические процессы. Рассмотрим реакцию. N2 + 3H2 ⇄ 2NH3 + Q
Прямая реакция является реакцией соединения, и протекает с выделением энергии, поэтому относится к экзотермическим реакциям. Обратная реакция является реакцией разложения и протекает с поглощением энергии, поэтому относится к эндотермическим реакциям.
Рассмотрим реакцию. N2 + O2 ⇄ 2NO — Q
Прямая реакция является реакцией соединения, и протекает с поглощение энергии, поэтому относится к эндотермическим реакциям. Обратная реакция является реакцией разложения и протекает с выделением энергии, поэтому относится к экзотермическим реакциям.
Видео:Решение задач на первое начало термодинамики. ТермохимияСкачать

Тренировочный вариант №2 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года
Тренировочная работа №5 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года, вариант 2, вариант ХИ2110502 с ответами и решениями. Ответы на тренировочный вариант Статград №5 ЕГЭ по химии 20.04.2022.
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) S, 2) Al, 3) O, 4) Fe, 5) Te Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1. Какие из указанных элементов имеют в возбуждённом состоянии конфигурацию внешнего уровня ns 2 np 3 nd 1 ? Запишите номера выбранных элементов в порядке возрастания. 2. Из указанного ряда выберите три элемента, принадлежащие одной подгруппе Периодической системы. Расположите их в порядке увеличения полярности связи в водородном соединении. Запишите в поле ответа номера выбранных элементов в нужной последовательности. 3. Из указанного ряда выберите два элемента, которые во многих соединениях проявляют степень окисления +3. Запишите в поле ответа номера выбранных элементов в порядке возрастания. 4. Из предложенного перечня выберите два вещества, в молекулах которых имеется тройная связь. Запишите номера выбранных ответов в порядке возрастания. 5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) амфотерного оксида; Б) сильного основания; В) кислой соли. Запишите в поле ответа выбранные цифры в нужной последовательности. 6. В двух колбах находился раствор сульфида аммония. В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выделился газ и выпал осадок, а во второй выделился газ, а раствор остался прозрачным. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. Запишите в поле ответа выбранные цифры в нужной последовательности. 7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 8. Установите соответствие между исходными веществами, вступающими в реакцию и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 9. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа номера выбранных веществ в нужной последовательности. 10. Установите соответствие между структурной формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 11. Из предложенного перечня выберите два вещества, в молекулах которых есть только σ-связи. 12. Из предложенного перечня выберите все вещества, способные окислять альдегиды. Запишите номера выбранных ответов в порядке возрастания. 13. Из предложенного перечня выберите два вещества, которые реагируют с пропиламином. Запишите номера выбранных ответов в порядке возрастания. 14. Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 15. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 16. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа выбранные цифры в нужной последовательности. 17. Из предложенного перечня выберите все реакции, которые происходят без изменения степеней окисления элементов. 18. Из предложенного перечня выберите все реакции, скорость которых возрастает при увеличении pH среды. Запишите номера выбранных ответов в порядке возрастания. 1) Cl2 + KOH → KCl + KClO + H2O 19. Установите соответствие между схемой реакции и свойством, которое проявляет элемент азот в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности. 20. Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности.
|
















 MnO2 + 2NO2↑
MnO2 + 2NO2↑
 2CH3CHO
2CH3CHO CH3CH=CHC6H5
CH3CH=CHC6H5







