Физика | 10 — 11 классы
При каких условиях для определения параметров состояния газа можно использовать уравнение pV = const?
P1V1 = p2V2 = const.
Такое уравнение можно использовать, когда присутствует изопроцесс, в котором температура = const.
- Какие изменения происходят с параметрами состояния идеального газа при переходе из состояния 1 в состояние 2?
- Получение уравнение состояния идеального газа , используя любые два закона , описывающие изменения состояния идеального газа при одном постоянном параметре?
- Какие макроскопические параметры, описывающие состояние теплового равновесия газа, связывает между собой объединённый газовый закон?
- Какие параметры состояния вы знаете?
- Используя уравнение состояния идеального газа, вычислите по четырем параметрам, представленным в таблице, пятый, неизвестный параметр?
- Какие параметры характеризуют состояние газа?
- Физики, помогите, пожалуйста) как изменится температура газа при его расширении, если его состояние изменяется по закону pV = const(n< ; 1)?
- Уравнение состояния идеального газа?
- Газ в закрытом сосуде находится в равновесном состояние?
- При каких условиях для определения параметров состояния газа можно использовать уравнение pv = const?
- При каких условиях для определения параметров газа можно использовать уравнение pv const
- Как написать хороший ответ?
- Уравнение состояния идеального газа — основные понятия, формулы и определение с примерами
- Уравнение состояния идеального газа
- Уравнение Клапейрона
- Изопроцессы
- Какой процесс называют изотермическим. Закон Бойля — Мариотта
- Какой процесс называют изобарным. Закон Гей-Люссака
- Закон Гей-Люссака
- Изохорный процесс. Закон Шарля
- Закон Шарля
- Пример №1
- Пример №2
- 📽️ Видео
Видео:Уравнение идеального газа: PV = nRT | Газы.Молекулярно-кинетическая теория | Химия (видео 1)Скачать

Какие изменения происходят с параметрами состояния идеального газа при переходе из состояния 1 в состояние 2?
Какие изменения происходят с параметрами состояния идеального газа при переходе из состояния 1 в состояние 2?
Массу газа считать постоянной.
Видео:Эта тема ВСЕГДА встречается на экзамене ЦТ — Изопроцессы (Физика для чайников)Скачать

Получение уравнение состояния идеального газа , используя любые два закона , описывающие изменения состояния идеального газа при одном постоянном параметре?
Получение уравнение состояния идеального газа , используя любые два закона , описывающие изменения состояния идеального газа при одном постоянном параметре.
Видео:Решение графических задач на тему Газовые законыСкачать

Какие макроскопические параметры, описывающие состояние теплового равновесия газа, связывает между собой объединённый газовый закон?
Какие макроскопические параметры, описывающие состояние теплового равновесия газа, связывает между собой объединённый газовый закон?
Видео:Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Какие параметры состояния вы знаете?
Какие параметры состояния вы знаете?
Видео:ЕГЭ. Физика. Уравнение состояния идеального газа. ПрактикаСкачать

Используя уравнение состояния идеального газа, вычислите по четырем параметрам, представленным в таблице, пятый, неизвестный параметр?
Используя уравнение состояния идеального газа, вычислите по четырем параметрам, представленным в таблице, пятый, неизвестный параметр.
Видео:Газовые законы. Изопроцессы | Физика 10 класс #34 | ИнфоурокСкачать

Какие параметры характеризуют состояние газа?
Какие параметры характеризуют состояние газа?
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Физики, помогите, пожалуйста) как изменится температура газа при его расширении, если его состояние изменяется по закону pV = const(n< ; 1)?
Физики, помогите, пожалуйста) как изменится температура газа при его расширении, если его состояние изменяется по закону pV = const(n< ; 1).
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Уравнение состояния идеального газа?
Уравнение состояния идеального газа.
Газовые законы, при одном постоянном параметре, с указанием их названия и единиц измерения.
Видео:Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Газ в закрытом сосуде находится в равновесном состояние?
Газ в закрытом сосуде находится в равновесном состояние.
Назовите параметры, характеризующие состояния газа.
Видео:мкт ИЗОТЕРМИЧЕСКИЙ процесс ИЗОХОРНЫЙ процесс ИЗОБАРНЫЙ процессСкачать

При каких условиях для определения параметров состояния газа можно использовать уравнение pv = const?
При каких условиях для определения параметров состояния газа можно использовать уравнение pv = const?
Перед вами страница с вопросом При каких условиях для определения параметров состояния газа можно использовать уравнение pV = const?, который относится к категории Физика. Уровень сложности соответствует учебной программе для учащихся 10 — 11 классов. Здесь вы найдете не только правильный ответ, но и сможете ознакомиться с вариантами пользователей, а также обсудить тему и выбрать подходящую версию. Если среди найденных ответов не окажется варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском», который откроет все похожие ответы, или создайте собственный вопрос, нажав кнопку в верхней части страницы.
Период колебаний по формуле Томсона : T = 2π·√ (L * C) = 2π·√ (6·10⁻⁶·42·10⁻¹²)≈ 1·10⁻⁸ с Частота : υ = 1 / T = 1 / 1·10⁻⁸ = 1·10⁸ = 100·10⁶ Гц = 100 МГц.
Координата движущегося тела с течением времени меняется по закону x = x0 + v0t + at ^ 2 ^ 2 х = — 1 + 3t — t ^ 2 начальная координата x0 = — 1м Начальная скорость v0 = 3м / с Ускорение a = — 2м / с2 Модуль ускорения |a | = 2м / с2 Координата через 5с..
Короче как — то так : D Писать очень много.
M₁v₁ + m₂v₂ = (m₁ + m₂) u ; u = (m₁v₁ + m₂v₂) / (m₁ + m₂) ; u = (60 кг * 1 м / с + 40 кг * 0 м / с) / (60 кг + 40 кг) = 0, 6 м / с.
M₁ = 60 кг для нашего случая запишем закон сохранения v₁ = 1 м / с импульса : v₂ = 0 m₁v₁ + m₂v₂ = (m₁ + m₂)v ; или, m₂ = 40 кг m₁v₁ = (m₁ + m₂)v ⇒ v = m₁v₁ / (m₁ + m₂) ; ____________ v = 60 * 1 / )60 + 40) = 60 / 100 = 0, 6 м / с ; v — ? Ответ : v ..
Так как система замкнута то количество теплоты отданное более горячей водой будет равно количеству теплоты принятой более холодной. Составляем уравнение теплового баланса, выражаем искомое количество воды.
Ответ : Объяснение : Удельная теплоемкость — это физическая величина, численно равная количеству теплоты, которое необходимо передать (или отнять) единичной массе данного вещества для того, чтобы его температура изменилась на единицу. Обозначается о..
Удельной теплоемкостью вещества называется физическая величина, численно равная количеству теплоты, которое надо подвести к 1 кг вещества чтобы нагреть его на 1 °С. Единица измерения — Дж / (кг * °С) или Дж / (кг * К).
T = S / (v1 + v2) = 200 / (8 + 2) = 20с S(хозяин) = v2 * t = 2 * 20 = 40м. Ответ։ 20с, 40м.
Суммарная скорость составила 8 + 2 = 10 м / с Время когда они встретятся 200 / 10 = 20 с.
Видео:Физика. МКТ: Графики газовых процессов. Центр онлайн-обучения «Фоксфорд»Скачать

При каких условиях для определения параметров газа можно использовать уравнение pv const
Вопрос по физике:
Физика 10 класс,лаб. работа 1,изучение изотермического процесса
1)при каких условиях для определения параметров состояния газа можно использовать уравнение pV=const ?
2) почему при выполнении данной работы процесс изменения объема воздуха можно считать практически изотермическим?
3)что влияет на точность полученных результатов ?
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Физика.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Физика — область естествознания: естественная наука о простейших и вместе с тем наиболее общих законах природы, о материи, её структуре и движении.
Видео:8-класс | Физика | Уравнение состояния идеального газаСкачать

Уравнение состояния идеального газа — основные понятия, формулы и определение с примерами
Содержание:
Уравнение состояния идеального газа:
Уравнения Клапейрона и Менделеева — клапейрона; законы Шарля, Гей-Люссака, Бойля — Мариотта, Авогадро, Дальтона, — пожалуй, такого количества «именных» законов нет ни в одном разделе физики. за каждым из них — кропотливая работа в лабораториях, тщательные измерения, длительные аналитические размышления и точные расчеты. нам намного проще. Мы уже знаем основные положения теории, и «открыть» все вышеупомянутые законы нам не составит труда.
Видео:Физика. 10 класс. Уравнение состояния идеального газаСкачать

Уравнение состояния идеального газа
Давление газа полностью определяется его температурой и концентрацией молекул: p=nkT. Запишем данное уравнение в виде: pV = NkT. Если состав и масса газа известны, число молекул газа можно найти из соотношения
Произведение числа Авогадро 


Обратите внимание! Состояние данного газа некоторой массы однозначно определяется двумя его макроскопическими параметрами; третий параметр можно найти из уравнения Менделеева — Клапейрона.
Уравнение Клапейрона
С помощью уравнения Менделеева — Клапейрона можно установить связь между макроскопическими параметрами газа при его переходе из одного состояния в другое. Пусть газ, имеющий массу m и молярную массу М, переходит из состояния (

Для каждого состояния запишем уравнение Менделеева — Клапейрона: 



Для данного газа некоторой массы отношение произведения давления на объем к температуре газа является неизменным.
Изопроцессы
Процесс, при котором один из макроскопических параметров данного газа некоторой массы остается неизменным, называют изопроцессом. Поскольку состояние газа характеризуется тремя макроскопическими параметрами, возможных изопроцессов тоже три: происходящий при неизменной температуре; происходящий при неизменном давлении; происходящий при неизменном объеме. Рассмотрим их.
Какой процесс называют изотермическим. Закон Бойля — Мариотта
Пузырек воздуха, поднимаясь со дна глубокого водоема, может увеличиться в объеме в несколько раз, при этом давление внутри пузырька падает, поскольку вследствие дополнительного гидростатического давления воды (
Рис. 30.2. Изотермическое сжатие газа. Если медленно опускать поршень, температура газа под поршнем будет оставаться неизменной и равной температуре окружающей среды. Давление газа при этом будет увеличиваться
Изотермический процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменной температуре.
Пусть некий газ переходит из состояния (



Закон Бойля — Мариотта:
Для данного газа некоторой массы произведение давления газа на его объем остается постоянным, если температура газа не изменяется:
Графики изотермических процессов называют изотермами. Как следует из закона Бойля — Мариотта, при неизменной температуре давление газа данной массы обратно пропорционально его объему: 
Какой процесс называют изобарным. Закон Гей-Люссака
Изобарный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном давлении.
Пусть некий газ переходит из состояния (


Рис. 30.4. Изобарное расширение газа. Если газ находится под тяжелым поршнем массой M и площадью S, который может перемещаться практически без трения, то при увеличении температуры объем газа будет увеличиваться, а давление газа будет оставаться неизменным и равным p
Закон Гей-Люссака
Для данного газа некоторой массы отношение объема газа к температуре остается постоянным, если давление газа не изменяется:
Графики изобарных процессов называют изобарами. Как следует из закона Гей-Люссака, при неизменном давлении объем газа данной массы прямо пропорционален его температуре: V = const⋅T. График данной зависимости — прямая, проходящая через начало координат (рис. 30.5, а). По графику видно, что с приближением к абсолютному нулю объем идеального газа должен уменьшиться до нуля. Понятно, что это невозможно, поскольку реальные газы при низких температурах превращаются в жидкости. В координатах p, V и p, T изобары перпендикулярны оси давления (рис. 30.5, б, в).
Изохорный процесс. Закон Шарля
Если газовый баллон сильно нагреется на солнце, давление в нем повысится настолько, что баллон может взорваться. В данном случае имеем дело с изохорным нагреванием.
Изохорный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном объеме.
Пусть некий газ переходит из состояния (


Рис. 30.6. Изохорное нагревание газа. Если газ находится в цилиндре под закрепленным поршнем, то с увеличением температуры давление газа тоже будет увеличиваться. Опыт показывает, что в любой момент времени отношение давления газа к его температуре неизменно:
Закон Шарля
Для данного газа некоторой массы отношение давления газа к его температуре остается постоянным, если объем газа не изменяется:
Графики изохорных процессов называют изохорами. Из закона Шарля следует, что при неизменном объеме давление газа данной массы прямо пропорционально его температуре: p T = ⋅ const . График этой зависимости — прямая, проходящая через начало координат (рис. 30.7, а). В координатах p, V и V, T изохоры перпендикулярны оси объема (рис. 30.7, б, в).
Пример №1
В вертикальной цилиндрической емкости под легкоподвижным поршнем находится 2 моль гелия и 1 моль молекулярного водорода. Температуру смеси увеличили в 2 раза, и весь водород распался на атомы. Во сколько раз увеличился объем смеси газов?
Анализ физической проблемы. Смесь газов находится под легкоподвижным поршнем, поэтому давление смеси не изменяется:
Решение:
Воспользуемся уравнением состояния идеального газа: pV = νRT. Запишем это уравнение для состояний смеси газов до и после распада: 




Ответ: примерно в 2,7 раза.
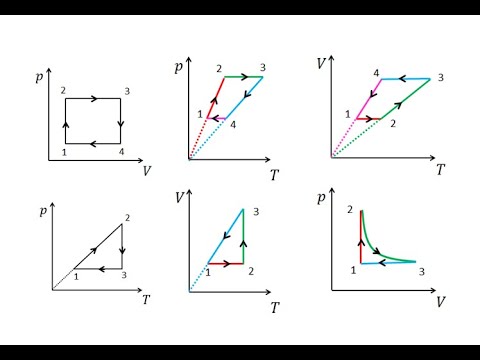
Пример №2
На рис. 1 представлен график изменения состояния идеального газа неизменной массы в координатах V, T. Представьте график данного процесса в координатах p, V и p, T.
Решение:
1. Выясним, какой изопроцесс соответствует каждому участку графика (рис. 1).
Зная законы, которым подчиняются эти изопроцессы, определим, как изменяются макроскопические параметры газа. Участок 1–2: изотермическое расширение; T = const, V ↑, следовательно, по закону Бойля — Мариотта p ↓. Участок 2–3: изохорное нагревание; V = const, T ↑, следовательно, по закону Шарля p ↑ . Участок 3–1: изобарное охлаждение; p = const , T ↓, следовательно, по закону Гей-Люссака V ↓ .
2. Учитывая, что точки 1 и 2 лежат на одной изотерме, точки 1 и 3 — на одной изобаре, а точки 2 и 3 на одной изохоре, и используя результаты анализа, построим график процесса в координатах p, V и p, T (рис. 2)
- Из соотношения p=nkT можно получить ряд важных законов, большинство из которых установлены экспериментально.
- Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона):
— универсальная газовая постоянная.
- Уравнение Клапейрона:
- Законы, которым подчиняются изопроцессы, то есть процессы, при которых один из макроскопических параметров данного газа некоторой массы остается неизменным:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Telegram и логотип telegram являются товарными знаками корпорации Telegram FZ-LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
📽️ Видео
Разбор задач на графики циклических процессовСкачать
Физика Изучение графиков изопроцессовСкачать

Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Изопроцессы. Графики изопроцессов. Закон Дальтона. 2 часть. 10 класс.Скачать

Определение и характеристики идеального газа. Универсальная газовая | Физическая и коллоидная химияСкачать

Урок 157. Изопроцессы и их графики. Частные газовые законыСкачать

Урок 162. Построение графиков изопроцессов в различных координатахСкачать










































 — универсальная газовая постоянная.
— универсальная газовая постоянная.
