Задача 4.
Схема гальванического элемента : Al/Al2(SO4)3//AgNO3/Ag.
Указать анод и катод, написать электродные процессы, суммарное уравнение реакции и рассчитать электродвижущую силу элемента при 298К, если
[A l3+ ] = 0,0001 моль/л, [Аg + ] = 0,1моль/л.
Решение:
Решение:
Серебро, потенциал которого (+0,80 В) более электроположительный, чем у алюминия (-1,66 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Ag + + 1 
Алюминий имеет меньший потенциал (-1,66 В) является анодом, на котором протекает окислительный процесс:
Al 0 — 3 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Al 0 + 3Ag + = 3Ag 0 + Al 3+
Для расчета значения потенциалов, используем уравнение Нернста:
Е = Е 0 + (0,059/n)lgC где
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Е(Ag) = +0,80 + (0,059/1)lg0,1 = +0,74 B;
Е(Al) = -1,66 + (0,059/3)lg0,0001 = -1,74 B.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = +0,74 — (-1,74) = +2,48 B.
Задача 65.
Составить схему гальванического элемента, в котором алюминий будет катодом. Написать электродные процессы, суммарное уравнение процесса.
Решение:
Cхема гальванического элемента, в котором алюминий будет катодом может иметь вид:
Алюминий, потенциал которого (-1,66 В) более электроположительный, чем у магния (-2,38 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Al 3+ + 3 
Магний имеет меньший потенциал (-2,38 В) является анодом, на котором протекает окислительный процесс:
Mg 0 — 2 
Cуммарное уравнение процесса:
3Mg 0 + 2Al 3+ = 3Mg 2+ + 2Al 0
Задача 66.
Составить схему гальванического элемента, в котором протекает реакция: Ag + + Cl – = AgCl. Рассчитать стандартную ЭДС элемента при 25o C, 
Решение.
1. Схема гальванического элемента имеет вид:
Ag|AgCl|Cl – ||Ag + |Ag
2. Электродные процессы:
Правый электрод: Ag + +1 
Левый электрод: AgCl + 1 
Общая реакция: Ag + + Cl – = AgCl; E o = +0,557 В.
3. Рассчитаем энергию Гиббса процесса:
Для расчета 

n — количество электронов, участвующих в процессе, 1 электрон; F — универсальная газовая постоянная, 96485 Кл.моль-1; Eo — окислительно-восстановительный потенциал процесса, +0,557 В.

4. Расчет константы равновесия реакции:
Для расчета используем формулу:
К = exp–
Видео:Разбор схемы гальванического элементаСкачать

Гальванические элементы и их ЭДС
Из двух электродов может быть составлена электрохимическая цепь — гальванический элемент, в которой электрическая энергия вырабатывается за счет протекания электрохимических реакций на электродах. Перенос заряда через границу раздела фаз (электрический ток) в такой системе осуществляется за счет электрохимической реакции, протекающей самопроизвольно. Электрод, на котором происходит электровосстановление, называется катодом, а электрод, на котором происходит электроокисление, называется анодом.
Отдельный электрод в гальваническом элементе иногда называют полуэлементом. Основной электрической характеристикой электрохимической цепи является разность электрических потенциалов между электродами. Соединение электродов внешним проводником приводит к появлению в цепи электрического тока.
Правильно разомкнутая электрохимическая цепь, на концах которой можно измерить электрическую разность потенциалов, всегда должна заканчиваться одинаковыми по своему химическому составу металлами. Обычно это достигается простым подключением к металлам М1 и М2 медных проводов. Включение между двумя металлическими проводниками третьего металлического проводника, согласно закону Вольта, не изменяет разности потенциалов на концах цепи.
Электрохимическая цепь является равновесной при условии, что электрохимическое равновесие наблюдается на каждой фазовой границе, а разность потенциалов на концах цепи Е скомпенсирована разностью потенциалов от внешнего источника тока.
При схематической записи электрохимической цепи:
1. Левый электрод записывается в обратном порядке (вещества, находящиеся в растворе, указываются справа от вертикальной черты, слева указываются вещества, образующие другую фазу, или материал электрода). Правый электрод записывается в обычном порядке согласно правилам схематической записи электродов;
2. Растворы обоих электродов отделяются вертикальной пунктирной линией, если они контактируют друг с другом (диффузионный потенциал не устранен) или двумя пунктирными вертикальными линиями, если диффузионный потенциал между растворами устранен (например, с помощью солевого мостика).
В правильно разомкнутой цепи на концах условной записи элемента записывается один и тот же по природе металл. Для простоты часто в записи цепи его опускают.
Cогласно правилу записи электродной реакции, окисленная форма вещества и электроны записываются слева. Суммарная реакция, протекающая в элементе, является разницей между реакциями на правом и левом электродах. Тогда, если разность потенциалов всего элемента положительна, то суммарная реакция и электрический ток в гальваническом элементе протекает слева направо, если же отрицательно, то – в обратном направлении.
Учитывая, что на катоде происходим электровосстановление, а на аноде – электроокисление, то в гальваническом элементе (при протекании самопроизвольных процессов) катод будет более электроположительным электродом, а анод более электроотрицательным. Если же элемент подключить к внешнему источнику тока и вызвать вынужденные электрохимические процессы (электролиз), то катодом будет более электроотрицательным электродом, а анод – более электроположительным. Во избежание путаницы термины катод и анод чаще употребляют при рассмотрении электролиза, а при рассмотрении гальванических элементов белее употребляют термины «плюс» и «минус» для обозначения катода и анода, соответственно.
Рассмотрим в качестве примера три случая.
1. Оба электрода имеют общий раствор:
Pt, H2(г) | HCl(aq) | AgCl | Ag
На электродах протекают реакции:
(1) AgCl + e 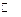
(2) 2H + (aq) + 2 e 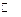
Суммарная реакция, протекающая в элементе
AgCl + 0.5H2(г) 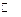
Если ЭДС этого элемента положительна, то суммарная реакция будет протекать в прямом направлении, правый электрод будет более положительным – плюсом (катодом), а левый электрод – более отрицательным – минусом (анодом).
2. Растворы электродов различны и имеют контакт между собой через мембрану (диффузионный потенциал не устранен);
На электродах протекают реакции:
(1) AgCl + e – 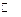
(2) Cd 2+ (aq) + 2 e 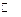
Суммарная реакция, формально протекающая в элементе
AgCl + 1/2Cd 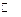
3. Растворы электродов различны и соединены между собой солевым мостиком (диффузионный потенциал устранен).
Pt | H2(г) | HCl(aq) || NaCl(aq) | AgCl | Ag
На электродах протекают реакции:
(1) AgCl + e 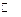
(2) 2H + (aq) + 2 e – 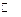
Суммарная реакция, формально протекающая в элементе
AgCl + 1/2H2(г) 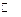
Предельное значение разности электрических потенциалов при токе через элемент, стремящемся к нулю, называется электродвижущей силой (ЭДС) и обозначается E.
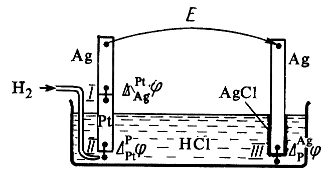
ЭДС гальванического элемента складывается из скачков потенциала на границе всех фаз образующих элемент (рис.4).
Разность потенциалов на концах этой цепи складывается из трех гальвани-потенциалов:
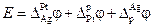
В общем виде в формировании ЭДС гальванического элемента участвуют не только скачки потенциалов между фазами электродов, но и разница потенциалов между металлами образующими электронопроводящую фазу электродов – так называемый контактный потенциал, а также разница потенциалов между фазами растворов электродов – диффузионный потенциал.
Рис. 4. Гальванический элемент, составленный из водородного
и хлоридсеребряного электродов.
Диффузионный потенциал возникает на границе двух растворов из-за различных подвижностей ионов, содержащихся в электродных растворах и/или их концентраций. Гальванический элемент может иметь общий раствор электролита для обоих электродов. В этом случае диффузионный потенциал будет отсутствовать. В других случаях при проведении электрохимических измерений от диффузионного потенциала стараются по возможности избавиться. Существует несколько способов устранения диффузионного потенциала. Наиболее простым является использование для соединения растворов двух электродов солевого мостика, заполненного раствором соли, катионы и анионы которой обладают приблизительно одинаковыми подвижностями (KCl, KNO3).
Контактный потенциал возникает в случае, когда электронопроводящие фазы электродов выполнены из различных металлов. В связи с тем, что в настоящее время нет прямых экспериментальных и расчетных методов определения гальвани-потенциалов на границе раздела фаз в гальваническом элементе, значение Эдс гальванического элемента вычисляют как разность двух условных электродных потенциалов:
где Eп– потенциал правого электрода, Eл – потенциал левого.
Химические цепи
Гальванические элементы первого типа – химические цепи представляют собой элементы, составленные из электродов, на которых протекают различные электрохимические реакции.
В основе работы всякого электрохимического элемента лежат самопроизвольные окислительно-восстановительные реакции, протекающие раздельно: на более отрицательном электроде (аноде) — окисление, на более положительном (катоде) — восстановление.
Соединение электродов внешним проводником приводит к появлению в цепи электрического тока. Например, элемент Даниэля — Якоби составлен из двух электродов первого рода цинкового и медного. Последовательность соединения их изображают схемой:
(1) Cu 2+ (aq) + 2 e – 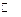
(2) Zn 2+ (aq) + 2 e – 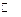
Суммарная реакция, протекающая в элементе
Zn + Cu 2+ (aq) 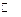
ЭДС этого элемента
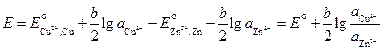
где 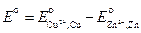
Различают химические цепи с двумя и с одним электролитом. К электрохимическим элементам с двумя электролитами относятся рассмотренный выше элемент Даниэля — Якоби.
Химические цепи с одним электролитом могут быть двух видов.
В цепях первого вида один электрод обратим относительно катиона, другой — относительно аниона. Например, элемент
Cd | CdCl2(aq) | AgCl | Ag
Он используется для определения среднего коэффициента активности электролита CdCl2. Рассчитаем ЭДС этого элемента.
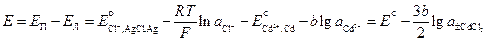
где 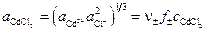
В гальванических элементах второго вида (с одним электролитом) оба электрода обратимы относительно одного из ионов. Примером может служить элемент
Выражение для ЭДС этого элемента равно:
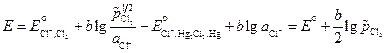
Если создать условия, при которых 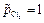
Дата добавления: 2016-01-09 ; просмотров: 2606 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Электроды и гальванические элементыСкачать

Представлена схема гальванического элемента pt h2 hcl agcl напишите уравнения электродных реакций
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || — солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu 2+ + 2e = Cu
Левый электрод: Zn 2+ + 2e = Zn
Общая реакция: Cu 2+ + Zn = Cu + Zn 2+
Потенциал E электрода рассчитывается по формуле Нернста:
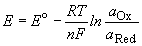
где aOx и aRed — активности окисленной и восстановленной форм вещества, участвующего в полуреакции; E o — стандартный потенциал электрода (при aOx = aRed =1); n — число электронов, участвующих в полуреакции; R — газовая постоянная; T — абсолютная температура; F — постоянная Фарадея. При 25 o C
Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю. Значения некоторых стандартных электродных потенциалов приведены в таблице 12.1.
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов:
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов:
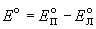
Для элемента Даниэля стандартная ЭДС равна
E o = E o (Cu 2+ /Cu) — E o (Zn 2+ /Zn) = +0.337 — (-0.763) = +1.100 В.
ЭДС элемента связана с 

Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
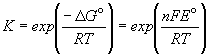
Константа равновесия реакции, протекающей в элементе Даниэля, равна
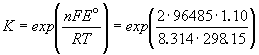
Зная температурный коэффициент ЭДС 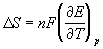




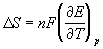
Таблица 12.1. Стандартные электродные потенциалы при 25 o С.
Электрод
Электродная реакция
E o , В
PbSO4 + 2H2O
Пример 12-1. Рассчитать стандартный электродный потенциал пары Cu 2+ /Cu + по данным таблицы 11.1 для пар Cu 2+ /Cu и Cu + /Cu.
Cu 2+ + 2e = Cu 
Cu + + e = Cu 
Cu 2+ + e = Cu + 
откуда E o = +0.153 В.
Пример 12-2. Составить схему гальванического элемента, в котором протекает реакция
Рассчитать стандартную ЭДС элемента при 25 o C, 
Ag | AgBr| Br — || Ag + | Ag
Правый электрод: Ag + + e = Ag E o = 0.7792 В
Левый электрод: AgBr + e = Ag + Br — E o = 0.0732 В
Общая реакция: Ag + + Br — = AgBr E o = 0.7260 В

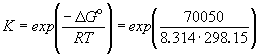
1/K= a(Ag + ) . a(Br — ) = m(Ag + ) . m(Br — ) . ( 
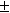

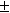
Отсюда, полагая 
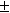
Пример 12-3. 

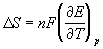



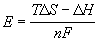
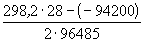
Ответ. 
12-1. Рассчитать стандартный электродный потенциал пары Fe 3+ /Fe по данным таблицы 12.1 для пар Fe 2+ /Fe и Fe 3+ /Fe 2+ . (ответ)
12-2. Рассчитать произведение растворимости и растворимость AgCl в воде при 25 o C по данным таблицы 12.1. (ответ)
12-3. Рассчитать произведение растворимости и растворимость Hg2Cl2 в воде при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-4. Рассчитать константу равновесия реакции диспропорционирования 2Cu + 
12-5. Рассчитать константу равновесия реакции ZnSO4 + Cd = CdSO4 + Zn при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-6. ЭДС элемента, в котором обратимо протекает реакция 0.5 Hg2Cl2 + Ag = AgCl + Hg, равна 0.456 В при 298 К и 0.439 В при 293 К. Рассчитать 


12-7. Вычислить тепловой эффект реакции Zn + 2AgCl = ZnCl2 + 2Ag, протекающей в гальваническом элементе при 273 К, если ЭДС элемента E= 1.015 В и температурный коэффициент ЭДС = — 4.02 . 10 -4 В . K -1 . (ответ)
12-8. В гальваническом элементе при температуре 298 К обратимо протекает реакция Cd + 2AgCl = CdCl2 + 2Ag. Рассчитать изменение энтропии реакции, если стандартная ЭДС элемента E o = 0.6753 В, а стандартные энтальпии образования CdCl2 и AgCl равны -389.7 и -126.9 кДж . моль -1 соответственно. (ответ)
12-9. ЭДС элемента Pt | H2 | HCl | AgCl | Ag при 25 o C равна 0.322 В. Чему равен pH раствора HCl . (ответ)
12-10. Растворимость Cu3(PO4)2 в воде при 25 o C равна 1.6 . 10 -8 моль . кг -1 . Рассчитать ЭДС элемента Pt | H2 | HCl (pH = 0) | Cu3(PO4)2 (насыщ. р-р) | Cu при 25 o C. (ответ)
12-11. Три гальванических элемента имеют стандартную ЭДС соответственно 0.01, 0.1 и 1.0 В при 25 o C. Рассчитать константы равновесия реакций, протекающих в этих элементах, если количество электронов для каждой реакции n = 1. (ответ)
12-12. ЭДС элемента Pt | H2 | HBr | AgBr | Ag в широком интервале температур описывается уравнением: E o (В) = 0.07131 — 4.99 . 10 -4 (T — 298) — 3.45 . 10 -6 (T — 298) 2 . Рассчитать 


12-13. Для измерения pH раствора можно применять хингидронный электрод. (Хингидрон, Q . QH2, представляет собой комплекс хинона, Q = C6H4O2, и гидрохинона, QH2 = C6H4O2H2). Электродная полуреакция записывается как Q + 2H + + 2e 
12-14. В гальваническом элементе обратимо протекает реакция CuSO4 + Zn = ZnSO4 + Cu. Рассчитать 

12-15. В элементе Вестона протекает реакция Cd + Hg2SO4 = Cd 2+ + 2Hg. Рассчитать ЭДС этого элемента при 303 K, если 

12-16. 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
🎥 Видео
Гальванические элементы. 1 часть. 10 класс.Скачать

Гальванический элементСкачать

Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

Электрохимия. Гальванический элемент Даниэля-ЯкобиСкачать

Гальванический элементСкачать

Гальванический элементСкачать

Гальванические элементы. Практическая часть. 10 класс.Скачать

Гальванические элементыСкачать
Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Составление схемы гальванического элемента. Вычисление потенциала свинцового электродаСкачать

Электролиз. 10 класс.Скачать

Гальванические элементы. 10 класс.Скачать

Составление схемы и вычисление ЭДС гальванического концентрационного элемента | Уравнение НернстаСкачать

Продукты в ОВР. Ч.2-3. Гальванический элемент.Скачать

Лабораторная работа "Гальванический элемент"Скачать

Технологический институт - гальванический элемент, электролиз, коррозия. Задачи.Скачать

Электродные потенциалы металлов. Электроды сравненияСкачать

ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТСкачать