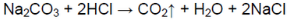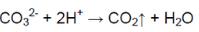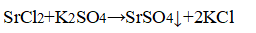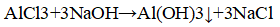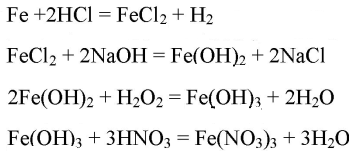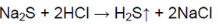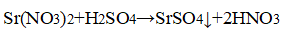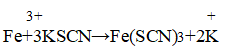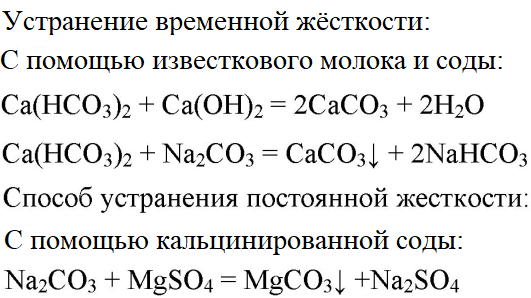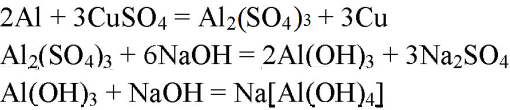- Ваш ответ
- решение вопроса
- Похожие вопросы
- Вопросы к параграфу 50 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 50. Практическая работа №7.
- Решение экспериментальных задач по теме: “Металлы”
- Вариант 1. Распознавание хлорида магния MgCl2, гидроксида натрия NaOH, карбоната натрия Na2CO3, нитрата натрия NaNO3 1. В четырёх пробирках даны следующие вещества в твёрдом виде: а) хлорид магния; 6) гидроксид натрия; в) карбонат натрия; г) нитрат натрия. При помощи химических реакций определите, в какой пробирке находится каждое из этих веществ.
- 2. При помощи характерных реакций докажите, что выданное вам вещество — сульфат алюминия.
- 3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ.
- 4. Практически осуществите следующие превращения:
- Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe(NO3)3
- Вариант 2. Распознавание карбоната кальция CaCO3, нитрата стронция Sr(NO3)2, сульфата натрия NaSO4, сульфида натрия Na2S. 1. В четырех пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ.
- 2. Докажите, что кристаллы сульфата железа (III) частично окислились и содержат примеси ионов Fe3+.
- 3. В двух склянках дана вода. В одной из них вода содержит сульфат магния, а в другой — гидрокарбонат кальция. Проделайте опыты, при помощи которых можно устранить постоянную и временную жёсткость воды.
- 4. Практически осуществите следующие превращения:
- Аl→Al2(SO4)3→Аl(ОН)3→Na[Al(OH)4]
- 5. Отчёт о работе оформите в произвольной форме.
- Контрольная работа по теме «Неметаллы»
- 💡 Видео
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Ваш ответ
Видео:Практическая работа №3 Приготовление раствора с определённой массовой долей растворённого веществаСкачать

решение вопроса
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Похожие вопросы
- Все категории
- экономические 43,399
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,960
- разное 16,854
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Распознавание органических веществ. 11 класс.Скачать

Вопросы к параграфу 50 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

§ 50. Практическая работа №7.
Решение экспериментальных задач по теме: “Металлы”
Вариант 1. Распознавание хлорида магния MgCl2, гидроксида натрия NaOH, карбоната натрия Na2CO3, нитрата натрия NaNO3 1. В четырёх пробирках даны следующие вещества в твёрдом виде: а) хлорид магния; 6) гидроксид натрия; в) карбонат натрия; г) нитрат натрия. При помощи химических реакций определите, в какой пробирке находится каждое из этих веществ.
Твёрдые вещества растворили в воде, далее прилили соляную кислоту.
В одной пробирке выделяется газ без цвета и запаха:
В пробирке — карбонат натрия.
К другим растворам добавили несколько капель фенолфталеина.
Содержимое одной из пробирок окрасилось с малиновый цвет.
В пробирке — гидроксид натрия (образует щелочную среду).
К оставшимся растворам добавили нитрат серебра.
В одной пробирке выпадает белый осадок:
В одной пробирке находится хлорид магния, в пробирке с осадком — нитрат натрия.
2. При помощи характерных реакций докажите, что выданное вам вещество — сульфат алюминия.
3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ.
К растворам добавили сульфат калия.
В одной пробирке выпадает белый осадок:
В пробирке — хлорид стронция.
К оставшимся растворам прилили раствор гидроксида натрия.
В пробирке — хлорид аллюминия. В пробирке с осадком — хлорид натрия.
4. Практически осуществите следующие превращения:
Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe(NO3)3
Вариант 2. Распознавание карбоната кальция CaCO3, нитрата стронция Sr(NO3)2, сульфата натрия NaSO4, сульфида натрия Na2S. 1. В четырех пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ.
Растворили твёрдые вещества и добавили к растворам соляную кислоту.
В пробирке вещество не растворилось в воде, после добавления соляной кислоты выделился газ без запаха и цвета:
В пробирке — карбонат кальция.
В другой пробирке выделяется газ с характерным запахом тухлых яиц:
В пробирке — сульфид натрия.
К остальным растворам прилили раствор серной кислоты.
В одной из пробирок выпадает белый осадок:
В пробирке — нитрид стронция, в пробирке с осадком — сульфат натрия.
2. Докажите, что кристаллы сульфата железа (III) частично окислились и содержат примеси ионов Fe3+.
Качественным реагентом на присутствие трёхвалентного железа является роданид калия. Появляется красное окрашивание.
3. В двух склянках дана вода. В одной из них вода содержит сульфат магния, а в другой — гидрокарбонат кальция. Проделайте опыты, при помощи которых можно устранить постоянную и временную жёсткость воды.
4. Практически осуществите следующие превращения:
Аl→Al2(SO4)3→Аl(ОН)3→Na[Al(OH)4]
5. Отчёт о работе оформите в произвольной форме.
Отчёт представлен выше (1,2,3,4 пункты каждого варианта).
Видео:Способы выражения состава растворовСкачать

Контрольная работа по теме «Неметаллы»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Контрольная работа по теме: «Неметаллы» 9 класс
1. Какова роль элементов подгруппы кислорода в жизнедеятельности живых организмов.
2. С какими из этих веществ будет взаимодействовать разбавленная азотная кислота: ZnO, CO 2 , Ag, NaOH, H 2 O, Na 2 CO 3 . Запишите уравнение реакций.
3. Осуществите превращение
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
4. К 150 г раствора карбоната натрия добавили избыток разбавленной серной кислоты, и раствор нагрели до окончания выделения газа. Всего выделилось 3,36 л газа (н. у.). Рассчитайте массовую долю карбоната натрия в исходном растворе
5*. Предположите план распознавания растворов: сульфата, хлорида и иодида натрия .
Контрольная работа по теме: «Неметаллы» 9 класс
1. Какова роль элементов подгруппы азота в жизнедеятельности живых организмов.
2. С какими из этих веществ будет взаимодействовать оксид серы (IV):
3. Дайте сравнительную характеристику простых веществ азота и фосфора, указав: а) строение их атомов, б) степени окисления, в) агрегатное состояние,г) химические свойства. Составьте уравнения реакций, дайте названия продуктам реакций.
4. К 250 г раствора карбоната натрия добавляли раствор хлорида бария до прекращения выделения осадка. Масса отфильтрованного и высушенного осадка составила 39,4 г. Рассчитайте массовую долю карбоната натрия в исходном растворе.
5*. Предположите план распознавания растворов: соляной, серной, азотной кислот . Запишите уравнения использованных реакций.
Контрольная работа по теме: «Неметаллы» 9 класс
1. Какова роль элементов подгруппы галогенов в жизнедеятельности живых организмов.
2. Осуществите превращения: S → H 2 S → SO 2 →SO 3 → Na 2 SO 4 →BaSO 4 Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для последнего превращения составьте сокращённое ионное уравнение реакции.
3. Дайте сравнительную характеристику простых веществ углерода и кремния, указав: а) строение их атомов, б) степени окисления, в) агрегатное состояние,г) химические свойства. Составьте уравнения реакций, дайте названия продуктам реакций.
4. К 125 г раствора серной кислоты добавили избыток гидрокарбоната натрия. Общий объём выделившегося газа составил 11,2 л (н. у.). Определите массовую долю серной кислоты в растворе.
5*. Предположите план распознавания растворов: фосфата, карбоната и гидроксида натрия . Запишите уравнения использованных реакций.
Контрольная работа по теме: «Неметаллы» 9 класс
1. Какова роль элементов подгруппы углерода в жизнедеятельности живых организмов.
2.Осуществите превращения: фосфор→ фосфид кальция → фосфин → фосфорная кислота→ фосфат бария→ хлорид бария
3. Определите, в каких реакциях сера является окислителем, а в каких восстановителем. Запишите уравнения реакций.
а) при взаимодействии с металлом;
б) при взаимодействии с водородом;
в) при взаимодействии с кислородом.
4. После пропускания 5,6 л сернистого газа через 400 г раствора гидроксида натрия получили раствор средней соли. Вычислите массовую долю гидроксида натрия в растворе.
5*. Предположите план распознавания растворов: сульфата, карбоната и хлорида калия . Запишите уравнения использованных реакций.
💡 Видео
Составление формул соединений. 8 класс.Скачать

Получение осадка сульфата бария | Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3Скачать

Молярная концентрация. 10 класс.Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Как решать задачи с МАССОВОЙ ДОЛЕЙ | Массовая доля растворенного веществаСкачать

Решение задач на массовую долю. Практическое занятие. Видеоурок 40. Химия 9 классСкачать

Способы выражения концентрации растворов. 8 класс.Скачать

Определение массовых долей элементов в соединениях. 8 класс.Скачать

Определение формулы органических соединений. 1 часть. Практическая часть - решение задачи. 9 класс.Скачать

131. Моляльная концентрация (моляльность). Решение задач.Скачать

Решение задач по теме "Растворы" | Химия, онлайн-форумСкачать

Проведение азопирамовой пробыСкачать

Способы выражения концентрации растворов. Практическая часть. 8 класс.Скачать