| Ацетат кальция | |
|---|---|
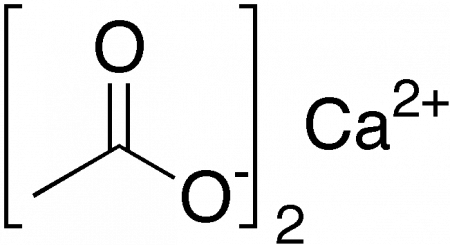 | |
| Систематическое наименование | Ацетат кальция |
| Сокращения | Ca(OAc)2 |
| Традиционные названия | Пригорело-древесная соль |
| Хим. формула | Ca(CH3COO)2 |
| Рац. формула | CaC4H6O4 |
| Состояние | твёрдое |
| Молярная масса | 158.138 г/моль |
| Плотность | 1.6 г/см³ |
| Температура | |
| • плавления | 160 (с разложением) |
| • разложения | 160 ± 1 °C |
| Растворимость | |
| • в воде | 40 г/100 мл |
| Рег. номер CAS | 62-54-4 |
| PubChem | 6116 |
| Рег. номер EINECS | 200-540-9 |
| SMILES | |
| Кодекс Алиментариус | E263 |
| RTECS | AF7525000 |
| ChEBI | 3310 |
| ChemSpider | 5890 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат кальция — кальциевая соль уксусной кислоты. Бесцветное кристаллическое или аморфное вещество, хорошо растворимое в воде. Технический моногидрат может быть в форме гранул или некрупных игл. Обладает слабым вкусом и запахом уксуса. Химическая формула — Ca(CH3COO)2, однако чаще получают его моногидрат Ca(CH3COO)2•H2O.
- Содержание
- История названия
- Получение
- Применение
- Пищевая промышленность
- Медицина
- Ацетат кальция
- Получение ацетата кальция
- Применение ацетата кальция в пищевой промышленности
- Вред ацетат кальция – пищевого консерванта Е263
- Acetyl
- Кальций: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- 🎬 Видео
Видео:Получение Ацетата Кальция. Ca(CH3COO)2. E263Скачать

Содержание
- 1 История названия
- 2 Получение
- 3 Применение
- 3.1 Пищевая промышленность
- 4 Медицина
Видео:Ацетат кальция и ацетонСкачать

История названия
Пригорело-древесная соль — старинное название ацетата кальция — в старину получалась при сухой перегонке древесины, из-за чего древесина, естественно, обугливалась, «пригорала». Из-за того, что метод сухой перегонки древесины использовался алхимиками с незапамятных времён, установить человека, давшего такое название этой соли или впервые получившего её, невозможно.
Видео:Получение ацетона из ацетата кальция / Getting acetone from calcium acetateСкачать

Получение
В лаборатории получают действием уксусной кислоты на карбонат, оксид или гидроксид кальция.
Видео:Получение солей ацетатовСкачать

Применение
Не имеет промышленного применения.
Используется в лаборатории для получения диметилкетона (ацетона). Эту реакцию осуществляют, нагревая ацетат кальция до 160 °С:
Именно из-за этой реакции ацетат кальция нельзя хранить или сушить вблизи открытого огня, а помещения, в которых происходят работы с ацетатом кальция, должны быть оборудованы приточно-вытяжной вентиляцией.
Также может применяться в лаборатории для получения сложных эфиров уксусной кислоты — алкилацетатов:
Также ацетат кальция используется для получения ацетата калия обменными реакциями из карбоната и/или бикарбоната калия:
Также ацетат кальция применяют при получении лавсана в качестве катализатора.
Ещё одним способом применения ацетата кальция является приготовление аналога сухого спирта — твёрдого спиртового сольвата ацетата кальция — при смешивании ацетата кальция и этилового спирта.
Пищевая промышленность
Ацетат кальция зарегистрирован в пищевой промышленности в качестве пищевой добавки группы консервантов E263. Может применяться как консервант, регулятор кислотности, уплотнитель растительных тканей. Останавливает развитие болезнетворных бактерий в хлебобулочных изделиях, смягчает ярко выраженный кислый вкус консервированных овощей и фруктов. В сельскохозяйственной промышленности используется для консервации кормов. Так как действие ацетата кальция ограничено наличием в продуктах сульфатов, фосфатов, карбонатов и гидрокарбонатов, которые в конечном итоге дают осадки с катионом Ca 2+ , то применять его лучше в сочетании с другими консервантами.
| Массовая доля основного вещества,безводная форма, %, не менее | 98 |
| Потери при просушке, %, не более | 11 |
| pH 10%-го водного раствора | 6-9 (включительно) |
| Массовая доля нерастворимых веществ, %, не более | 0,3 |
Видео:Получение ацетата натрия двумя способами. Наблюдение разного теплового эффектаСкачать

Медицина
Ацетат кальция оказывает абсорбирующее действие на анионы фосфорных кислот:
Также ацетат кальция восстанавливает положительный кальциевый баланс у больных с почечной недостаточностью в легкой, средней и тяжелой форме и у больных, находящихся на гемодиализе или перитонеальном диализе. Является безалюминиевым и безмагниевым фосфат-связывающим препаратом (фосфат-биндером). Фосфат-связывающая способность ацетата кальция в 2 раза выше, а всасываемость его в кишечнике значительно меньше, чем у кальция карбоната.
Видео:Реакция азотной кислоты и карбоната кальция, получение нитрата кальция/Obtaining calcium nitrateСкачать

Ацетат кальция
Ацетат кальция является химическим соединением – кальциевой солью уксусной кислоты, представляющей собой хорошо растворимое в воде бесцветное кристаллическое вещество с химической формулой (CH3COO)2Ca.
Ацетат кальция применяют:
- В химической промышленности – при производстве ацетона;
- В пищевой промышленности в качестве консерванта;
- При производстве кормов;
- В фармакологическом производстве – при производстве дезинфицирующих средств с сильными антимикробными и противовирусными свойствами.
Видео:Получение АЦЕТИЛЕНА. Получение КАРБИДА КАЛЬЦИЯ. Реакция КАРБИДА КАЛЬЦИЯ и ВОДЫ. Опыты по химии дома.Скачать

Получение ацетата кальция
Раньше это соединение имело название «пригорело-древесная соль». Это было связано со способом получения ацетата кальция, для чего использовали сухую перегонку древесины, вызывающую в большинстве случаев обугливание или пригорание.
В промышленных масштабах это соединение не производят. В лабораторных условиях получение ацетата кальция происходит воздействием уксусной кислоты на гидроксид, оксид или карбонат кальция.
Видео:Приготовление ацетата кальция / Preparation of calcium acetateСкачать

Применение ацетата кальция в пищевой промышленности
Ацетат кальция (Е263) относится к группе пищевых консервантов с индексом от E-200 до E-299, которые применяют для увеличения срока хранения продуктов, что происходит благодаря подавлению роста и размножения бактерий или грибков.

Помимо увеличения срока хранения, ацетат кальция также применяют в качестве регулятора кислотности и уплотнителя растительных тканей. Это соединение смягчает природный кислый вкус некоторых продуктов питания.
Наиболее широкое применение ацетат кальция (Е263) получил при производстве хлебобулочных изделий как средство для борьбы с «картофельной болезнью».
Данное заболевание чаще всего развивается в пшеничном хлебе на фоне сниженной кислотности и повышенной влажности при длительном хранении в теплом помещении, что способствует образованию в хлебе чрезмерного количества декстринов, альдегидов и других соединений с неприятным резким запахом. От этого мякоть хлеба становится липкой, что делает его непригодным для употребления в пищу.
Предотвратить развитие «картофельной болезни» в готовом хлебе невозможно, поскольку споры картофельной палочки термостойки. Поэтому ацетат кальция добавляют в муку в процессе замешивания теста.
Видео:Опыты по химии. Получение ацетилена и опыты с нимСкачать

Вред ацетат кальция – пищевого консерванта Е263
Доказано, что Е263 не оказывает канцерогенное, токсичное или ядовитое воздействие на человеческий организм. Однако основной вред этого пищевого консерванта заключается в его химическом составе, который небезопасен для людей с непереносимостью пищевых добавок.
Также согласно многим исследованиям ацетат кальция является мощным аллергеном, способным провоцировать приступы удушья и стойкие аллергические реакции. Однако исследованиями не выявлены предельно допустимые нормы ежедневного потребления Е263 в составе продуктов питания.
Таким образом, ацетат кальция в составе продуктов питания представляет опасность для людей с:
- Индивидуальной непереносимостью пищевых добавок;
- Аллергическими болезнями.
Также медики советуют родителям стараться исключать из детского рациона питания продукты, содержащие этот небезопасный консервант.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Видео:Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Практическая работа. Получение оксида углерода(IV) и изучение его свойств.Распознавание карбонатов.Скачать  Кальций: способы получения и химические свойстваКальций Ca — это щелочноземельный металл, серебристо-белый, пластичный, достаточно твердый. Реакционноспособный. Сильный восстановитель. Относительная молекулярная масса Mr = 40,078; относительная плотность для твердого и жидкого состояния d = 1,54; tпл = 842º C; tкип = 1495º C. Видео:Получение ацетиленаСкачать  Способ получения1. В результате электролиза жидкого хлорида кальция образуются кальций и хлор : 2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С образуя кальций и хлорид алюминия: 3CaCl2 + 2Al = 3Ca + 2AlCl3 3. В результате разложения гидрида кальция при температуре выше 1000º С образуется кальций и водород: 4. Оксид кальция взаимодействует с алюминием при 1200º С и образует кальций и алюминат кальция: 4CaO + 2Al = 3Ca + Ca(AlO2)2 Видео:Получение ацетата медиСкачать  Качественная реакцияКальций окрашивает пламя газовой горелки в коричнево-красный цвет. Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Химические свойства1. Кальций — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами : 1.1. Кальций взаимодействует с азотом при 200 — 450º С образуя нитрид кальция: 1.2. Кальций сгорает в кислороде (воздухе) при выше 300º С с образованием оксида кальция: 2Ca + O2 = 2CaO 1.3. Кальций активно реагирует при температуре 200 — 400º С с хлором, бромом и йодом . При этом образуются соответствующие соли : 1.4. С водородом кальций реагирует при температуре 500 — 700º C с образованием гидрида кальция: 1.5. В результате взаимодействия кальция и фтора при комнатной температуре образуется фторид кальция: 1.6. Кальций взаимодействует с серой при 150º С и образует сульфид кальция: Ca + S = CaS 1.7. В результате реакции между кальцием и фосфором при 350 — 450º С образуется фосфид кальция: 1.8. Кальций взаимодействует с углеродом (графитом) при 550º С и образует карбид кальция: Ca + 2C = CaC2 2. Кальций активно взаимодействует со сложными веществами: 2.1. Кальций при комнатной температуре реагирует с водой . Взаимодействие кальция с водой приводит к образованию гидроксида кальция и газа водорода: 2.2. Кальций взаимодействует с кислотами: 2.2.1. Кальций реагирует с разбавленной соляной кислотой, при этом образуются хлорид кальция и водород : Ca + 2HCl = CaCl2 + H2 ↑ 2.2.2. Реагируя с разбавленной азотной кислотой кальций образует нитрат кальция, оксид азота (I) и воду: если азотную кислоту еще больше разбавить, то образуются нитрат кальция, нитрат аммония и вода: 2.3. Кальций вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид кальция и гидрид кальция: если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид кальция и водород: 🎬 ВидеоПолучение алканов. 10 класс.Скачать  Получение ПЕРОКСИДА КАЛЬЦИЯ CaO2. Реакция ГИДРОКСИДА КАЛЬЦИЯ и ПЕРЕКИСИ ВОДОРОДА. Опыты по химииСкачать  10.2. Альдегиды и кетоны: Способы получения. ЕГЭ по химииСкачать  Получение нитрата кальция _ чрезвычайно гигроскопичное вещество!Скачать  Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать  ОФИЦИАЛЬНЫЙ ПРОБНИК ОТ ФИПИ! РАЗБОР ВАРИАНТА №1 ЕГКР ПО ХИМИИ 2024 | Катя СтрогановаСкачать  |


